Flagyl 200mg, 400mg Metronidazole Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Flagyl und wie wird es angewendet?
Flagyl ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome bakterieller Infektionen der Vagina, des Magens, der Leber, der Haut, der Gelenke, des Gehirns und der Atemwege. Flagyl kann allein oder mit anderen Medikamenten verwendet werden.
Flagyl ist ein mittelstarker CYP3A4-Hemmer der Nitroimidazole.
Welche Nebenwirkungen kann Flagyl 200 mg haben?
Flagyl 400 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Informieren Sie Ihren Arzt, wenn bei Ihnen schwerwiegende Nebenwirkungen von Flagyl auftreten, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Dies sind nicht alle möglichen Nebenwirkungen von Flagyl. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Um die Entwicklung arzneimittelresistenter Bakterien zu verringern und die Wirksamkeit von FLAGYL® und anderen antibakteriellen Arzneimitteln aufrechtzuerhalten, sollte FLAGYL® nur zur Behandlung oder Vorbeugung von Infektionen angewendet werden, die nachweislich oder mit starkem Verdacht auf Bakterien zurückzuführen sind.
WARNUNG
Metronidazol hat sich bei Mäusen und Ratten als krebserregend erwiesen (vgl VORSICHTSMASSNAHMEN ). Unnötiger Gebrauch des Arzneimittels sollte vermieden werden. Seine Verwendung sollte den in der beschriebenen Bedingungen vorbehalten bleiben INDIKATIONEN UND VERWENDUNG Abschnitt unten.
BEZEICHNUNG
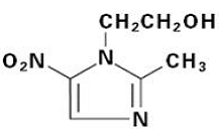
FLAGYL (Metronidazol) Tabletten, 250 mg oder 500 mg, ist eine orale Formulierung des synthetischen antimikrobiellen Nitroimidazols, 2-Methyl-5-nitro-1H-imidazol-1-ethanol, das die folgende Strukturformel hat:
FLAGYL (Metronidazol) Tabletten enthalten 250 mg oder 500 mg Metronidazol. Zu den inaktiven Bestandteilen gehören Zellulose, FD&C Blue No. 2 Lake, Hydroxypropylzellulose, Hypromellose, Polyethylenglycol, Stearinsäure und Titandioxid.
INDIKATIONEN
Symptomatische Trichomoniasis. FLAGYL ist angezeigt zur Behandlung von T. vaginalis-Infektionen bei Frauen und Männern, wenn das Vorhandensein der Trichomonaden durch geeignete Laborverfahren (Feuchtabstriche und/oder Kulturen) bestätigt wurde.
Asymptomatische Trichomoniasis. FLAGYL 400 mg ist indiziert zur Behandlung einer asymptomatischen T. vaginalis-Infektion bei Frauen, wenn der Organismus mit Endozervizitis, Zervizitis oder zervikaler Erosion einhergeht. Da es Hinweise gibt, dass das Vorhandensein von Trichomonaden die genaue Beurteilung abnormaler zytologischer Abstriche beeinträchtigen kann, sollten nach der Eradikation des Parasiten zusätzliche Abstriche durchgeführt werden.
Behandlung asymptomatischer Sexualpartner. T. vaginalis-Infektion ist eine Geschlechtskrankheit. Daher sollten asymptomatische Sexualpartner behandelter Patienten gleichzeitig behandelt werden, wenn der Erreger nachgewiesen wurde, um eine erneute Infektion des Partners zu verhindern. Die Entscheidung, ob ein asymptomatischer männlicher Partner mit einer negativen Kultur oder ein Partner, bei dem keine Kultur versucht wurde, behandelt werden soll, ist eine individuelle Entscheidung. Bei dieser Entscheidung sollte beachtet werden, dass es Hinweise darauf gibt, dass eine Frau erneut infiziert werden kann, wenn ihr Sexualpartner nicht behandelt wird. Da es auch beträchtliche Schwierigkeiten geben kann, den Organismus von dem asymptomatischen männlichen Träger zu isolieren, kann man sich in dieser Hinsicht nicht auf negative Abstriche und Kulturen verlassen. In jedem Fall sollte der Sexualpartner im Falle einer Reinfektion mit FLAGYL behandelt werden.
Amöbiasis. FLAGYL ist indiziert zur Behandlung von akuter intestinaler Amöbiasis (Amöbenruhr) und Amöbenleberabszess.
Bei einem Amöbenleberabszess beseitigt die FLAGYL-Therapie nicht die Notwendigkeit einer Aspiration oder Drainage von Eiter.
Anaerobe bakterielle Infektionen. FLAGYL 200 mg ist zur Behandlung schwerer Infektionen angezeigt, die durch anfällige anaerobe Bakterien verursacht werden. Indizierte chirurgische Eingriffe sollten in Verbindung mit der FLAGYL-Therapie durchgeführt werden. Bei einer gemischten aeroben und anaeroben Infektion sollten zusätzlich zu FLAGYL antimikrobielle Mittel verwendet werden, die für die Behandlung der aeroben Infektion geeignet sind.
INTRAABDOMINALE INFEKTIONEN, einschließlich Peritonitis, intraabdomineller Abszess und Leberabszess, verursacht durch Bacteroides-Spezies, einschließlich der B. fragilis-Gruppe (B. fragilis, B. distasonis, B. ovatus, B. thetaiotaomicron, B. vulgatus), Clostridium -Spezies, Eubacterium-Spezies, Peptococcus-Spezies und Peptostreptococcus-Spezies.
HAUT- UND HAUTSTRUKTUR-INFEKTIONEN, die durch Bacteroides-Spezies einschließlich der B. fragilis-Gruppe, Clostridium-Spezies, Peptococcus-Spezies, Peptostreptococcus-Spezies und Fusobacterium-Spezies verursacht werden.
GYNÄKOLOGISCHE INFEKTIONEN, einschließlich Endometritis, Endomyometritis, Tubo-Ovarial-Abszess und postoperative Vaginalmanschetteninfektion, verursacht durch Bacteroides-Spezies, einschließlich der B. fragilis-Gruppe, Clostridium-Spezies, Peptococcus-Spezies, Peptostreptococcus-Spezies und Fusobacterium-Spezies.
BAKTERIELLE SEPTIZÄMIE, verursacht durch Bacteroides-Spezies, einschließlich der B. fragilis-Gruppe und Clostridium-Spezies.
KNOCHEN- UND GELENKEINFEKTIONEN (als Begleittherapie), verursacht durch Bacteroides-Spezies, einschließlich der B. fragilis-Gruppe.
INFEKTIONEN DES ZENTRALEN NERVENSYSTEMS (ZNS), einschließlich Meningitis und Hirnabszess, verursacht durch Bacteroides-Spezies, einschließlich der B. fragilis-Gruppe.
INFEKTIONEN DER UNTEREN ATEMWEGE, einschließlich Lungenentzündung, Empyem und Lungenabszess, verursacht durch Bacteroides-Spezies, einschließlich der B. fragilis-Gruppe.
ENDOKARDITIS verursacht durch Bacteroides-Spezies einschließlich der B. fragilis-Gruppe.
Um die Entwicklung arzneimittelresistenter Bakterien zu verringern und die Wirksamkeit von FLAGYL 400 mg und anderen antibakteriellen Arzneimitteln aufrechtzuerhalten, sollte FLAGYL nur zur Behandlung oder Vorbeugung von Infektionen angewendet werden, die nachweislich oder mit starkem Verdacht auf empfindliche Bakterien zurückzuführen sind. Wenn Kultur- und Empfindlichkeitsinformationen verfügbar sind, sollten diese bei der Auswahl oder Änderung der antibakteriellen Therapie berücksichtigt werden. In Ermangelung solcher Daten können lokale Epidemiologie und Anfälligkeitsmuster zur empirischen Auswahl der Therapie beitragen.
DOSIERUNG UND ANWENDUNG
Trichomoniasis
Im Weibchen
Eintägige Behandlung – zwei Gramm FLAGYL, verabreicht entweder als Einzeldosis oder in zwei getrennten Dosen von jeweils einem Gramm, die am selben Tag verabreicht werden.
Siebentägiger Behandlungszyklus – 250 mg dreimal täglich an sieben aufeinanderfolgenden Tagen. Es gibt Hinweise aus kontrollierten Vergleichsstudien, dass die Heilungsraten, die anhand von Vaginalabstrichen und Anzeichen und Symptomen bestimmt werden, nach einem siebentägigen Behandlungszyklus höher sein können als nach einem eintägigen Behandlungsschema.
Das Dosierungsschema sollte individuell angepasst werden. Eine Einzeldosisbehandlung kann die Compliance sicherstellen, insbesondere wenn sie unter Aufsicht verabreicht wird, bei Patienten, bei denen nicht darauf vertraut werden kann, dass sie das siebentägige Regime fortsetzen. Eine siebentägige Behandlung kann eine Reinfektion minimieren, indem der Patient lange genug geschützt wird, damit die sexuellen Kontakte eine angemessene Behandlung erhalten. Darüber hinaus können einige Patienten ein Behandlungsschema besser vertragen als das andere.
Schwangere sollten während des ersten Trimesters nicht behandelt werden (siehe KONTRAINDIKATIONEN ). Bei schwangeren Patientinnen, bei denen eine alternative Behandlung unzureichend war, sollte die eintägige Therapie nicht angewendet werden, da sie zu höheren Serumspiegeln führt, die in den fötalen Kreislauf gelangen können (s VORSICHTSMASSNAHMEN , Schwangerschaft ).
Wenn Wiederholungszyklen des Arzneimittels erforderlich sind, wird empfohlen, zwischen den Zyklen ein Intervall von vier bis sechs Wochen einzuhalten und das Vorhandensein der Trichomonaden durch geeignete Labormessungen erneut zu bestätigen. Gesamt- und Differentialleukozytenzählungen sollten vor und nach einer erneuten Behandlung durchgeführt werden.
Beim Mann: Die Behandlung sollte wie bei der Frau individualisiert werden.
Amöbiasis
Erwachsene
Bei akuter intestinaler Amöbiasis (akute Amöbenruhr): 750 mg p.o. dreimal täglich für 5 bis 10 Tage.
Bei Amöbenleberabszess: 500 mg oder 750 mg p.o. dreimal täglich für 5 bis 10 Tage.
Pädiatrische Patienten: 35 bis 50 mg/kg/24 Stunden, aufgeteilt in drei Dosen, oral für 10 Tage.
Anaerobe bakterielle Infektionen
Bei der Behandlung der schwersten anaeroben Infektionen wird üblicherweise initial intravenös Metronidazol verabreicht.
Die übliche orale Dosierung für Erwachsene beträgt 7,5 mg/kg alle sechs Stunden (ca. 500 mg für einen 70-kg-Erwachsenen). Innerhalb von 24 Stunden sollten maximal 4 g nicht überschritten werden.
Die übliche Therapiedauer beträgt 7 bis 10 Tage; Infektionen der Knochen und Gelenke, der unteren Atemwege und des Endokards können jedoch eine längere Behandlung erfordern.
Dosisanpassungen
Patienten mit schwerer Leberfunktionsstörung
Bei Patienten mit schwerer Leberfunktionsstörung (Child-Pugh C) sollte die FLAGYL-Dosis um 50 % reduziert werden (siehe KLINISCHE PHARMAKOLOGIE und VORSICHTSMASSNAHMEN ).
Patienten, die sich einer Hämodialyse unterziehen
Die Hämodialyse entfernt erhebliche Mengen an Metronidazol und seinen Metaboliten aus dem systemischen Kreislauf. Die Clearance von Metronidazol hängt von der Art der verwendeten Dialysemembran, der Dauer der Dialysesitzung und anderen Faktoren ab. Wenn die Einnahme von Metronidazol nicht von der Hämodialysesitzung getrennt werden kann, sollte je nach klinischer Situation des Patienten eine Ergänzung der Metronidazol-Dosierung im Anschluss an die Hämodialysesitzung in Betracht gezogen werden (siehe KLINISCHE PHARMAKOLOGIE ).
WIE GELIEFERT
FLAGYL 250 mg Tabletten sind rund, blau, filmbeschichtet, mit der Prägung SEARLE und 1831 auf der einen Seite und FLAGYL und 250 auf der anderen Seite; Lieferung in 50er und 100er Flaschen.
FLAGYL 500 mg Tabletten sind länglich, blau, filmbeschichtet, mit der Prägung FLAGYL auf der einen Seite und 500 auf der anderen Seite; 50er und 100er Flaschen.
Lagerung und Stabilität
Unter 25 °C (77 °F) lagern und vor Licht schützen.
Vertrieb durch: Pfizer Labs, Division of Pfizre Inc., NY, NY 10017. Überarbeitet: Dez 2021
NEBENWIRKUNGEN
Die folgenden Reaktionen wurden während der Behandlung mit Metronidazol berichtet:
Zentrales Nervensystem
Die schwerwiegendsten Nebenwirkungen, die bei mit Metronidazol behandelten Patienten berichtet wurden, waren Krampfanfälle, Enzephalopathie, aseptische Meningitis, optische und periphere Neuropathie, wobei letztere hauptsächlich durch Taubheit oder Parästhesie einer Extremität gekennzeichnet war. Da bei einigen Patienten unter längerer Anwendung von Metronidazol über anhaltende periphere Neuropathie berichtet wurde, sollten die Patienten besonders vor diesen Reaktionen gewarnt und angewiesen werden, das Medikament abzusetzen und sofort ihren Arzt zu benachrichtigen, wenn irgendwelche neurologischen Symptome auftreten. Darüber hinaus haben Patienten über Kopfschmerzen, Synkopen, Schwindel, Schwindel, Koordinationsstörungen, Ataxie, Verwirrtheit, Dysarthrie, Reizbarkeit, Depression, Schwäche und Schlaflosigkeit berichtet (vgl WARNUNGEN ).
Magen-Darm
Die am häufigsten berichteten Nebenwirkungen betrafen den Gastrointestinaltrakt, insbesondere Übelkeit, manchmal begleitet von Kopfschmerzen, Anorexie und gelegentlich Erbrechen; Durchfall; epigastrische Not; und Bauchkrämpfe und Verstopfung.
Mund
Ein scharfer, unangenehmer metallischer Geschmack ist nicht ungewöhnlich. Fellzunge, Glossitis und Stomatitis sind aufgetreten; diese können mit einem plötzlichen übermäßigen Wachstum von Candida einhergehen, das während der Therapie auftreten kann.
Dermatologisch
Erythematöser Ausschlag und Juckreiz.
Hämatopoetisch
Reversible Neutropenie (Leukopenie); selten reversible Thrombozytopenie.
Herz-Kreislauf
QT-Verlängerung wurde berichtet, insbesondere wenn Metronidazol zusammen mit Arzneimitteln verabreicht wurde, die das QT-Intervall verlängern können. Eine Abflachung der T-Welle kann in elektrokardiographischen Aufzeichnungen gesehen werden.
Überempfindlichkeit
Urtikaria, erythematöser Ausschlag, Stevens-Johnson-Syndrom, toxische epidermale Nekrolyse, Hitzegefühl, verstopfte Nase, Mundtrockenheit (oder Vagina oder Vulva) und Fieber.
Nieren
Dysurie, Zystitis, Polyurie, Inkontinenz und ein Druckgefühl im Beckenbereich. Fälle von dunklem Urin wurden von etwa einem Patienten von 100.000 berichtet. Obwohl das Pigment, das wahrscheinlich für dieses Phänomen verantwortlich ist, nicht eindeutig identifiziert wurde, ist es mit ziemlicher Sicherheit ein Metabolit von Metronidazol und scheint keine klinische Bedeutung zu haben.
Leber
Fälle von schwerer irreversibler Hepatotoxizität/akutem Leberversagen, einschließlich Fällen mit tödlichem Ausgang und sehr schnellem Einsetzen nach Beginn der systemischen Anwendung von Metronidazol, wurden bei Patienten mit Cockayne-Syndrom berichtet (Latenz von der Einnahme des Medikaments bis zu Anzeichen von Leberversagen nur 2 Tage). ) (sehen KONTRAINDIKATIONEN ).
Sonstiges
Proliferation von Candida in der Vagina, Dyspareunie, Abnahme der Libido, Proktitis und flüchtige Gelenkschmerzen, die manchmal einer „Serumkrankheit“ ähneln. Es wurde über seltene Fälle von Pankreatitis berichtet, die im Allgemeinen nach Absetzen des Arzneimittels abklang.
Bei Patienten mit Morbus Crohn ist bekannt, dass sie häufiger an gastrointestinalen und bestimmten extraintestinalen Krebsarten erkranken. In der medizinischen Literatur gibt es einige Berichte über Brust- und Dickdarmkrebs bei Patienten mit Morbus Crohn, die über einen längeren Zeitraum mit Metronidazol in hohen Dosen behandelt wurden. Eine Ursache-Wirkungs-Beziehung wurde nicht hergestellt. Morbus Crohn ist keine zugelassene Indikation für FLAGYL 200 mg Tabletten.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Disulfiram
Bei alkoholkranken Patienten, die gleichzeitig Metronidazol und Disulfiram anwenden, wurde über psychotische Reaktionen berichtet. Metronidazol sollte nicht an Patienten verabreicht werden, die Disulfiram innerhalb der letzten zwei Wochen eingenommen haben (siehe KONTRAINDIKATIONEN ).
Alkoholische Getränke
Bauchkrämpfe, Übelkeit, Erbrechen, Kopfschmerzen und Hitzegefühl können auftreten, wenn alkoholische Getränke oder Produkte, die Propylenglykol enthalten, während oder nach einer Metronidazol-Therapie konsumiert werden (siehe KONTRAINDIKATIONEN ).
Warfarin und andere orale Antikoagulanzien
Es wurde berichtet, dass Metronidazol die gerinnungshemmende Wirkung von Warfarin und anderen oralen Cumarin-Antikoagulanzien verstärkt, was zu einer Verlängerung der Prothrombinzeit führt. Wenn FLAGYL Patienten unter dieser Art von Antikoagulanzientherapie verschrieben wird, sollten Prothrombinzeit und INR sorgfältig überwacht werden.

Lithium
Bei Patienten, die mit relativ hohen Lithiumdosen stabilisiert wurden, wurde eine Kurzzeittherapie mit Metronidazol mit einem Anstieg des Serumlithiums und in einigen Fällen mit Anzeichen einer Lithiumtoxizität in Verbindung gebracht. Die Serum-Lithium- und Serum-Kreatininspiegel sollten einige Tage nach Beginn der Metronidazol-Behandlung bestimmt werden, um einen Anstieg zu erkennen, der den klinischen Symptomen einer Lithium-Intoxikation vorausgehen kann.
Busulfan
Es wurde berichtet, dass Metronidazol die Plasmakonzentrationen von Busulfan erhöht, was zu einem erhöhten Risiko für eine schwere Busulfan-Toxizität führen kann. Metronidazol sollte nicht gleichzeitig mit Busulfan verabreicht werden, es sei denn, der Nutzen überwiegt das Risiko. Wenn keine therapeutischen Alternativen zu Metronidazol verfügbar sind und die gleichzeitige Anwendung mit Busulfan aus medizinischen Gründen erforderlich ist, sollte die Busulfan-Plasmakonzentration häufig überwacht und die Busulfan-Dosis entsprechend angepasst werden.
Medikamente, die CYP450-Enzyme hemmen
Die gleichzeitige Verabreichung von Arzneimitteln, die die mikrosomale Leberenzymaktivität verringern, wie Cimetidin, kann die Halbwertszeit verlängern und die Plasmaclearance von Metronidazol verringern.
Medikamente, die CYP450-Enzyme induzieren
Die gleichzeitige Verabreichung von Arzneimitteln, die mikrosomale Leberenzyme induzieren, wie Phenytoin oder Phenobarbital, kann die Elimination von Metronidazol beschleunigen, was zu verringerten Plasmaspiegeln führt; Es wurde auch über eine beeinträchtigte Clearance von Phenytoin berichtet.
Medikamente, die das QT-Intervall verlängern
QT-Verlängerung wurde berichtet, insbesondere wenn Metronidazol zusammen mit Arzneimitteln verabreicht wurde, die das QT-Intervall verlängern können.
WARNUNGEN
Auswirkungen auf das zentrale und periphere Nervensystem
Enzephalopathie und periphere Neuropathie: Unter Metronidazol wurden Fälle von Enzephalopathie und peripherer Neuropathie (einschließlich Optikusneuropathie) berichtet.
Enzephalopathie wurde im Zusammenhang mit zerebellärer Toxizität, gekennzeichnet durch Ataxie, Schwindel und Dysarthrie, berichtet. ZNS-Läsionen, die im MRT gesehen wurden, wurden in Berichten über Enzephalopathie beschrieben. ZNS-Symptome sind im Allgemeinen innerhalb von Tagen bis Wochen nach Absetzen von Metronidazol reversibel. ZNS-Läsionen, die im MRT gesehen wurden, wurden auch als reversibel beschrieben.
Periphere Neuropathie, hauptsächlich sensorischer Art, wurde berichtet und ist durch Taubheit oder Parästhesien einer Extremität gekennzeichnet.
Krampfanfälle wurden bei mit Metronidazol behandelten Patienten berichtet.
Aseptische Meningitis: Unter Metronidazol wurden Fälle von aseptischer Meningitis berichtet. Die Symptome können innerhalb von Stunden nach Verabreichung der Dosis auftreten und klingen im Allgemeinen nach Absetzen der Metronidazol-Therapie ab.
Das Auftreten von abnormen neurologischen Anzeichen und Symptomen erfordert die unverzügliche Bewertung des Nutzen-Risiko-Verhältnisses der Fortsetzung der Therapie (vgl NEBENWIRKUNGEN ).
VORSICHTSMASSNAHMEN
Allgemein
Leberfunktionsstörung
Patienten mit eingeschränkter Leberfunktion metabolisieren Metronidazol langsam, was zu einer Akkumulation von Metronidazol im Plasma führt. Für Patienten mit schwerer Leberfunktionsstörung (Child-Pugh C) wird eine reduzierte Dosis von FLAGYL 400 mg empfohlen. Bei Patienten mit leichter bis mittelschwerer Leberfunktionsstörung ist keine Dosisanpassung erforderlich, aber diese Patienten sollten auf Metronidazol-assoziierte Nebenwirkungen überwacht werden (s KLINISCHE PHARMAKOLOGIE und DOSIERUNG UND ANWENDUNG ).
Nierenfunktionsstörung
Patienten mit einer Nierenerkrankung im Endstadium können Metronidazol und seine Metaboliten langsam mit dem Urin ausscheiden, was zu einer signifikanten Akkumulation von Metronidazol-Metaboliten führt. Eine Überwachung auf Metronidazol-assoziierte unerwünschte Ereignisse wird empfohlen (siehe KLINISCHE PHARMAKOLOGIE ).
Pilz-Superinfektionen
Bekannte oder bisher nicht erkannte Candidiasis kann während der Therapie mit FLAGYL stärkere Symptome zeigen und erfordert eine Behandlung mit einem Candida-Wirkstoff.
Anwendung bei Patienten mit Blutdyskrasien
Metronidazol ist ein Nitroimidazol und sollte bei Patienten mit Anzeichen oder Vorgeschichte einer Blutdyskrasie mit Vorsicht angewendet werden. Während der Verabreichung wurde eine leichte Leukopenie beobachtet; In klinischen Studien wurden jedoch keine anhaltenden hämatologischen Anomalien beobachtet, die auf Metronidazol zurückzuführen sind. Gesamt- und Differentialleukozytenzahlen werden vor und nach der Therapie empfohlen.
Arzneimittelresistente Bakterien und Parasiten
Die Verschreibung von FLAGYL ohne nachgewiesene oder dringend vermutete bakterielle oder parasitäre Infektion oder ohne prophylaktische Indikation bringt dem Patienten wahrscheinlich keinen Nutzen und erhöht das Risiko der Entwicklung arzneimittelresistenter Bakterien und Parasiten.
Arzneimittel-/Labortest-Wechselwirkungen
Metronidazol kann bestimmte Arten von Bestimmungen der Serumchemiewerte stören, wie z. B. Aspartataminotransferase (AST, SGOT), Alaninaminotransferase (ALT, SGPT), Laktatdehydrogenase (LDH), Triglyceride und Glucosehexokinase. Werte von Null können beobachtet werden. Alle Assays, bei denen Interferenzen berichtet wurden, umfassen eine enzymatische Kopplung des Assays an die Oxidations-Reduktion von Nicotinamid-Adenin-Dinukleotid (NAD + NADH). Die Interferenz ist auf die Ähnlichkeit der Extinktionspeaks von NADH (340 nm) und Metronidazol (322 nm) bei pH 7 zurückzuführen.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
In mehreren Studien mit Metronidazol bei Ratten und Mäusen, jedoch nicht bei Hamstern, wurden Tumore festgestellt, die Leber, Lunge, Brust- und lymphatisches Gewebe betreffen.
Lungentumoren wurden in allen sechs berichteten Studien an Mäusen beobachtet, einschließlich einer Studie, in der die Tiere intermittierend behandelt wurden (Verabreichung nur alle vier Wochen). Bösartige Lebertumore traten bei männlichen Mäusen, die mit etwa 1500 mg/m² behandelt wurden (ähnlich der maximal empfohlenen Tagesdosis, basierend auf Vergleichen der Körperoberfläche), vermehrt auf. Maligne Lymphome und pulmonale Neoplasmen wurden auch erhöht, wenn das Medikament lebenslang an Mäuse verfüttert wurde. Mamma- und Lebertumoren waren bei weiblichen Ratten, denen Metronidazol oral verabreicht wurde, im Vergleich zu gleichzeitigen Kontrollen erhöht. Es wurden zwei lebenslange Tumorigenitätsstudien an Hamstern durchgeführt und als negativ gemeldet.
Metronidazol hat in In-vitro-Testsystemen einschließlich des Ames-Tests mutagene Aktivität gezeigt. In-vivo-Studien an Säugetieren konnten kein Potenzial für genetische Schäden nachweisen.
Metronidazol verursachte bei männlichen Ratten bei Dosen von bis zu 400 mg/kg/Tag (ähnlich der maximal empfohlenen klinischen Dosis, basierend auf Vergleichen der Körperoberfläche) über 28 Tage keine nachteiligen Wirkungen auf die Fertilität oder Hodenfunktion. Ratten, die 6 Wochen oder länger mit der gleichen Dosis behandelt wurden, waren jedoch unfruchtbar und zeigten eine schwere Degeneration des Hodenepithels in den Hoden sowie eine deutliche Abnahme der Hoden- und Nebenhodenspermienzahl. Die Fertilität wurde bei den meisten Ratten nach einer achtwöchigen arzneimittelfreien Erholungsphase wiederhergestellt.
Schwangerschaft
Teratogene Wirkungen
Es liegen keine angemessenen und gut kontrollierten Studien zu FLAGYL bei Schwangeren vor. Es liegen veröffentlichte Daten aus Fall-Kontroll-Studien, Kohortenstudien und 2 Metaanalysen vor, die mehr als 5000 schwangere Frauen umfassen, die während der Schwangerschaft Metronidazol angewendet haben. Viele Studien umfassten Expositionen im ersten Trimester. Eine Studie zeigte ein erhöhtes Risiko für Lippenspalten mit oder ohne Gaumenspalte bei Säuglingen, die Metronidazol in utero ausgesetzt waren; diese Feststellungen wurden jedoch nicht bestätigt. Darüber hinaus nahmen mehr als 5000 schwangere Frauen an mehr als zehn randomisierten placebokontrollierten klinischen Studien teil, um die Anwendung einer Antibiotikabehandlung (einschließlich Metronidazol) bei bakterieller Vaginose auf die Inzidenz von Frühgeburten zu bewerten. Die meisten Studien zeigten kein erhöhtes Risiko für angeborene Anomalien oder andere unerwünschte fetale Folgen nach einer Metronidazol-Exposition während der Schwangerschaft. Drei Studien, die durchgeführt wurden, um das Krebsrisiko bei Säuglingen nach Exposition gegenüber Metronidazol während der Schwangerschaft zu bewerten, zeigten kein erhöhtes Risiko; Die Fähigkeit dieser Studien, ein solches Signal nachzuweisen, war jedoch begrenzt.
Metronidazol passiert die Plazentaschranke und seine Auswirkungen auf die menschliche fötale Organogenese sind nicht bekannt. Reproduktionsstudien wurden an Ratten, Kaninchen und Mäusen mit Dosen durchgeführt, die der maximal empfohlenen Dosis beim Menschen, basierend auf Vergleichen der Körperoberfläche, ähnelten. Es gab keine Hinweise auf eine Schädigung des Fötus durch Metronidazol.
Stillende Mutter
Metronidazol ist in der Muttermilch in Konzentrationen vorhanden, die den mütterlichen Serumspiegeln ähneln, und die Serumspiegel von Säuglingen können nahe oder vergleichbar mit den therapeutischen Spiegeln von Säuglingen sein. Aufgrund des für Metronidazol bei Maus und Ratte nachgewiesenen tumorigenen Potenzials
Studien sollte eine Entscheidung getroffen werden, ob das Stillen oder das Medikament abgesetzt werden soll, wobei die Bedeutung des Medikaments für die Mutter zu berücksichtigen ist. Alternativ kann sich eine stillende Mutter dafür entscheiden, Muttermilch für die Dauer der Metronidazol-Therapie und für 24 Stunden nach Therapieende abzupumpen und zu verwerfen und ihren Säugling mit gelagerter Muttermilch oder Säuglingsnahrung zu füttern.
Geriatrische Verwendung
Bei älteren geriatrischen Patienten wird eine Überwachung auf Metronidazol-assoziierte Nebenwirkungen empfohlen (s KLINISCHE PHARMAKOLOGIE , VORSICHTSMASSNAHMEN ). Eine verminderte Leberfunktion bei geriatrischen Patienten kann zu erhöhten Konzentrationen von Metronidazol führen, die eine Anpassung der Metronidazol-Dosierung erforderlich machen können (siehe DOSIERUNG UND ANWENDUNG ).
Pädiatrische Verwendung
Sicherheit und Wirksamkeit bei pädiatrischen Patienten wurden nicht nachgewiesen, mit Ausnahme der Behandlung von Amöbiasis.
ÜBERDOSIS
Orale Einzeldosen von Metronidazol von bis zu 15 g wurden bei Suizidversuchen und versehentlichen Überdosierungen berichtet. Zu den berichteten Symptomen gehören Übelkeit, Erbrechen und Ataxie.
Orales Metronidazol wurde als Strahlensensibilisator bei der Behandlung von bösartigen Tumoren untersucht. Neurotoxische Wirkungen, einschließlich Krampfanfälle und periphere Neuropathie, wurden nach 5 bis 7 Tagen bei Dosen von 6 bis 10,4 g jeden zweiten Tag berichtet.
Behandlung einer Überdosierung
Es gibt kein spezifisches Antidot für eine Metronidazol-Überdosierung; Daher sollte die Behandlung des Patienten aus einer symptomatischen und unterstützenden Therapie bestehen.
KONTRAINDIKATIONEN
Überempfindlichkeit
FLAGYL Tabletten sind kontraindiziert bei Patienten mit bekannter Überempfindlichkeit gegenüber Metronidazol oder anderen Nitroimidazol-Derivaten.
Bei Patientinnen mit Trichomoniasis ist FLAGYL 200 mg Tabletten während des ersten Schwangerschaftstrimesters kontraindiziert (siehe VORSICHTSMASSNAHMEN ).
Psychotische Reaktion mit Disulfiram
Die Anwendung von oralem Metronidazol ist bei alkoholkranken Patienten, die gleichzeitig Disulfiram einnahmen, mit psychotischen Reaktionen verbunden. Verabreichen Sie Metronidazol nicht an Patienten, die innerhalb der letzten zwei Wochen Disulfiram eingenommen haben (siehe VORSICHTSMASSNAHMEN , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ).
Wechselwirkung mit Alkohol
Die Anwendung von oralem Metronidazol ist mit einer Disulfiram-ähnlichen Reaktion auf Alkohol verbunden, einschließlich Bauchkrämpfe, Übelkeit, Erbrechen, Kopfschmerzen und Hitzewallungen. Unterbrechen Sie den Konsum von Alkohol oder Produkten, die Propylenglykol enthalten, während und für mindestens drei Tage nach der Therapie mit Metronidazol (siehe VORSICHTSMASSNAHMEN , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ).
Cockayne-Syndrom
FLAGYL 400 mg Tabletten sind bei Patienten mit Cockayne-Syndrom kontraindiziert. Schwere irreversible Hepatotoxizität/akutes Leberversagen mit tödlichem Ausgang wurden nach Beginn der Metronidazol-Behandlung bei Patienten mit Cockayne-Syndrom berichtet (vgl NEBENWIRKUNGEN ).
KLINISCHE PHARMAKOLOGIE
Absorption
Die Disposition von Metronidazol im Körper ist für orale und intravenöse Darreichungsformen ähnlich. Nach oraler Verabreichung wird Metronidazol gut resorbiert, wobei maximale Plasmakonzentrationen zwischen einer und zwei Stunden nach der Verabreichung auftreten.
Die Plasmakonzentrationen von Metronidazol sind proportional zur verabreichten Dosis. Die orale Verabreichung von 250 mg, 500 mg oder 2.000 mg führte zu maximalen Plasmakonzentrationen von 6 µg/ml, 12 µg/ml bzw. 40 µg/ml. Studien zeigen keine signifikanten Unterschiede in der Bioverfügbarkeit zwischen Männern und Frauen; Aufgrund von Gewichtsunterschieden sind die resultierenden Plasmaspiegel bei Männern jedoch im Allgemeinen niedriger.
Verteilung
Metronidazol ist die Hauptkomponente, die im Plasma erscheint, wobei auch geringere Mengen an Metaboliten vorhanden sind. Weniger als 20 % des zirkulierenden Metronidazols ist an Plasmaproteine gebunden. Metronidazol erscheint in Zerebrospinalflüssigkeit, Speichel und Muttermilch in ähnlichen Konzentrationen wie im Plasma. Bakterizide Konzentrationen von Metronidazol wurden auch im Eiter von Leberabszessen nachgewiesen.
Stoffwechsel/Ausscheidung
Der Hauptausscheidungsweg von Metronidazol und seinen Metaboliten verläuft über den Urin (60 % bis 80 % der Dosis), wobei die fäkale Ausscheidung 6 % bis 15 % der Dosis ausmacht. Die im Urin auftretenden Metaboliten resultieren hauptsächlich aus Seitenkettenoxidation [1-(β-Hydroxyethyl)-2-hydroxymethyl-5-nitroimidazol und 2-Methyl-5-nitroimidazol-1-ylessigsäure] und Glucuronid-Konjugation, bei unveränderter Metronidazol-Anrechnung für etwa 20 % der Gesamtsumme. Sowohl die Ausgangsverbindung als auch der Hydroxyl-Metabolit besitzen in vitro antimikrobielle Aktivität.
Die renale Clearance von Metronidazol beträgt etwa 10 ml/min/1,73 m². Die durchschnittliche Eliminationshalbwertszeit von Metronidazol beträgt bei gesunden Probanden acht Stunden.
Nierenfunktionsstörung
Eine eingeschränkte Nierenfunktion verändert die Pharmakokinetik einer Einzeldosis von Metronidazol nicht.
Patienten mit terminaler Niereninsuffizienz (ESRD; CLCR = 8,1±9,1 ml/min), die eine einzelne intravenöse Infusion von 500 mg Metronidazol erhielten, zeigten keine signifikante Veränderung der Metronidazol-Pharmakokinetik, hatten aber eine 2-fach höhere Cmax von Hydroxy-Metronidazol und 5 -fach höhere Cmax von Metronidazolacetat im Vergleich zu gesunden Probanden mit normaler Nierenfunktion (CLCR = 126 ± 16 ml/min). Daher wird aufgrund der möglichen Akkumulation von Metronidazol-Metaboliten bei ESRD-Patienten eine Überwachung auf Metronidazol-assoziierte Nebenwirkungen empfohlen (siehe VORSICHTSMASSNAHMEN ).
Wirkung der Dialyse
Nach einer einzelnen intravenösen Infusion oder oralen Dosis von 500 mg Metronidazol wurde die Clearance von Metronidazol bei ESRD-Patienten untersucht, die sich einer Hämodialyse oder einer kontinuierlichen ambulanten Peritonealdialyse (CAPD) unterzogen. Eine Hämodialysesitzung, die 4 bis 8 Stunden dauerte, entfernte 40 % bis 65 % der verabreichten Metronidazol-Dosis, abhängig von der Art der verwendeten Dialysatormembran und der Dauer der Dialysesitzung. Wenn die Verabreichung von Metronidazol nicht von der Dialysesitzung getrennt werden kann, sollte eine Ergänzung der Metronidazol-Dosis nach der Hämodialyse in Erwägung gezogen werden (siehe DOSIERUNG UND ANWENDUNG ). Eine 7,5-stündige Peritonealdialysesitzung entfernte etwa 10 % der verabreichten Metronidazol-Dosis. Bei ESRD-Patienten, die sich einer CAPD unterziehen, ist keine Anpassung der Metronidazol-Dosis erforderlich.
Leberfunktionsstörung
Nach einer einzelnen intravenösen Infusion von 500 mg Metronidazol war die mittlere AUC24 von Metronidazol bei Patienten mit schwerer (Child-Pugh C) Leberfunktionsstörung um 114 % und bei Patienten mit leichter (Child-Pugh A) Leberfunktionsstörung um 54 % bzw. 53 % höher. bzw. mäßiger (Child-Pugh B) Leberfunktionsstörung im Vergleich zu gesunden Kontrollpersonen. Bei diesen Patienten mit eingeschränkter Leberfunktion gab es keine signifikanten Veränderungen der AUC24 von Hydroxyl-Metronidazol. Bei Patienten mit schwerer Leberfunktionsstörung (Child-Pugh C) wird eine Reduktion der Metronidazol-Dosierung um 50 % empfohlen (vgl DOSIERUNG UND ANWENDUNG ). Bei Patienten mit leichter bis mittelschwerer Leberfunktionsstörung ist keine Dosisanpassung erforderlich. Patienten mit leichter bis mittelschwerer Leberfunktionsstörung sollten auf Metronidazol-assoziierte Nebenwirkungen überwacht werden (s VORSICHTSMASSNAHMEN und DOSIERUNG UND ANWENDUNG ).
Geriatrische Patienten
Nach einer oralen oder intravenösen Einzeldosis von 500 mg Metronidazol hatten Personen > 70 Jahre ohne offensichtliche Nieren- oder Leberfunktionsstörung eine um 40 % bis 80 % höhere mittlere AUC von Hydroxy-Metronidazol (aktiver Metabolit), ohne erkennbaren Anstieg des Mittelwerts AUC von Metronidazol (Ausgangssubstanz) im Vergleich zu jungen gesunden Kontrollpersonen VORSICHTSMASSNAHMEN ).
Pädiatrische Patienten
In einer Studie schienen Neugeborene eine verminderte Fähigkeit zur Ausscheidung von Metronidazol zu zeigen. Die Eliminationshalbwertszeit, gemessen während der ersten 3 Lebenstage, war umgekehrt proportional zum Gestationsalter. Bei Säuglingen mit einem Gestationsalter zwischen 28 und 40 Wochen lagen die entsprechenden Eliminationshalbwertszeiten zwischen 109 und 22,5 Stunden.
Mikrobiologie
Wirkmechanismus
Metronidazol, ein Nitroimidazol, übt antibakterielle Wirkungen in einer anaeroben Umgebung gegen die meisten obligaten Anaerobier aus. Sobald Metronidazol durch passive Diffusion in den Organismus gelangt und im Zytoplasma empfänglicher anaerober Bakterien aktiviert wird, wird es reduziert; Dieser Prozess umfasst intrazelluläre Elektronentransportproteine wie Ferredoxin, die Übertragung eines Elektrons auf die Nitrogruppe des Metronidazols und die Bildung eines kurzlebigen freien Nitrosoradikals. Aufgrund dieser Veränderung des Metronidazol-Moleküls wird ein Konzentrationsgradient erzeugt und aufrechterhalten, der den intrazellulären Transport des Medikaments fördert. Die reduzierte Form von Metronidazol und freie Radikale können mit DNA interagieren, was zu einer Hemmung der DNA-Synthese und dem DNA-Abbau führt, was zum Absterben der Bakterien führt. Der genaue Wirkungsmechanismus von Metronidazol ist unklar.
Widerstand
Gegen Metronidazol besteht die Möglichkeit einer Resistenzentwicklung.
Die Resistenz kann auf mehrere Mechanismen zurückzuführen sein, darunter eine verminderte Aufnahme des Arzneimittels, eine veränderte Reduktionseffizienz, eine Überexpression der Effluxpumpen, eine Inaktivierung des Arzneimittels und/oder eine verstärkte Reparatur von DNA-Schäden.
Metronidazol besitzt keine klinisch relevante Aktivität gegen fakultative Anaerobier oder obligate Aerobier.
Antimikrobielle Aktivität
Metronidazol hat sich sowohl in vitro als auch bei klinischen Infektionen als wirksam gegen die meisten Isolate der folgenden Bakterien erwiesen, wie im Abschnitt INDIKATIONEN UND ANWENDUNG beschrieben.
Gram-positive Anaerobier
Clostridium-Spezies Eubacterium-Spezies Peptococcus-Spezies Peptostreptococcus-Spezies
Gramnegative Aerobier
Bacteroides fragilis-Gruppe (B. fragilis, B. distasonis, B. ovatus, B. thetaiotaomicron, B. vulgatus) Fusobacterium-Spezies
Protozoale Parasiten
Entamoeba histolytica Trichomonas vaginalis
Die folgenden In-vitro-Daten sind verfügbar, ihre klinische Bedeutung ist jedoch nicht bekannt:
Metronidazol weist in vitro minimale Hemmkonzentrationen (MHK) von 8 mcg/ml oder weniger gegenüber den meisten (≥ 90 %) Isolaten der folgenden Bakterien auf; Die Sicherheit und Wirksamkeit von Metronidazol bei der Behandlung klinischer Infektionen durch diese Bakterien wurden jedoch nicht in angemessenen und gut kontrollierten klinischen Studien nachgewiesen.
Gramnegative Anaerobier
Bacteroides-fragilis-Gruppe (B. caccae, B. uniformis) Prevotella-Arten (P. bivia, P. buccae, P. disiens)
Empfindlichkeitsprüfung
Spezifische Informationen zu den Interpretationskriterien von Empfindlichkeitstests und zugehörigen Testmethoden und Qualitätskontrollstandards, die von der FDA für dieses Medikament anerkannt sind, finden Sie unter: https://www.fda.gov/STIC.
INFORMATIONEN ZUM PATIENTEN
Wechselwirkung mit Alkohol
Stellen Sie den Konsum von alkoholischen Getränken oder Produkten, die Propylenglykol enthalten, während der Einnahme von FLAGYL 400 mg und für mindestens drei Tage danach ein, da Bauchkrämpfe, Übelkeit, Erbrechen, Kopfschmerzen und Hitzegefühl auftreten können (siehe KONTRAINDIKATIONEN und VORSICHTSMASSNAHMEN , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ).
Behandlung von bakteriellen und parasitären Infektionen
Die Patienten sollten darauf hingewiesen werden, dass FLAGYL 400 mg nur zur Behandlung von bakteriellen und parasitären Infektionen angewendet werden sollte. FLAGYL 400 mg behandelt keine Virusinfektionen (z. B. Erkältung). Wenn FLAGYL zur Behandlung einer bakteriellen Infektion verschrieben wird, sollten die Patienten darüber aufgeklärt werden, dass sie sich zwar zu Beginn der Therapie besser fühlen, das Medikament jedoch genau nach Anweisung eingenommen werden sollte. Das Auslassen von Dosen oder das Nichtbeenden des vollständigen Therapieverlaufs kann (1) die Wirksamkeit der sofortigen Behandlung verringern und (2) die Wahrscheinlichkeit erhöhen, dass Bakterien Resistenzen entwickeln und in Zukunft nicht mehr mit FLAGYL 400 mg behandelbar sind.