Omnicef 300mg Cefdinir Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Omnicef und wie wird es angewendet?
Omnicef (Cefdinir) ist ein Cephalosporin-Antibiotikum, das zur Behandlung vieler verschiedener Arten von Infektionen verwendet wird, die durch Bakterien verursacht werden. Der Markenname Omnicef wird in den USA eingestellt. Omnicef ist in generischer Form erhältlich.
Was sind Nebenwirkungen von Omnicef?
Häufige Nebenwirkungen von Omnicef 300 mg sind:
Notiz: Diese Liste enthält möglicherweise nicht alle möglichen Nebenwirkungen.
Um die Entwicklung arzneimittelresistenter Bakterien zu verringern und die Wirksamkeit von OMNICEF 300 mg und anderen antibakteriellen Arzneimitteln aufrechtzuerhalten, sollte OMNICEF nur zur Behandlung oder Vorbeugung von Infektionen angewendet werden, die nachweislich oder mit starkem Verdacht auf Bakterien zurückzuführen sind.
BEZEICHNUNG
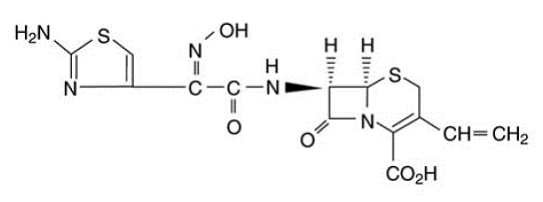
OMNICEF (Cefdinir) Kapseln und OMNICEF (Cefdinir) zur Herstellung einer Suspension zum Einnehmen enthalten den Wirkstoff Cefdinir, ein halbsynthetisches Cephalosporin mit erweitertem Wirkungsspektrum, zur oralen Verabreichung. Chemisch gesehen ist Cefdinir [6R-[6α, 7β (Z)]]-7-[[(2-Amino-4-thiazolyl)(hydroxyimino)acetyl]amino]3-ethenyl-8-oxo-5-thia-1 -azabicyclo[4.2.0]oct-2-en-2-carbonsäure. Cefdinir ist ein weißer bis leicht bräunlich-gelber Feststoff. Es ist leicht löslich in verdünnter Salzsäure und schwer löslich in 0,1 M pH 7,0 Phosphatpuffer. Die Summenformel lautet C14H13N5O5S2 und das Molekulargewicht beträgt 395,42. Cefdinir hat die unten gezeigte Strukturformel:
OMNICEF 300 mg Kapseln enthalten 300 mg Cefdinir und die folgenden Hilfsstoffe: Carboxymethylcellulose-Calcium, NF; Polyoxyl-40-stearat, NF; und Magnesiumstearat, NF. Die Kapselhüllen enthalten FD&C Blue #1; FD&C Rot Nr. 40; D&C Rot Nr. 28; Titandioxid, NF; Gelatine, NF; Siliziumdioxid, NF; und Natriumlaurylsulfat, NF.
OMNICEF 300 mg zur Herstellung einer Suspension zum Einnehmen enthält nach Rekonstitution 125 mg Cefdinir pro 5 ml oder 250 mg Cefdinir pro 5 ml und die folgenden Hilfsstoffe: Saccharose, NF; Zitronensäure, USP; Natriumcitrat, USP; Natriumbenzoat, NF; Xanthangummi, NF; Guarkernmehl, NF; künstliche Erdbeer- und Sahnearomen; Siliziumdioxid, NF; und Magnesiumstearat, NF.
INDIKATIONEN
Um die Entwicklung arzneimittelresistenter Bakterien zu verringern und die Wirksamkeit von OMNICEF 300 mg und anderen antibakteriellen Arzneimitteln aufrechtzuerhalten, sollte OMNICEF 300 mg nur zur Behandlung oder Vorbeugung von Infektionen angewendet werden, die nachweislich oder mit starkem Verdacht auf empfindliche Bakterien zurückzuführen sind. Wenn Kultur- und Empfindlichkeitsinformationen verfügbar sind, sollten diese bei der Auswahl oder Änderung der antibakteriellen Therapie berücksichtigt werden. In Ermangelung solcher Daten können lokale Epidemiologie und Anfälligkeitsmuster zur empirischen Auswahl der Therapie beitragen.
OMNICEF (Cefdinir) Kapseln und OMNICEF (Cefdinir) zur Herstellung einer Suspension zum Einnehmen sind für die Behandlung von Patienten mit leichten bis mittelschweren Infektionen angezeigt, die durch empfindliche Stämme der bezeichneten Mikroorganismen unter den unten aufgeführten Erkrankungen verursacht werden.
Erwachsene und Jugendliche
Ambulant erworbene Pneumonie
verursacht durch Haemophilus influenzae (einschließlich β-Lactamase-produzierender Stämme), Haemophilus parainfluenzae (einschließlich β-Lactamase-produzierender Stämme), Streptococcus pneumoniae (nur Penicillin-empfindliche Stämme) und Moraxella catarrhalis (einschließlich β-Lactamase-produzierender Stämme) (siehe Klinische Studien ).
Akute Exazerbationen einer chronischen Bronchitis
verursacht durch Haemophilus influenzae (einschließlich β-Lactamase-produzierender Stämme), Haemophilus parainfluenzae (einschließlich β-Lactamase-produzierender Stämme), Streptococcus pneumoniae (nur Penicillin-empfindliche Stämme) und Moraxella catarrhalis (einschließlich β-Lactamase-produzierender Stämme).
Akute Kieferhöhlenentzündung
verursacht durch Haemophilus influenzae (einschließlich β-Lactamase-produzierender Stämme), Streptococcus pneumoniae (nur Penicillin-empfindliche Stämme) und Moraxella catarrhalis (einschließlich β-Lactamase-produzierender Stämme).
HINWEIS: Informationen zur Anwendung bei pädiatrischen Patienten finden Sie unter Pädiatrische Verwendung und DOSIERUNG UND ANWENDUNG .
Pharyngitis/Mandelentzündung
verursacht durch Streptococcus pyogenes (vgl Klinische Studien ).
HINWEIS: Cefdinir ist bei der Eradikation von S. pyogenes aus dem Oropharynx wirksam. Cefdinir wurde jedoch nicht zur Vorbeugung von rheumatischem Fieber nach S.-pyogenes-Pharyngitis/Mandelentzündung untersucht. Nur intramuskuläres Penicillin hat sich als wirksam zur Vorbeugung von rheumatischem Fieber erwiesen.
Unkomplizierte Haut- und Hautstrukturinfektionen
verursacht durch Staphylococcus aureus (einschließlich β-Lactamase-produzierender Stämme) und Streptococcus pyogenes.
Pädiatrische Patienten
Akute bakterielle Mittelohrentzündung verursacht durch Haemophilus influenzae (einschließlich β-Lactamase-produzierender Stämme), Streptococcus pneumoniae (nur Penicillin-empfindliche Stämme) und Moraxella catarrhalis (einschließlich β-Lactamase-produzierender Stämme).
Pharyngitis/Mandelentzündung
verursacht durch Streptococcus pyogenes (vgl Klinische Studien ).
HINWEIS: Cefdinir ist bei der Eradikation von S. pyogenes aus dem Oropharynx wirksam. Cefdinir wurde jedoch nicht zur Vorbeugung von rheumatischem Fieber nach S.-pyogenes-Pharyngitis/Mandelentzündung untersucht. Nur intramuskuläres Penicillin hat sich als wirksam zur Vorbeugung von rheumatischem Fieber erwiesen.
Unkomplizierte Haut- und Hautstrukturinfektionen
verursacht durch Staphylococcus aureus (einschließlich β-Lactamase-produzierender Stämme) und Streptococcus pyogenes.
DOSIERUNG UND ANWENDUNG
(sehen INDIKATIONEN UND VERWENDUNG zum Angezeigte Krankheitserreger )
Kapseln
Die empfohlene Dosierung und Behandlungsdauer bei Infektionen bei Erwachsenen und Jugendlichen sind in der folgenden Tabelle beschrieben; die tägliche Gesamtdosis für alle Infektionen beträgt 600 mg. Eine einmal tägliche Dosierung über 10 Tage ist genauso wirksam wie eine zweimalige Dosierung. Die einmal tägliche Dosierung wurde bei Pneumonie oder Hautinfektionen nicht untersucht; Daher sollten OMNICEF-Kapseln bei diesen Infektionen zweimal täglich verabreicht werden. OMNICEF Kapseln können unabhängig von den Mahlzeiten eingenommen werden.
Erwachsene und Jugendliche (ab 13 Jahren)
Pulver zur oralen Suspension
Die empfohlene Dosierung und Dauer der Behandlung von Infektionen bei pädiatrischen Patienten sind in der folgenden Tabelle beschrieben; die tägliche Gesamtdosis für alle Infektionen beträgt 14 mg/kg bis zu einer Höchstdosis von 600 mg pro Tag. Eine einmal tägliche Dosierung über 10 Tage ist genauso wirksam wie eine zweimalige Dosierung. Die einmal tägliche Dosierung wurde bei Hautinfektionen nicht untersucht; Daher sollte OMNICEF 300 mg als Suspension zum Einnehmen bei dieser Infektion zweimal täglich verabreicht werden. OMNICEF zur oralen Suspension kann unabhängig von den Mahlzeiten verabreicht werden.
Pädiatrische Patienten (Alter 6 Monate bis 12 Jahre)
OMNICEF FÜR DIE ORALE SUSPENSION PÄDIATRISCHE DOSIERUNGSTABELLE
Patienten mit Niereninsuffizienz
Bei erwachsenen Patienten mit einer Kreatinin-Clearance
Die Kreatinin-Clearance ist bei ambulanten Patienten schwer zu messen. Die folgende Formel kann jedoch zur Schätzung der Kreatinin-Clearance (CLcr) bei erwachsenen Patienten verwendet werden. Damit die Schätzungen gültig sind, sollten die Serum-Kreatininspiegel die Steady-State-Spiegel der Nierenfunktion widerspiegeln.
wobei die Kreatinin-Clearance in ml/min, das Alter in Jahren, das Gewicht in Kilogramm und das Serum-Kreatinin in mg/dl angegeben ist.4
Die folgende Formel kann verwendet werden, um die Kreatinin-Clearance bei pädiatrischen Patienten abzuschätzen:
CLcr = K × Körperlänge oder Körpergröße/ Serumkreatinin
wobei K = 0,55 für pädiatrische Patienten älter als 1 Jahr5 und 0,45 für Säuglinge (bis zu 1 Jahr)6.
In der obigen Gleichung wird die Kreatinin-Clearance in ml/min/1,73 m², die Körperlänge oder -größe in Zentimetern und das Serumkreatinin in mg/dL angegeben.
Bei pädiatrischen Patienten mit einer Kreatinin-Clearance von
Patienten unter Hämodialyse
Hämodialyse entfernt Cefdinir aus dem Körper. Bei Patienten, die unter chronischer Hämodialyse bleiben, ist die empfohlene Initialdosis eine Dosis von 300 mg oder 7 mg/kg jeden zweiten Tag.
Am Ende jeder Hämodialysesitzung sollten 300 mg (oder 7 mg/kg) verabreicht werden. Nachfolgende Dosen (300 mg oder 7 mg/kg) werden dann jeden zweiten Tag verabreicht.
Anleitung zum Mischen von Omnicef 300 mg zur Herstellung einer Suspension zum Einnehmen
Nach dem Mischen kann die Suspension bei Raumtemperatur (25°C/77°F) gelagert werden. Das Behältnis sollte fest verschlossen bleiben und die Suspension vor jeder Verabreichung gut geschüttelt werden. Die Suspension kann 10 Tage lang verwendet werden, danach muss jede nicht verbrauchte Portion verworfen werden.
WIE GELIEFERT
OMNICEF-Kapseln , enthaltend 300 mg Cefdinir, als lavendelfarbene und türkisfarbene Kapseln mit dem Produktnamen bedruckt, sind wie folgt erhältlich:
60 Kapseln/Flasche NDC 0074-3769-60 OMNI-PAC™ Karton mit 3 Blisterpackungen mit 3 Einheiten der Anwendung, 5 Tage, 10 Kapseln NDC 0074-3769-30
OMNICEF 300 mg zur oralen Suspension ist eine cremefarbene Pulverformulierung, die nach vorschriftsmäßiger Rekonstitution 125 mg Cefdinir/5 ml oder 250 mg Cefdinir/5 ml enthält. Die rekonstituierten Suspensionen haben eine cremefarbene Farbe und einen Erdbeergeschmack. Das Pulver ist wie folgt erhältlich:
125 mg/5 ml
60-ml-Flaschen NDC 0074-3771-60 100-ml-Flaschen NDC 0074-3771-13 250 mg/5 ml 60-ml-Flaschen NDC 0074-6151-60 100-ml-Flaschen NDC 0074-6151-13
Lagern Sie die Kapseln und das nicht suspendierte Pulver bei 25 °C (77 °F); Abweichungen bis 15°-30°C (59°-86°F) zulässig [siehe USP Controlled Room Temperature]. Nach der Rekonstitution kann die Suspension zum Einnehmen 10 Tage lang bei kontrollierter Raumtemperatur aufbewahrt werden.
Hergestellt von: CEPH International Corporation Carolina, Puerto Rico 00986. Für: AbbVie Inc., North Chicago, IL 60064, USA, Unter Lizenz von: Astellas Pharma Inc. Tokio, Japan. Überarbeitet Nov. 2015
NEBENWIRKUNGEN
Nebenwirkungen
Klinische Studien – OMNICEF-Kapseln (Erwachsene und jugendliche Patienten)
In klinischen Studien wurden 5093 erwachsene und jugendliche Patienten (3841 in den USA und 1252 außerhalb der USA) mit der empfohlenen Dosis von Cefdinir-Kapseln (600 mg/Tag) behandelt. Die meisten Nebenwirkungen waren mild und selbstlimitierend. Cefdinir wurden keine Todesfälle oder dauerhaften Behinderungen zugeschrieben. Einhundertsiebenundvierzig von 5093 (3 %) Patienten brachen die Medikation aufgrund von Nebenwirkungen ab, die nach Meinung der Prüfärzte möglicherweise, wahrscheinlich oder definitiv mit der Cefdinir-Therapie in Zusammenhang stehen. Die Abbrüche erfolgten vor allem wegen Magen-Darm-Störungen, meist Durchfall oder Übelkeit. Neunzehn von 5093 (0,4 %) Patienten wurden aufgrund von überstürzten Gedanken im Zusammenhang mit der Verabreichung von Cefdinir abgesetzt.
In den USA wurden die folgenden Nebenwirkungen von den Prüfärzten als möglicherweise, wahrscheinlich oder definitiv im Zusammenhang mit Cefdinir-Kapseln in klinischen Studien mit Mehrfachdosierung angesehen (N = 3841 mit Cefdinir behandelte Patienten):
NEBENWIRKUNGEN IM ZUSAMMENHANG MIT CEFDINIR-KAPSELN US-STUDIEN MIT ERWACHSENEN UND JUGENDLICHEN PATIENTEN (N = 3841)a
Die folgenden Veränderungen der Laborwerte von möglicher klinischer Bedeutung, unabhängig vom Zusammenhang mit der Therapie mit Cefdinir, wurden während der in den USA durchgeführten klinischen Studien beobachtet:
BEOBACHTETE VERÄNDERUNGEN DES LABORWERTES MIT CEFDINIR-KAPSELN US-STUDIEN MIT ERWACHSENEN UND JUGENDLICHEN PATIENTEN (N = 3841)
Klinische Studien – OMNICEF zur oralen Suspension (pädiatrische Patienten)
In klinischen Studien wurden 2289 pädiatrische Patienten (1783 in den USA und 506 außerhalb der USA) mit der empfohlenen Dosis der Cefdinir-Suspension (14 mg/kg/Tag) behandelt. Die meisten Nebenwirkungen waren mild und selbstlimitierend. Cefdinir wurden keine Todesfälle oder dauerhaften Behinderungen zugeschrieben. Vierzig von 2289 (2 %) Patienten brachen die Medikation aufgrund von Nebenwirkungen ab, die von den Prüfärzten als möglicherweise, wahrscheinlich oder definitiv im Zusammenhang mit der Cefdinir-Therapie angesehen wurden. Abbrüche erfolgten hauptsächlich wegen Magen-Darm-Störungen, meist Durchfall. Fünf von 2289 (0,2 %) Patienten wurden wegen überstürzter Gedanken im Zusammenhang mit der Verabreichung von Cefdinir abgesetzt.
In den USA wurden die folgenden Nebenwirkungen von den Prüfärzten als möglicherweise, wahrscheinlich oder definitiv im Zusammenhang mit der Cefdinir-Suspension in klinischen Studien mit Mehrfachdosierung angesehen (N = 1783 mit Cefdinir behandelte Patienten):
UNERWÜNSCHTE EREIGNISSE IM ZUSAMMENHANG MIT US-STUDIEN MIT CEFDINIR-SUSPENSION BEI PÄDIATRISCHEN PATIENTEN (N = 1783)a
HINWEIS: Sowohl bei den mit Cefdinir als auch bei den Kontrollpatienten behandelten Patienten war die Häufigkeit von Durchfall und Hautausschlag bei den jüngsten pädiatrischen Patienten höher. Die Inzidenz von Durchfall bei mit Cefdinir behandelten Patienten im Alter von ≤ 2 Jahren betrug 17 % (95/557) im Vergleich zu 4 % (51/1226) bei Patienten im Alter von > 2 Jahren. Die Inzidenz von Hautausschlag (hauptsächlich Windelausschlag bei jüngeren Patienten) betrug 8 % (43/557) bei Patienten im Alter von ≤ 2 Jahren im Vergleich zu 1 % (8/1226) bei Patienten im Alter von > 2 Jahren.
Die folgenden Veränderungen der Laborwerte von möglicher klinischer Bedeutung, unabhängig vom Zusammenhang mit der Therapie mit Cefdinir, wurden während der in den USA durchgeführten klinischen Studien beobachtet:
VERÄNDERUNGEN DES LABORWERTS VON MÖGLICHER KLINISCHER BEDEUTUNG, BEOBACHTET BEI US-STUDIEN MIT CEFDINIR-SUSPENSION BEI PÄDIATRISCHEN PATIENTEN (N = 1783)
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen und veränderten Labortests, unabhängig von ihrem Zusammenhang mit Cefdinir, wurden während umfangreicher Erfahrungen nach der Markteinführung, beginnend mit der Zulassung in Japan im Jahr 1991, berichtet: Schock, Anaphylaxie mit seltenen Todesfällen, Gesichts- und Kehlkopfödem, Erstickungsgefühl, Serumkrankheitsähnliche Reaktionen, Konjunktivitis, Stomatitis, Stevens-Johnson-Syndrom, toxische epidermale Nekrolyse, exfoliative Dermatitis, Erythema multiforme, Erythema nodosum, akute Hepatitis, Cholestase, fulminante Hepatitis, Leberversagen, Gelbsucht, erhöhte Amylase, akute Enterokolitis, blutiger Durchfall, hämorrhagische Kolitis, Meläna, pseudomembranöse Kolitis, Panzytopenie, Granulozytopenie, Leukopenie, Thrombozytopenie, idiopathische thrombozytopenische Purpura, hämolytische Anämie, akute Ateminsuffizienz, Asthmaanfall, arzneimittelinduzierte Pneumonie, eosinophile Pneumonie, idiopathische interstitielle Pneumonie, Fieber, akutes Nierenversagen, Nephropathie, Blutungsneigung, Koagulationsdis Ordnung, disseminierte intravaskuläre Gerinnung, Blutung im oberen Gastrointestinaltrakt, Magengeschwür, Ileus, Bewusstlosigkeit, allergische Vaskulitis, mögliche Cefdinir-Diclofenac-Wechselwirkung, Herzinsuffizienz, Brustschmerzen, Myokardinfarkt, Bluthochdruck, unwillkürliche Bewegungen und Rhabdomyolyse.
Nebenwirkungen der Cephalosporin-Klasse
Die folgenden unerwünschten Ereignisse und veränderten Labortests wurden für Antibiotika der Cephalosporin-Klasse im Allgemeinen berichtet:
Allergische Reaktionen, Anaphylaxie, Stevens-Johnson-Syndrom, Erythema multiforme, toxische epidermale Nekrolyse, Nierenfunktionsstörung, toxische Nephropathie, Leberfunktionsstörung einschließlich Cholestase, aplastische Anämie, hämolytische Anämie, Blutung, falsch-positiver Test auf Glukose im Urin, Neutropenie, Panzytopenie und Agranulozytose . Pseudomembranöse Kolitis-Symptome können während oder nach einer Antibiotikabehandlung auftreten (vgl WARNUNGEN ).
Mehrere Cephalosporine wurden mit der Auslösung von Krampfanfällen in Verbindung gebracht, insbesondere bei Patienten mit eingeschränkter Nierenfunktion, wenn die Dosis nicht reduziert wurde (vgl DOSIERUNG UND ANWENDUNG und ÜBERDOSIERUNG ). Wenn im Zusammenhang mit der medikamentösen Therapie Krampfanfälle auftreten, sollte das Medikament abgesetzt werden. Bei klinischer Indikation kann eine antikonvulsive Therapie gegeben werden.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Antazida (aluminium- oder magnesiumhaltig)
Die gleichzeitige Verabreichung von 300-mg-Cefdinir-Kapseln mit 30 ml Maalox® TC-Suspension verringert die Geschwindigkeit (Cmax) und das Ausmaß (AUC) der Resorption um etwa 40 %. Die Zeit bis zum Erreichen von Cmax verlängert sich ebenfalls um 1 Stunde. Es gibt keine signifikanten Auswirkungen auf die Pharmakokinetik von Cefdinir, wenn das Antazida 2 Stunden vor oder 2 Stunden nach Cefdinir verabreicht wird. Wenn während der Behandlung mit OMNICEF 300 mg Antazida erforderlich sind, sollte OMNICEF 300 mg mindestens 2 Stunden vor oder nach dem Antazida eingenommen werden.
Probenecid
Wie andere β-Lactam-Antibiotika hemmt Probenecid die renale Ausscheidung von Cefdinir, was zu einer ungefähren Verdopplung der AUC, einem 54 %igen Anstieg der Cefdinir-Plasmaspiegel und einer 50 %igen Verlängerung der scheinbaren Eliminations-t½ führt.
Eisenpräparate und mit Eisen angereicherte Lebensmittel
Die gleichzeitige Verabreichung von Cefdinir mit einem therapeutischen Eisenergänzungsmittel, das 60 mg elementares Eisen (als FeSO4) enthielt, oder Vitaminen, die mit 10 mg elementarem Eisen ergänzt wurden, verringerte das Ausmaß der Resorption um 80 % bzw. 31 %. Wenn während der Therapie mit OMNICEF 300 mg eine Eisenergänzung erforderlich ist, sollte OMNICEF mindestens 2 Stunden vor oder nach der Ergänzung eingenommen werden.
Die Wirkung von Lebensmitteln, die stark mit elementarem Eisen angereichert sind (hauptsächlich mit Eisen angereicherte Frühstückszerealien), auf die Resorption von Cefdinir wurde nicht untersucht.
Die gleichzeitige Gabe von mit Eisen angereicherter Säuglingsanfangsnahrung (2,2 mg elementares Eisen/6 oz) hat keine signifikante Wirkung auf die Pharmakokinetik von Cefdinir. Daher kann OMNICEF zur oralen Suspension zusammen mit mit Eisen angereicherter Säuglingsanfangsnahrung verabreicht werden.
Es gab Berichte über rötlichen Stuhl bei Patienten, die Cefdinir erhielten. In vielen Fällen erhielten die Patienten auch eisenhaltige Produkte. Die rötliche Farbe ist auf die Bildung eines nicht resorbierbaren Komplexes zwischen Cefdinir oder seinen Abbauprodukten und Eisen im Magen-Darm-Trakt zurückzuführen.
Arzneimittel-/Labortest-Wechselwirkungen
Eine falsch-positive Reaktion auf Ketone im Urin kann bei Tests mit Nitroprussid auftreten, nicht jedoch bei Tests mit Nitroferricyanid. Die Verabreichung von Cefdinir kann mit Clinitest®, Benedict-Lösung oder Fehling-Lösung zu einer falsch-positiven Reaktion auf Glukose im Urin führen. Es wird empfohlen, Glukosetests auf Basis enzymatischer Glukoseoxidase-Reaktionen (wie Clinistix® oder Tes-Tape®) zu verwenden. Von Cephalosporinen ist bekannt, dass sie gelegentlich einen positiven direkten Coombs-Test hervorrufen.
WARNUNGEN
BEVOR EINE THERAPIE MIT OMNICEF (CEFDINIR) EINGELEITET WIRD, SOLLTE SORGFÄLTIG ABGEFRAGT WERDEN, UM ZU BESTIMMEN, OB DER PATIENT FRÜHERE ÜBERSENSIBILITÄTSREAKTIONEN GEGEN CEFDINIR, ANDERE CEPHALOSPORINE, PENICILLINE ODER ANDERE ARZNEIMITTEL HAT. WENN CEFDINIR AN PENICILLIN-EMPFINDLICHE PATIENTEN GEGEBEN WERDEN SOLLTE, SOLLTE VORSICHT GEGEBEN WERDEN, DA EINE KREUZ-HYPERSENSITIVITÄT BEI β-LACTAM-ANTIBIOTIKA EINDEUTIG DOKUMENTIERT WURDE UND BEI BIS ZU 10 % DER PATIENTEN MIT EINER VORGESCHICHTENEN PENICILLIN-ALLERGIE AUFTRETEN KANN. WENN EINE ALLERGISCHE REAKTION AUF CEFDINIR AUFTRITT, SOLLTE DAS ARZNEIMITTEL ABGESETZT WERDEN. SCHWERE AKUTE ÜBERSENSIBILITÄTSREAKTIONEN KÖNNEN EINE BEHANDLUNG MIT Epinephrin UND ANDERE NOTFALLMASSNAHMEN, EINSCHLIESSLICH SAUERSTOFF, INTRAVENÖSE FLÜSSIGKEITEN, INTRAVENÖSE ANTIHISTAMINE, KORTIKOSTEROIDE, PRESSORAMINE UND ATEMWEGSMANAGEMENT ERFORDERLICH MACHEN, WIE KLINISCH INDIVIDUELL.
Clostridium difficile-assoziierte Diarrhoe (CDAD) wurde bei der Anwendung von fast allen Antibiotika, einschließlich OMNICEF, berichtet und kann in ihrer Schwere von leichter Diarrhoe bis hin zu tödlicher Kolitis reichen. Die Behandlung mit antibakteriellen Mitteln verändert die normale Flora des Dickdarms, was zu einem übermäßigen Wachstum von C. difficile führt.
C. difficile produziert die Toxine A und B, die zur Entstehung von CDAD beitragen. Hypertoxin produzierende Stämme von C. difficile verursachen eine erhöhte Morbidität und Mortalität, da diese Infektionen gegenüber einer antimikrobiellen Therapie refraktär sein können und eine Kolektomie erfordern können. CDAD muss bei allen Patienten in Betracht gezogen werden, bei denen nach der Anwendung von Antibiotika Durchfall auftritt. Eine sorgfältige Anamnese ist erforderlich, da berichtet wurde, dass CDAD mehr als zwei Monate nach der Verabreichung von Antibiotika auftritt.
Wenn CDAD vermutet oder bestätigt wird, muss die laufende antibakterielle Anwendung, die nicht gegen C. difficile gerichtet ist, möglicherweise abgebrochen werden. Je nach klinischer Indikation sollte ein angemessenes Flüssigkeits- und Elektrolytmanagement, eine Proteinergänzung, eine antibakterielle Behandlung von C. difficile und eine chirurgische Untersuchung eingeleitet werden.
VORSICHTSMASSNAHMEN
Allgemein
Es ist unwahrscheinlich, dass die Verschreibung von OMNICEF 300 mg ohne nachgewiesene oder dringend vermutete bakterielle Infektion oder ohne prophylaktische Indikation einen Nutzen für den Patienten bringt und das Risiko der Entwicklung arzneimittelresistenter Bakterien erhöht.
Wie bei anderen Breitspektrum-Antibiotika kann eine längere Behandlung zum möglichen Auftreten und Überwuchern resistenter Organismen führen. Eine sorgfältige Beobachtung des Patienten ist unerlässlich. Wenn während der Therapie eine Superinfektion auftritt, sollte eine geeignete alternative Therapie verabreicht werden.
Cefdinir sollte, wie andere Breitspektrum-Antibiotika (Antibiotika), Personen mit Colitis in der Vorgeschichte mit Vorsicht verschrieben werden.
Bei Patienten mit vorübergehender oder anhaltender Niereninsuffizienz (Kreatinin-Clearance DOSIERUNG UND ANWENDUNG ).
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Das karzinogene Potenzial von Cefdinir wurde nicht untersucht. Im bakteriellen Rückmutationstest (Ames) oder Punktmutationstest am Hypoxanthin-Guanin-Phosphoribosyltransferase-Locus (HGPRT) in V79-Lungenzellen des chinesischen Hamsters wurden keine mutagenen Wirkungen beobachtet. Keine klastogenen Wirkungen wurden in vitro im strukturellen Chromosomenaberrationsassay in V79-Lungenzellen des chinesischen Hamsters oder in vivo im Mikrokernassay im Mausknochenmark beobachtet. Bei Ratten wurden die Fertilität und Fortpflanzungsfähigkeit durch Cefdinir in oralen Dosen von bis zu 1000 mg/kg/Tag (das 70-Fache der Humandosis basierend auf mg/kg/Tag, das 11-fache der Humandosis basierend auf mg/m²/Tag) nicht beeinflusst.
Schwangerschaft
Teratogene Wirkungen
Schwangerschaftskategorie B
Cefdinir war bei Ratten in oralen Dosen von bis zu 1000 mg/kg/Tag (das 70-fache der Humandosis basierend auf mg/kg/Tag, das 11-fache der Humandosis basierend auf mg/m²/Tag) oder bei Kaninchen in oralen Dosen von bis zu 10 mg/kg/Tag nicht teratogen mg/kg/Tag (das 0,7-fache der Humandosis basierend auf mg/kg/Tag, das 0,23-fache der Humandosis basierend auf mg/m²/Tag). Maternale Toxizität (verringerte Körpergewichtszunahme) wurde bei Kaninchen bei der maximal tolerierten Dosis von 10 mg/kg/Tag ohne nachteilige Auswirkungen auf die Nachkommen beobachtet. Verringertes Körpergewicht trat bei Rattenföten bei ≥ 100 mg/kg/Tag und bei Rattennachkommen bei ≥ 32 mg/kg/Tag auf. Es wurden keine Auswirkungen auf die mütterlichen Fortpflanzungsparameter oder das Überleben, die Entwicklung, das Verhalten oder die Fortpflanzungsfunktion der Nachkommen beobachtet.
Es gibt jedoch keine adäquaten und gut kontrollierten Studien bei Schwangeren. Da Reproduktionsstudien an Tieren die menschliche Reaktion nicht immer vorhersagen, sollte dieses Medikament während der Schwangerschaft nur angewendet werden, wenn dies eindeutig erforderlich ist.
Arbeit und Lieferung
Die Anwendung von Cefdinir während der Wehen und der Geburt wurde nicht untersucht.
Stillende Mutter
Nach Gabe von Einzeldosen von 600 mg wurde Cefdinir nicht in der Muttermilch nachgewiesen.
Pädiatrische Verwendung
Sicherheit und Wirksamkeit bei Neugeborenen und Säuglingen unter 6 Monaten wurden nicht nachgewiesen. Die Anwendung von Cefdinir zur Behandlung der akuten Sinusitis maxillaris bei pädiatrischen Patienten (im Alter von 6 Monaten bis 12 Jahren) wird durch Belege aus angemessenen und gut kontrollierten Studien bei Erwachsenen und Jugendlichen, die ähnliche Pathophysiologie der akuten Sinusitis bei erwachsenen und pädiatrischen Patienten und unterstützt vergleichende pharmakokinetische Daten in der pädiatrischen Population.
Geriatrische Verwendung
Die Wirksamkeit ist bei geriatrischen Patienten und jüngeren Erwachsenen vergleichbar. Während Cefdinir in allen Altersgruppen gut vertragen wurde, kam es in klinischen Studien bei geriatrischen Patienten zu einer geringeren Rate an Nebenwirkungen, einschließlich Durchfall, als bei jüngeren Erwachsenen. Eine Dosisanpassung bei älteren Patienten ist nicht erforderlich, es sei denn, die Nierenfunktion ist deutlich eingeschränkt (vgl DOSIERUNG UND ANWENDUNG ).
ÜBERDOSIS
Informationen zu einer Cefdinir-Überdosierung beim Menschen liegen nicht vor. In Studien zur akuten Nagertoxizität verursachte eine orale Einzeldosis von 5600 mg/kg keine Nebenwirkungen. Zu den toxischen Anzeichen und Symptomen nach einer Überdosierung mit anderen β-Lactam-Antibiotika gehörten Übelkeit, Erbrechen, epigastrische Beschwerden, Durchfall und Krämpfe. Hämodialyse entfernt Cefdinir aus dem Körper. Dies kann im Falle einer schweren toxischen Reaktion aufgrund einer Überdosierung nützlich sein, insbesondere wenn die Nierenfunktion beeinträchtigt ist.
KONTRAINDIKATIONEN
OMNICEF (Cefdinir) ist bei Patienten mit bekannter Allergie gegen Antibiotika der Cephalosporin-Klasse kontraindiziert.
KLINISCHE PHARMAKOLOGIE
Pharmakokinetik und Arzneimittelstoffwechsel
Absorption
Orale Bioverfügbarkeit
Maximale Cefdinir-Plasmakonzentrationen treten 2 bis 4 Stunden nach der Einnahme nach Verabreichung der Kapsel oder Suspension auf. Die Plasmakonzentrationen von Cefdinir steigen mit der Dosis, aber die Anstiege sind von 300 mg (7 mg/kg) bis 600 mg (14 mg/kg) weniger als dosisproportional. Nach Verabreichung der Suspension an gesunde Erwachsene beträgt die Bioverfügbarkeit von Cefdinir 120 % im Vergleich zu Kapseln. Die geschätzte Bioverfügbarkeit von Cefdinir-Kapseln beträgt 21 % nach Verabreichung einer 300-mg-Kapseldosis und 16 % nach Verabreichung einer 600-mg-Kapseldosis. Die geschätzte absolute Bioverfügbarkeit der Cefdinir-Suspension beträgt 25 %. Cefdinir-Suspension zum Einnehmen in einer Stärke von 250 mg/5 ml erwies sich bei gesunden Erwachsenen unter nüchternen Bedingungen als bioäquivalent zu der Stärke von 125 mg/5 ml.
Wirkung von Lebensmitteln
Die Cmax und AUC von Cefdinir aus den Kapseln werden um 16 % bzw. 10 % reduziert, wenn sie zusammen mit einer fettreichen Mahlzeit eingenommen werden. Bei Erwachsenen, die die 250 mg/5 ml Suspension zum Einnehmen mit einer fettreichen Mahlzeit erhalten, werden Cmax und AUC von Cefdinir um 44 % bzw. 33 % reduziert. Das Ausmaß dieser Reduktionen ist wahrscheinlich nicht klinisch signifikant, da die Sicherheits- und Wirksamkeitsstudien der Suspension zum Einnehmen bei pädiatrischen Patienten ohne Berücksichtigung der Nahrungsaufnahme durchgeführt wurden. Daher kann Cefdinir ohne Rücksicht auf Nahrung eingenommen werden.
Cefdinir-Kapseln
Die Cefdinir-Plasmakonzentrationen und pharmakokinetischen Parameterwerte nach Verabreichung von oralen Einzeldosen von 300 und 600 mg Cefdinir an erwachsene Probanden sind in der folgenden Tabelle dargestellt:
Mittlere (± Standardabweichung) pharmakokinetische Parameterwerte von Cefdinir im Plasma nach Verabreichung von Kapseln an erwachsene Probanden
Cefdinir-Suspendierung
Die Cefdinir-Plasmakonzentrationen und pharmakokinetischen Parameterwerte nach Verabreichung von oralen Einzeldosen von 7 und 14 mg/kg Cefdinir an pädiatrische Probanden (im Alter von 6 Monaten bis 12 Jahren) sind in der folgenden Tabelle dargestellt:
Mittlere (± SD) Plasma-Cefdinir-Pharmakokinetik-Parameterwerte nach Verabreichung einer Suspension an pädiatrische Probanden
Mehrfachdosierung
Cefdinir akkumuliert nach ein- oder zweimal täglicher Verabreichung an Personen mit normaler Nierenfunktion nicht im Plasma.
Verteilung
Das mittlere Verteilungsvolumen (Vdarea) von Cefdinir bei erwachsenen Probanden beträgt 0,35 l/kg (± 0,29); bei pädiatrischen Patienten (im Alter von 6 Monaten bis 12 Jahren) beträgt Cefdinir Vdarea 0,67 l/kg (± 0,38). Cefdinir wird sowohl bei erwachsenen als auch bei pädiatrischen Probanden zu 60 % bis 70 % an Plasmaproteine gebunden; Die Bindung ist konzentrationsunabhängig.
Hautblase
Bei erwachsenen Probanden wurden 4 bis 5 Stunden nach Verabreichung von 300- bzw. 600-mg-Dosen mediane (Bereich) maximale Cefdinir-Konzentrationen in der Blasenflüssigkeit von 0,65 (0,33-1,1) und 1,1 (0,49-1,9) μg/ml beobachtet. Die mittleren (±SD) Cmax- und AUC(0-∞)-Werte der Blisterpackung betrugen 48 % (± 13) und 91 % (± 18) der entsprechenden Plasmawerte.
Mandelgewebe
Bei erwachsenen Patienten, die sich einer elektiven Tonsillektomie unterziehen mussten, betrugen die jeweiligen medianen Cefdinir-Konzentrationen im Tonsillengewebe 4 Stunden nach Gabe von Einzeldosen von 300 und 600 mg 0,25 (0,220,46) bzw. 0,36 (0,22 – 0,80) μg/g. Die mittleren Tonsillengewebekonzentrationen betrugen 24 % (± 8) der entsprechenden Plasmakonzentrationen.
Nebenhöhlengewebe
Bei erwachsenen Patienten, die sich einer elektiven Kieferhöhlen- und Siebbeinhöhlenoperation unterziehen mussten, betrugen die jeweiligen medianen Cefdinir-Konzentrationen im Nasennebenhöhlengewebe 4 Stunden nach Gabe von Einzeldosen von 300 und 600 mg
Lungengewebe
Bei erwachsenen Patienten, die sich einer diagnostischen Bronchoskopie unterzogen, betrugen die jeweiligen medianen Konzentrationen von Cefdinir in der Bronchialschleimhaut 4 Stunden nach Gabe einer Einzeldosis von 300 und 600 mg 0,78 (
Mittelohrflüssigkeit
Bei 14 pädiatrischen Patienten mit akuter bakterieller Otitis media betrugen die jeweiligen medianen Mittelohrflüssigkeitskonzentrationen von Cefdinir 3 Stunden nach Verabreichung von Einzeldosen von 7 und 14 mg/kg 0,21 (
Liquor
Daten zur Penetration von Cefdinir in die menschliche Zerebrospinalflüssigkeit sind nicht verfügbar.
Stoffwechsel und Ausscheidung
Cefdinir wird nicht nennenswert metabolisiert. Die Aktivität beruht hauptsächlich auf der Mutterdroge. Cefdinir wird hauptsächlich über die Nieren ausgeschieden, mit einer mittleren Eliminationshalbwertszeit (t½) aus dem Plasma von 1,7 (± 0,6) Stunden. Bei gesunden Probanden mit normaler Nierenfunktion beträgt die renale Clearance 2,0 (± 1,0) ml/min/kg und die scheinbare orale Clearance 11,6 (± 6,0) und 15,5 (± 5,4) ml/min/kg nach Dosen von 300 und 600 -mg. Der mittlere Prozentsatz der unverändert im Urin wiedergefundenen Dosis nach 300- und 600-mg-Dosen beträgt 18,4 % (± 6,4) bzw. 11,6 % (± 4,6). Die Cefdinir-Clearance ist bei Patienten mit Nierenfunktionsstörung verringert (siehe Besondere Populationen - Patienten mit Niereninsuffizienz ).
Da die renale Ausscheidung der vorherrschende Eliminationsweg ist, sollte die Dosierung bei Patienten mit deutlich eingeschränkter Nierenfunktion oder Patienten, die sich einer Hämodialyse unterziehen, angepasst werden (siehe DOSIERUNG UND ANWENDUNG ).
Besondere Populationen
Patienten mit Niereninsuffizienz
Die Pharmakokinetik von Cefdinir wurde bei 21 erwachsenen Probanden mit unterschiedlich ausgeprägter Nierenfunktion untersucht. Die Verringerung der Eliminationsrate von Cefdinir, der scheinbaren oralen Clearance (CL/F) und der renalen Clearance war ungefähr proportional zur Verringerung der Kreatinin-Clearance (CLcr). Infolgedessen waren die Plasmakonzentrationen von Cefdinir bei Patienten mit eingeschränkter Nierenfunktion höher und hielten länger an als bei Patienten ohne eingeschränkte Nierenfunktion. Bei Patienten mit einer CLcr zwischen 30 und 60 ml/min stiegen Cmax und t½ um etwa das 2-Fache und die AUC um etwa das 3-Fache an. Bei Patienten mit CLcr DOSIERUNG UND ANWENDUNG ).
Hämodialyse
Die Pharmakokinetik von Cefdinir wurde bei 8 erwachsenen Probanden untersucht, die sich einer Hämodialyse unterzogen. Die Dialyse (Dauer 4 Stunden) entfernte 63 % des Cefdinir aus dem Körper und verringerte die scheinbare Eliminations-t½ von 16 (± 3,5) auf 3,2 (± 1,2) Stunden. Bei dieser Patientengruppe wird eine Dosisanpassung empfohlen (siehe DOSIERUNG UND ANWENDUNG ).
Lebererkrankung
Da Cefdinir überwiegend renal eliminiert und nicht nennenswert metabolisiert wird, wurden keine Studien an Patienten mit eingeschränkter Leberfunktion durchgeführt. Es ist nicht zu erwarten, dass bei dieser Patientengruppe eine Dosisanpassung erforderlich ist.
Geriatrische Patienten
Die Auswirkung des Alters auf die Pharmakokinetik von Cefdinir nach einer Einzeldosis von 300 mg wurde bei 32 Probanden im Alter von 19 bis 91 Jahren untersucht. Die systemische Cefdinir-Exposition war bei älteren Probanden (N = 16) erheblich erhöht, Cmax um 44 % und AUC um 86 %. Dieser Anstieg war auf eine Verringerung der Cefdinir-Clearance zurückzuführen. Das scheinbare Verteilungsvolumen war ebenfalls verringert, sodass keine nennenswerten Veränderungen der scheinbaren Eliminations-t½ beobachtet wurden (ältere Patienten: 2,2 ± 0,6 Stunden vs. junge: 1,8 ± 0,4 Stunden). Da gezeigt wurde, dass die Clearance von Cefdinir in erster Linie mit Veränderungen der Nierenfunktion und nicht mit dem Alter zusammenhängt, ist bei älteren Patienten keine Dosisanpassung erforderlich, es sei denn, sie haben eine deutlich eingeschränkte Nierenfunktion (Kreatinin-Clearance Patienten mit Niereninsuffizienz, oben ).
Geschlecht und Rasse
Die Ergebnisse einer Metaanalyse der klinischen Pharmakokinetik (N = 217) zeigten keinen signifikanten Einfluss von Geschlecht oder ethnischer Zugehörigkeit auf die Pharmakokinetik von Cefdinir.
Mikrobiologie
Wirkmechanismus
Wie bei anderen Cephalosporinen resultiert die bakterizide Aktivität von Cefdinir aus der Hemmung der Zellwandsynthese. Cefdinir ist in Gegenwart einiger, aber nicht aller β-Lactamase-Enzyme stabil. Infolgedessen sind viele gegen Penicilline resistente Organismen und einige Cephalosporine anfällig für Cefdinir.
Widerstandsmechanismus
Die Resistenz gegenüber Cefdinir beruht hauptsächlich auf Hydrolyse durch einige β-Lactamasen, Veränderung von Penicillin-bindenden Proteinen (PBPs) und verminderter Permeabilität. Cefdinir ist gegen die meisten Stämme von Enterobacter spp., Pseudomonas spp., Enterococcus spp., Penicillin-resistente Streptokokken und Methicillin-resistente Staphylokokken inaktiv. β-Lactamase-negative, Ampicillin-resistente (BLNAR) H. influenzae-Stämme sind typischerweise nicht empfindlich gegenüber Cefdinir.
Antimikrobielle Aktivität
Cefdinir hat sich als wirksam gegen die meisten Stämme der folgenden Mikroorganismen erwiesen, sowohl in vitro als auch bei klinischen Infektionen, wie in beschrieben INDIKATIONEN UND VERWENDUNG .
Gram-positive Bakterien
Staphylococcus aureus (nur Methicillin-empfindliche Stämme) Streptococcus pneumoniae (nur Penicillin-empfindliche Stämme) Streptococcus pyogenes
Gramnegative Bakterien
Haemophilus influenzae Haemophilus parainfluenzae Moraxella catarrhalis
Die folgenden In-vitro-Daten sind verfügbar, ihre klinische Bedeutung ist jedoch nicht bekannt.
Cefdinir weist in vitro minimale Hemmkonzentrationen (MICs) von 1 µg/ml oder weniger gegen (≥ 90 %) Stämme der folgenden Mikroorganismen auf; Die Sicherheit und Wirksamkeit von Cefdinir bei der Behandlung klinischer Infektionen durch diese Mikroorganismen wurden jedoch nicht in angemessenen und gut kontrollierten klinischen Studien nachgewiesen.
Gram-positive Bakterien
Staphylococcus epidermidis (nur Methicillin-empfindliche Stämme) Streptococcus agalactiae Streptokokken der Viridans-Gruppe
Gramnegative Bakterien
Citrobacter koseri Escherichia coli Klebsiella pneumoniae Proteus mirabilis
Empfindlichkeitstestmethoden
Wenn verfügbar, sollte das Labor für klinische Mikrobiologie regelmäßig Berichte vorlegen, die das regionale/lokale Empfindlichkeitsprofil potenzieller nosokomialer und ambulant erworbener Pathogene beschreiben. Diese Berichte sollen dem Arzt bei der Auswahl eines antibakteriellen Medikaments für die Behandlung helfen.
Verdünnungstechniken
Zur Bestimmung der minimalen Hemmkonzentrationen (MHK) von antimikrobiellen Mitteln werden quantitative Methoden verwendet. Diese MICs liefern Schätzungen der Empfindlichkeit von Bakterien gegenüber antimikrobiellen Verbindungen. Die MHK-Werte sollten mit einer standardisierten Testmethode1 (Brühe und/oder Agar) bestimmt werden. Die MHK-Werte sollten gemäß den in Tabelle 1 angegebenen Kriterien interpretiert werden.
Diffusionstechniken
Quantitative Methoden, die die Messung von Zonendurchmessern erfordern, liefern auch reproduzierbare Schätzungen der Empfindlichkeit von Bakterien gegenüber antimikrobiellen Verbindungen. Die Zonengröße sollte mit einer standardisierten Methode bestimmt werden.2 Das Verfahren verwendet mit 5 µg Cefdinir imprägnierte Papierscheiben, um die Anfälligkeit von Bakterien zu testen. Die Interpretationskriterien für die Disk-Diffusion sind in Tabelle 1 angegeben.
Die Empfindlichkeit von Staphylokokken gegenüber Cefdinir kann aus der Untersuchung von Penicillin und entweder Cefoxitin oder Oxacillin abgeleitet werden. Staphylokokken, die gegenüber Oxacillin (Cefoxitin) empfindlich sind, können als gegenüber Cefdinir empfindlich betrachtet werden.3
Ein Bericht „Anfällig“ weist darauf hin, dass antimikrobielle Mittel wahrscheinlich das Wachstum des Pathogens hemmen, wenn die antimikrobielle Verbindung am Ort der Infektion die Konzentrationen erreicht, die erforderlich sind, um das Wachstum des Pathogens zu hemmen. Ein Bericht mit „Zwischenergebnis“ weist darauf hin, dass das Ergebnis als zweideutig betrachtet werden sollte und der Test wiederholt werden sollte, wenn der Mikroorganismus nicht vollständig empfindlich gegenüber alternativen, klinisch geeigneten Arzneimitteln ist. Diese Kategorie impliziert eine mögliche klinische Anwendbarkeit an Körperstellen, an denen das Arzneimittel physiologisch konzentriert ist, oder in Situationen, in denen eine hohe Arzneimitteldosis verwendet werden kann. Diese Kategorie bietet auch eine Pufferzone, die verhindert, dass kleine unkontrollierte technische Faktoren größere Diskrepanzen bei der Interpretation verursachen. Ein Bericht „resistent“ weist darauf hin, dass das antimikrobielle Mittel das Wachstum des Pathogens wahrscheinlich nicht hemmt, wenn die antimikrobielle Verbindung die Konzentrationen erreicht, die normalerweise an der Infektionsstelle erreichbar sind; andere Therapie gewählt werden.
Qualitätskontrolle
Standardisierte Empfindlichkeitstestverfahren erfordern die Verwendung von Laborkontrollen, um die Genauigkeit und Präzision der im Assay verwendeten Materialien und Reagenzien sowie die Techniken der Person, die den Test durchführt, zu überwachen und sicherzustellen.1,2,3 Standard-Cefdinir-Pulver sollte den folgenden Bereich aufweisen der MHK-Werte, wie in Tabelle 2 angegeben. Für die Diffusionstechnik unter Verwendung einer 5-mcg-Scheibe sollten die Kriterien in Tabelle 2 erreicht werden.
Klinische Studien
Ambulant erworbene bakterielle Pneumonie
In einer kontrollierten, doppelblinden Studie an Erwachsenen und Jugendlichen, die in den USA durchgeführt wurde, wurde Cefdinir BID mit Cefaclor 500 mg TID verglichen. Unter Anwendung strenger Auswertbarkeits- und mikrobiologischer/klinischer Ansprechkriterien 6 bis 14 Tage nach der Therapie wurden die folgenden klinischen Heilungsraten, mutmaßlichen mikrobiologischen Eradikationsraten und statistischen Ergebnisse erzielt:
Studie zu ambulant erworbener Pneumonie in den USA Cefdinir vs. Cefaclor
In einer zweiten kontrollierten, prüferblinden Studie bei Erwachsenen und Jugendlichen, die hauptsächlich in Europa durchgeführt wurde, wurde Cefdinir BID mit Amoxicillin/Clavulanat 500/125 mg TID verglichen. Unter Anwendung strenger Auswertbarkeits- und klinischer Ansprechkriterien 6 bis 14 Tage nach der Therapie wurden die folgenden klinischen Heilungsraten, mutmaßlichen mikrobiologischen Eradikationsraten und statistischen Ergebnisse erzielt:
European Community-Acquired Pneumonia Study Cefdinir vs. Amoxicillin/Clavulanat
Streptokokken-Pharyngitis/Tonsillitis
In vier kontrollierten Studien, die in den Vereinigten Staaten durchgeführt wurden, wurde Cefdinir mit 10 Tagen Penicillin bei erwachsenen, jugendlichen und pädiatrischen Patienten verglichen. Zwei Studien (eine an Erwachsenen und Jugendlichen, die andere an pädiatrischen Patienten) verglichen 10 Tage Cefdinir QD oder BID mit Penicillin 250 mg oder 10 mg/kg QID. Unter Anwendung strenger Auswertbarkeits- und mikrobiologischer/klinischer Ansprechkriterien 5 bis 10 Tage nach der Therapie wurden die folgenden klinischen Heilungsraten, mikrobiologischen Eradikationsraten und statistischen Ergebnisse erzielt:
Studien zu Pharyngitis/Tonsillitis Cefdinir (10 Tage) vs. Penicillin (10 Tage)
Zwei Studien (eine an Erwachsenen und Jugendlichen, die andere an pädiatrischen Patienten) verglichen 5 Tage Cefdinir BID mit 10 Tagen Penicillin 250 mg oder 10 mg/kg QID. Unter Anwendung strenger Auswertbarkeits- und mikrobiologischer/klinischer Ansprechkriterien 4 bis 10 Tage nach der Therapie wurden die folgenden klinischen Heilungsraten, mikrobiologischen Eradikationsraten und statistischen Ergebnisse erzielt:
Studien zu Pharyngitis/Tonsillitis Cefdinir (5 Tage) vs. Penicillin (10 Tage)
VERWEISE
1. Clinical and Laboratory Standards Institute (CLSI). Methoden zur Verdünnung Antimikrobielle Empfindlichkeitstests für Bakterien, die aerob wachsen; Genehmigter Standard – Zehnte Ausgabe. CLSI-Dokument M07-A10 [2015], Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA.
2. Institut für klinische und Laborstandards (CLSI). Leistungsstandards für antimikrobielle Disk-Diffusions-Empfindlichkeitstests; Genehmigter Standard – Zwölfte Ausgabe. CLSI-Dokument M02-A12 [2015], Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA.
3. Clinical and Laboratory Standards Institute (CLSI). Leistungsstandards für antimikrobielle Empfindlichkeitstests; Fünfundzwanzigste Informationsergänzung, CLSI-Dokument M100-S25 [2015], Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA.
4. Cockcroft DW, Gault MH. Vorhersage der Kreatinin-Clearance aus Serum-Kreatinin. Nephron 1976;16:31-41.
5. Schwartz GJ, Haycock GB, Edelmann CM, Spitzer A. Eine einfache Schätzung der glomerulären Filtrationsrate bei Kindern, abgeleitet aus Körperlänge und Plasma-Kreatinin. Pädiatrie 1976;58:259-63.
6. Schwartz GJ, Feld LG, Langford DJ. Eine einfache Schätzung der glomerulären Filtrationsrate bei Reifgeborenen während des ersten Lebensjahres. J Pediatrics 1984;104:849-54.
INFORMATIONEN ZUM PATIENTEN
Die Patienten sollten darauf hingewiesen werden, dass antibakterielle Arzneimittel, einschließlich OMNICEF 300 mg, nur zur Behandlung bakterieller Infektionen angewendet werden sollten. Sie behandeln keine Virusinfektionen (z. B. Erkältung). Wenn OMNICEF 300 mg zur Behandlung einer bakteriellen Infektion verschrieben wird, sollten die Patienten darüber aufgeklärt werden, dass sie sich zwar zu Beginn der Therapie besser fühlen, das Medikament jedoch genau nach Anweisung eingenommen werden sollte. Das Auslassen von Dosen oder das Nichtbeenden des vollständigen Therapieverlaufs kann (1) die Wirksamkeit der sofortigen Behandlung verringern und (2) die Wahrscheinlichkeit erhöhen, dass Bakterien Resistenzen entwickeln und in Zukunft nicht mehr mit OMNICEF 300 mg oder anderen antibakteriellen Arzneimitteln behandelbar sind.
Antazida, die Magnesium oder Aluminium enthalten, beeinträchtigen die Resorption von Cefdinir. Wenn diese Art von Antazida während der Therapie mit OMNICEF 300 mg erforderlich ist, sollte OMNICEF mindestens 2 Stunden vor oder nach dem Antazida eingenommen werden.
Eisenpräparate, einschließlich eisenhaltiger Multivitamine, beeinträchtigen die Aufnahme von Cefdinir. Wenn während der Therapie mit OMNICEF 300 mg eine Eisenergänzung erforderlich ist, sollte OMNICEF mindestens 2 Stunden vor oder nach der Ergänzung eingenommen werden.
Mit Eisen angereicherte Säuglingsanfangsnahrung beeinträchtigt die Resorption von Cefdinir nicht signifikant. Daher kann OMNICEF 300 mg als Suspension zum Einnehmen zusammen mit mit Eisen angereicherter Säuglingsanfangsnahrung verabreicht werden.
Diabetiker und Pflegekräfte sollten sich darüber im Klaren sein, dass die Suspension zum Einnehmen 2,86 g Saccharose pro Teelöffel enthält.
Durchfall ist ein häufiges Problem, das durch Antibiotika verursacht wird und normalerweise endet, wenn das Antibiotikum abgesetzt wird. Manchmal können Patienten nach Beginn der Behandlung mit Antibiotika wässrigen und blutigen Stuhl (mit oder ohne Magenkrämpfe und Fieber) sogar noch zwei oder mehr Monate nach Einnahme der letzten Dosis des Antibiotikums entwickeln. In diesem Fall sollten die Patienten so schnell wie möglich ihren Arzt kontaktieren.