Biaxin 250mg, 500mg Clarithromycin Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Biaxin 500 mg und wie wird es angewendet?
Biaxin ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome vieler verschiedener bakterieller Infektionen, einschließlich Magengeschwüren und Helicobacter pylori. Biaxin kann allein oder mit anderen Medikamenten verwendet werden.
Biaxin 500 mg ist ein Antibiotikum.
Es ist nicht bekannt, ob Biaxin bei Kindern unter 6 Monaten sicher und wirksam ist.
Welche Nebenwirkungen kann Biaxin 250mg haben?
Biaxin 500 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Biaxin gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Biaxin. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
Clarithromycin ist ein halbsynthetisches Makrolid-Antibiotikum zur oralen Anwendung. Chemisch ist es 6-0-Methylerythromycin. Die Molekularformel lautet C38H69NO13 und das Molekulargewicht beträgt 747,96. Die Strukturformel lautet:
Abbildung 1: Struktur von Clarithromycin
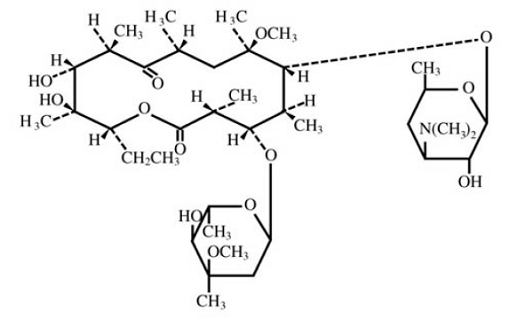
Clarithromycin ist ein weißes bis cremefarbenes kristallines Pulver. Es ist löslich in Aceton, leicht löslich in Methanol, Ethanol und Acetonitril und praktisch unlöslich in Wasser.
BIAXIN ist als Tabletten mit sofortiger Wirkstofffreisetzung, Tabletten mit verlängerter Wirkstofffreisetzung und Granulat zur Herstellung einer Suspension zum Einnehmen erhältlich.
Jede gelbe, ovale Filmtablette BIAXIN Filmtab mit sofortiger Freisetzung (Clarithromycin-Tabletten, USP) enthält 250 mg oder 500 mg Clarithromycin und die folgenden Hilfsstoffe:
Jede gelbe, ovale Filmtablette BIAXIN XL Filmtab (Clarithromycin-Retardtabletten) enthält 500 mg Clarithromycin und die folgenden Hilfsstoffe: Zellulosepolymere, D&C Gelb Nr. 10, Lactose-Monohydrat, Magnesiumstearat, Propylenglykol, Sorbinsäure, Sorbitan Monooleat, Talk, Titandioxid und Vanillin.
Jede 5 ml BIAXIN 500 mg rekonstituierte Suspension (Clarithromycin zur Herstellung einer Suspension zum Einnehmen, USP) enthält 125 mg oder 250 mg Clarithromycin. Jede Flasche BIAXIN Granulat enthält 1250 mg (Größe 50 ml), 2500 mg (Größe 50 und 100 ml) oder 5000 mg (Größe 100 ml) Clarithromycin und die folgenden Hilfsstoffe: Carbomer, Rizinusöl, Zitronensäure, Hypromellosephthalat, Maltodextrin, Kaliumsorbat, Povidon, Siliziumdioxid, Saccharose, Xanthangummi, Titandioxid und Fruchtpunschgeschmack.
INDIKATIONEN
Akute bakterielle Exazerbation einer chronischen Bronchitis
BIAXIN (Filmtab, Granulat) und BIAXIN XL Filmtab sind angezeigt bei Erwachsenen zur Behandlung von leichten bis mittelschweren Infektionen, die durch empfindliche Isolate verursacht werden, die auf Haemophilus influenzae, Haemophilus parainfluenzae, Moraxella catarrhalis oder Streptococcus pneumoniae zurückzuführen sind [siehe INDIKATIONEN UND VERWENDUNG ].
Akute Kieferhöhlenentzündung
BIAXIN (Filmtab, Granulat) und BIAXIN 500 mg XL Filmtab (bei Erwachsenen) sind indiziert zur Behandlung leichter bis mittelschwerer Infektionen, die durch empfindliche Isolate verursacht werden, die auf Haemophilus influenzae, Moraxella catarrhalis oder Streptococcus pneumoniae zurückzuführen sind [siehe INDIKATIONEN UND VERWENDUNG ].
Ambulant erworbene Pneumonie
BIAXIN (Filmtab, Granulat) und BIAXIN XL Filmtab sind angegeben [siehe INDIKATIONEN UND VERWENDUNG ] zur Behandlung von leichten bis mittelschweren Infektionen, die durch empfindliche Isolate verursacht werden aufgrund von:
Pharyngitis/Mandelentzündung
BIAXIN 500 mg Filmtab und BIAXIN 500 mg Granulat sind für die Behandlung von leichten bis mittelschweren Infektionen angezeigt, die durch empfindliche Isolate verursacht werden, die auf Streptococcus pyogenes zurückzuführen sind, als Alternative bei Personen, die keine Erstlinientherapie anwenden können.
Unkomplizierte Haut- und Hautstrukturinfektionen
BIAXIN Filmtab und BIAXIN Granulat sind angezeigt für die Behandlung von leichten bis mittelschweren Infektionen, die durch empfindliche Isolate verursacht werden, die auf Staphylococcus aureus oder Streptococcus pyogenes zurückzuführen sind.
Akute Otitis media
BIAXIN Filmtab und BIAXIN 250 mg Granulat sind indiziert bei pädiatrischen Patienten zur Behandlung von leichten bis mittelschweren Infektionen, die durch empfindliche Isolate verursacht werden, die auf Haemophilus influenzae, Moraxella catarrhalis oder Streptococcus pneumoniae zurückzuführen sind [siehe Klinische Studien ].
Behandlung und Prophylaxe verbreiteter mykobakterieller Infektionen
BIAXIN 500 mg Filmtab und BIAXIN 250 mg Granulat sind indiziert zur Behandlung von leichten bis mittelschweren Infektionen, die durch empfindliche Isolate von Mycobacterium avium oder Mycobacterium intracellulare bei Patienten mit fortgeschrittener HIV-Infektion verursacht werden [siehe Klinische Studien ].
Helicobacter-pylori-Infektion und Zwölffingerdarmgeschwür-Erkrankung
BIAXIN 250 mg Filmtab wird Erwachsenen wie unten beschrieben in Kombination mit anderen Arzneimitteln verabreicht, um H. pylori auszurotten. Es wurde gezeigt, dass die Eradikation von H. pylori das Risiko eines erneuten Auftretens von Zwölffingerdarmgeschwüren verringert [siehe Klinische Studien ].
Nutzungsbeschränkungen
BIAXIN 500 mg XL Filmtab ist nur angezeigt bei akuter Sinusitis maxillaris, akuter bakterieller Exazerbation einer chronischen Bronchitis und ambulant erworbener Lungenentzündung bei Erwachsenen. Die Wirksamkeit und Sicherheit von BIAXIN 500 mg XL Filmtab bei der Behandlung anderer Infektionen, für die BIAXIN Filmtab und BIAXIN Granulat zugelassen sind, wurden nicht nachgewiesen.
Bei bestimmten bakteriellen Infektionen, die durch Streptococcus pneumoniae und Staphylococcus aureus verursacht werden, besteht eine Resistenz gegen Makrolide. Bei klinischer Indikation sollte eine Empfindlichkeitsprüfung durchgeführt werden.
Verwendungszweck
Um die Entwicklung arzneimittelresistenter Bakterien zu verringern und die Wirksamkeit von BIAXIN und anderen antibakteriellen Arzneimitteln aufrechtzuerhalten, sollte BIAXIN nur zur Behandlung oder Vorbeugung von Infektionen angewendet werden, die nachweislich oder mit starkem Verdacht auf empfindliche Bakterien zurückzuführen sind. Wenn Kultur- und Empfindlichkeitsinformationen verfügbar sind, sollten diese bei der Auswahl oder Änderung der antibakteriellen Therapie berücksichtigt werden. In Ermangelung solcher Daten können lokale Epidemiologie und Anfälligkeitsmuster zur empirischen Auswahl der Therapie beitragen.
DOSIERUNG UND ANWENDUNG
Wichtige Verwaltungsanweisungen
BIAXIN Filmtab und BIAXIN 250 mg Granulat können mit oder ohne Nahrung verabreicht werden.
BIAXIN XL Filmtab sollte mit Nahrung eingenommen werden. Schlucken Sie BIAXIN 500mg XL Filmtab ganz; BIAXIN 500mg XL Filmtab nicht kauen, zerbrechen oder zerkleinern.
Dosierung für Erwachsene
Die empfohlenen Dosierungen von BIAXIN 250 mg Filmtab und BIAXIN 250 mg XL Filmtab zur Behandlung von leichten bis mittelschweren Infektionen bei Erwachsenen sind in Tabelle 1 aufgeführt.
Kombinationsdosierungsschemata für H. pylori-Infektion
Pädiatrische Dosierung
Die empfohlene Tagesdosis beträgt 15 mg/kg/Tag aufgeteilt alle 12 Stunden für 10 Tage (bis zur Erwachsenendosis). Siehe Dosierungsschemata für mykobakterielle Infektionen bei pädiatrischen Patienten für zusätzliche Dosierungsinformationen [siehe Dosierungsschemata für mykobakterielle Infektionen ].
Dosierungsschemata für mykobakterielle Infektionen
Zur Behandlung einer disseminierten Infektion durch den Mycobacterium avium-Komplex (MAC) werden BIAXIN Filmtab und BIAXIN 500 mg Granulat als primäre Mittel empfohlen. BIAXIN Filmtab und BIAXIN Granulat sollten in Kombination mit anderen antimykobakteriellen Arzneimitteln (z. B. Ethambutol) angewendet werden, die in vitro eine Aktivität gegen MAC oder einen klinischen Nutzen bei der MAC-Behandlung gezeigt haben [siehe Klinische Studien ].
Erwachsene Patienten
Zur Behandlung und Prophylaxe mykobakterieller Infektionen bei Erwachsenen beträgt die empfohlene Dosis von BIAXIN 500 mg alle 12 Stunden.
Pädiatrische Patienten
Zur Behandlung und Prophylaxe mykobakterieller Infektionen bei pädiatrischen Patienten beträgt die empfohlene Dosis 7,5 mg/kg alle 12 Stunden bis zu 500 mg alle 12 Stunden. [Sehen Verwendung in bestimmten Bevölkerungsgruppen und Klinische Studien ].
Die Behandlung mit BIAXIN 250 mg sollte fortgesetzt werden, wenn ein klinisches Ansprechen beobachtet wird. BIAXIN kann abgesetzt werden, wenn bei dem Patienten ein geringes Risiko einer disseminierten Infektion angenommen wird.
Dosisanpassung bei Patienten mit eingeschränkter Nierenfunktion
Siehe Tabelle 2 zur Dosisanpassung bei Patienten mit mittelschwerer oder schwerer Nierenfunktionsstörung mit oder ohne gleichzeitige Behandlung mit Atazanavir oder Ritonavir [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Dosisanpassung aufgrund von Arzneimittelwechselwirkungen
Verringern Sie die Dosis von BIAXIN 500 mg um 50 % bei gleichzeitiger Anwendung mit Atazanavir [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ]. Dosisanpassungen für andere Arzneimittel bei gleichzeitiger Anwendung mit BIAXIN 250 mg können aufgrund von Wechselwirkungen mit anderen Arzneimitteln empfohlen werden [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Rekonstitution von BIAXIN-Granulat
Das mitgelieferte BIAXIN 250 mg Granulat muss vor der Verabreichung von BIAXIN zur Herstellung einer Suspension zum Einnehmen mit Wasser rekonstituiert werden. Die nachstehende Tabelle 3 gibt das bei der Rekonstitution hinzuzufügende Wasservolumen an. Zur Wiederherstellung:
Vor jedem Gebrauch gut schütteln. Nach dem Mischen bei 15° bis 30°C (59° bis 86°F) lagern und innerhalb von 14 Tagen aufbrauchen. Nicht kühlen.
WIE GELIEFERT
Darreichungsformen und Stärken
BIAXIN 500 mg ist erhältlich als:
Lagerung und Handhabung
BIAXIN 250 mg Filmtab (Clarithromycin-Tabletten, USP) ist als gelbe, ovale Filmtablette in folgenden Packungsgrößen erhältlich: 250-mg-Tabletten: (blauer Aufdruck mit „a“-Logo und KT)
Flaschen von 60 ( NDC 0074-3368-60) und Einheitsdosis-Streifenpackungen mit 100 ( NDC 0074-3368-11).
Lagern Sie BIAXIN Filmtab 250 mg bei kontrollierter Raumtemperatur von 15 °C bis 30 °C (59 °F bis 86 °F) in einem gut verschlossenen Behälter. Vor Licht schützen.
500 mg Tabletten : (geprägt mit dem „a“-Logo auf einer Seite und KL auf der gegenüberliegenden Seite)
Flaschen mit 60 (NDC 0074-2586-60) und Einheitsdosis-Streifenpackungen mit 100 ( NDC 0074-2586-11).
Lagern Sie BIAXIN Filmtab 500 mg bei kontrollierter Raumtemperatur von 20 °C bis 25 °C (68 °F bis 77 °F) in einem gut verschlossenen Behälter.
BIAXIN XL Filmtab (Clarithromycin-Retardtabletten) wird als gelbe, ovale Filmtabletten in den folgenden Packungsgrößen geliefert:
500 mg Tabletten : (geprägt mit dem „a“-Logo und KJ)
Flaschen mit 60 (NDC 0074-3165-60), Einheitsdosis-Streifenpackungen mit 100 ( NDC 0074-3165-11) und BIAXIN XL PAC Karton mit 4 Blisterpackungen zu je 14 Tabletten ( NDC 0074-3165-41).
Lagern Sie BIAXIN 500 mg XL Filmtab bei 20 °C bis 25 °C (68 °F bis 77 °F). Exkursionen bis 15° bis 30°C (59° bis 86°F) erlaubt. [Sehen USP kontrollierte Raumtemperatur .]
BIAXIN 500 mg Granulat (Clarithromycin zur Herstellung einer Suspension zum Einnehmen, USP) wird als weißes bis cremefarbenes Granulat in den folgenden Stärken und Größen geliefert:
Lagern Sie BIAXIN 500 mg Granulat unter 25 °C (77 °F) in einem gut verschlossenen Behälter. Bewahren Sie das rekonstituierte BIAXIN 500 mg Granulat nicht im Kühlschrank auf.
BIAXIN Filmtab 250 mg und 500 mg und BIAXIN 250 mg XL Filmtab 500 mg Mfd. von AbbVie LTD, Barceloneta, PR 00617. BIAXIN-Granulat, 125 mg/5 ml und 250 mg/5 ml Herst.-Nr. von AbbVie Inc., North Chicago, IL 60064 Für AbbVie Inc., North Chicago, IL 60064, USA Überarbeitet: Nov. 2018.
NEBENWIRKUNGEN
Die folgenden schwerwiegenden Nebenwirkungen werden unten und an anderer Stelle in der Kennzeichnung beschrieben:
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien eines Arzneimittels beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien eines anderen Arzneimittels verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Basierend auf gepoolten Daten aus allen Indikationen sind die häufigsten Nebenwirkungen, die sowohl bei Erwachsenen als auch bei Kindern in klinischen Studien beobachtet wurden, Bauchschmerzen, Durchfall, Übelkeit, Erbrechen und Dysgeusie. Ebenfalls berichtet wurden Dyspepsie, anormaler Leberfunktionstest, anaphylaktische Reaktion, Candidiasis, Kopfschmerzen, Schlaflosigkeit und Hautausschlag.
In den folgenden Unterabschnitten sind die häufigsten Nebenwirkungen zur Prophylaxe und Behandlung von mykobakteriellen Infektionen und Zwölffingerdarmgeschwüren im Zusammenhang mit einer H.-pylori-Infektion aufgeführt. Im Allgemeinen stimmen diese Profile mit den oben beschriebenen gepoolten Daten überein.
Prophylaxe mykobakterieller Infektionen
Bei AIDS-Patienten, die zur Prophylaxe gegen M. avium über längere Zeiträume mit BIAXIN behandelt wurden, war es oft schwierig, Nebenwirkungen, die möglicherweise mit der BIAXIN-Verabreichung in Zusammenhang stehen, von einer zugrunde liegenden HIV-Erkrankung oder einer interkurrenten Erkrankung zu unterscheiden. Die mediane Behandlungsdauer betrug 10,6 Monate für die BIAXIN-Gruppe und 8,2 Monate für die Placebo-Gruppe.
Änderungen der Laborwerte
Ausgewählte unerwünschte Laborerfahrungen, die während der Therapie bei mehr als 2 % der mit BIAXIN behandelten erwachsenen Patienten in einer randomisierten, doppelblinden klinischen Studie mit 682 Patienten berichtet wurden, sind in Tabelle 5 aufgeführt.
Bei immungeschwächten Patienten, die eine Prophylaxe gegen M. avium erhielten, wurden Auswertungen der Laborwerte vorgenommen, indem diejenigen Werte analysiert wurden, die außerhalb des ernsthaft abnormalen Wertes (dh der extrem hohen oder niedrigen Grenze) für den spezifizierten Test lagen.
Behandlung mykobakterieller Infektionen
Die Nebenwirkungsprofile waren bei den Dosierungsschemata mit 500 mg und 1000 mg zweimal täglich ähnlich.
Bei AIDS-Patienten und anderen immungeschwächten Patienten, die wegen mykobakterieller Infektionen über lange Zeiträume mit höheren Dosen von BIAXIN behandelt wurden, war es oft schwierig, Nebenwirkungen, die möglicherweise mit der Verabreichung von BIAXIN 250 mg in Zusammenhang stehen, von zugrunde liegenden Anzeichen einer HIV-Erkrankung oder einer interkurrenten Erkrankung zu unterscheiden.
Die folgende Analyse fasst die Erfahrungen während der ersten 12 Wochen der Therapie mit BIAXIN zusammen. Die Daten werden für Studie 1 (randomisiert, doppelblind) und Studie 2 (open-labeled, Compassionate Use) getrennt berichtet und auch kombiniert. Nebenwirkungen wurden in Studie 2 weniger häufig berichtet, was teilweise auf Unterschiede in der Überwachung zwischen den beiden Studien zurückzuführen sein könnte.
Bei erwachsenen Patienten, die zweimal täglich BIAXIN 500 mg erhielten, sind die am häufigsten berichteten Nebenwirkungen, die möglicherweise oder möglicherweise mit dem Studienmedikament zusammenhängen, mit einer Inzidenz von 5 % oder mehr unten aufgeführt (Tabelle 6). Ungefähr 8 % der Patienten, die zweimal täglich 500 mg erhielten, und 12 % der Patienten, die zweimal täglich 1000 mg erhielten, brachen die Therapie aufgrund arzneimittelbedingter Nebenwirkungen während der ersten 12 Behandlungswochen ab; Zu den Nebenwirkungen, die bei mindestens 2 Patienten zum Absetzen führten, gehörten Übelkeit, Erbrechen, Bauchschmerzen, Durchfall, Hautausschlag und Asthenie.
Eine begrenzte Anzahl pädiatrischer AIDS-Patienten wurde wegen mykobakterieller Infektionen mit BIAXIN-Suspension behandelt. Die am häufigsten berichteten Nebenwirkungen, mit Ausnahme derjenigen, die auf gleichzeitige Erkrankungen des Patienten zurückzuführen sind, stimmten mit denen überein, die bei erwachsenen Patienten beobachtet wurden.
Änderungen der Laborwerte
In den ersten 12 Wochen nach Beginn der Behandlung mit BIAXIN 500 mg zweimal täglich kam es in Studie 2 (469 eingeschlossene erwachsene Patienten) während Studie 1 bei 3 % der Patienten zu SGOT-Erhöhungen und bei 2 % der Patienten zu SGPT-Erhöhungen um das > 5-Fache der Obergrenze des Normalwerts (154 eingeschlossene Patienten) hatten keine Erhöhung der Transaminasen. Dies umfasst nur Patienten mit Baseline-Werten im normalen Bereich oder grenzwertig niedrig.
Zwölffingerdarmgeschwür im Zusammenhang mit einer H. pylori-Infektion
In klinischen Studien zur Kombinationstherapie mit BIAXIN 500 mg plus Omeprazol und Amoxicillin wurden keine Nebenwirkungen beobachtet, die spezifisch für die Kombination dieser Arzneimittel sind. Die aufgetretenen Nebenwirkungen beschränkten sich auf diejenigen, die zuvor mit BIAXIN 250 mg, Omeprazol oder Amoxicillin berichtet wurden.
Die Nebenwirkungsprofile sind unten (Tabelle 7) für vier randomisierte, doppelblinde klinische Studien aufgeführt, in denen Patienten die Kombination aus BIAXIN 500 mg dreimal täglich und Omeprazol 40 mg täglich für 14 Tage erhielten, gefolgt von Omeprazol 20 mg einmal täglich täglich (drei Studien) oder 40 mg einmal täglich (eine Studie) für weitere 14 Tage. Von den 346 Patienten, die die Kombination erhielten, brachen 3,5 % der Patienten das Medikament aufgrund von Nebenwirkungen ab.
Änderungen der Laborwerte
Veränderungen der Laborwerte mit möglicher klinischer Bedeutung bei Patienten, die BIAXIN und Omeprazol in vier randomisierten Doppelblindstudien mit 945 Patienten einnahmen, sind wie folgt:
Leber erhöhtes direktes Bilirubin
Weniger häufige Nebenwirkungen, die während klinischer Studien mit Clarithromycin beobachtet wurden
Basierend auf den gepoolten Daten aller Indikationen wurden die folgenden Nebenwirkungen in klinischen Studien mit Clarithromycin mit einer Rate von weniger als 1 % beobachtet:
Erkrankungen des Blut- und Lymphsystems: Leukopenie, Neutropenie, Thrombozythämie, Eosinophilie
Herzerkrankungen: QT-Verlängerung im Elektrokardiogramm, Herzstillstand, Vorhofflimmern, Extrasystolen, Herzklopfen
Erkrankungen des Ohrs und des Labyrinths: Schwindel, Tinnitus, Schwerhörigkeit
Gastrointestinale Störungen: Stomatitis, Glossitis, Ösophagitis, gastroösophageale Refluxkrankheit, Gastritis, Proktalgie, aufgeblähter Bauch, Verstopfung, Mundtrockenheit, Aufstoßen, Blähungen
Allgemeine Erkrankungen und Bedingungen am Verabreichungsort: Unwohlsein, Fieber, Asthenie, Brustschmerzen, Schüttelfrost, Müdigkeit
Leber- und Gallenerkrankungen: Cholestase, Hepatitis
Erkrankungen des Immunsystems: Überempfindlichkeit
Infektionen und Schädlinge: Cellulitis, Gastroenteritis, Infektion, vaginale Infektion
Untersuchungen: Bilirubin im Blut erhöht, alkalische Phosphatase im Blut erhöht, Laktatdehydrogenase im Blut erhöht, Albumin-Globulin-Verhältnis anormal
Stoffwechsel- und Ernährungsstörungen: Anorexie, verminderter Appetit
Erkrankungen des Bewegungsapparates und des Bindegewebes: Myalgie, Muskelkrämpfe, Nackensteifigkeit
Erkrankungen des Nervensystems: Schwindel, Zittern, Bewusstlosigkeit, Dyskinesie, Somnolenz
Psychische Störungen: Angst, Nervosität
Nieren- und Harnwegserkrankungen: Kreatinin im Blut erhöht, Harnstoff im Blut erhöht
Erkrankungen der Atemwege, des Brustraums und des Mediastinums: Asthma, Epistaxis, Lungenembolie
Erkrankungen der Haut und des Unterhautgewebes: Urtikaria, bullöse Dermatitis, Juckreiz, Hyperhidrose, makulopapulöser Ausschlag
Magen-Darm-Nebenwirkungen
In den Studien zur akuten Exazerbation von chronischer Bronchitis und akuter Sinusitis maxillaris wurden insgesamt gastrointestinale Nebenwirkungen von einem ähnlichen Anteil der Patienten berichtet, die entweder BIAXIN 250 mg Filmtab oder BIAXIN 500 mg XL Filmtab einnahmen; Patienten, die BIAXIN 500 mg XL Filmtab einnahmen, berichteten jedoch über signifikant weniger schwere gastrointestinale Symptome im Vergleich zu Patienten, die BIAXIN 250 mg Filmtab einnahmen. Darüber hinaus kam es bei Patienten, die BIAXIN 500 mg XL Filmtab einnahmen, im Vergleich zu BIAXIN Filmtab zu signifikant weniger vorzeitigen Behandlungsabbrüchen aufgrund arzneimittelbedingter gastrointestinaler oder abnormaler Geschmacksnebenwirkungen.
Gesamtmortalität bei Patienten mit koronarer Herzkrankheit 1 bis 10 Jahre nach BIAXIN-Exposition
In einer klinischen Studie, in der die Ergebnisse der Behandlung mit Clarithromycin bei Patienten mit koronarer Herzkrankheit untersucht wurden, wurde bei Patienten, die randomisiert Clarithromycin erhielten, ein erhöhtes Risiko für Gesamtmortalität beobachtet. Clarithromycin zur Behandlung der koronaren Herzkrankheit ist keine zugelassene Indikation. Die Patienten wurden 14 Tage lang mit Clarithromycin oder Placebo behandelt und mehrere Jahre lang auf primäre Outcome-Ereignisse (z. B. Gesamtmortalität oder nicht tödliche kardiale Ereignisse) beobachtet.1 Eine zahlenmäßig höhere Anzahl von primären Outcome-Ereignissen bei Patienten, die randomisiert Clarithromycin erhielten, war mit einer Hazard Ratio von 1,06 (95 % Konfidenzintervall 0,98 bis 1,14) beobachtet. Bei der Nachbeobachtung 10 Jahre nach der Behandlung gab es jedoch 866 (40 %) Todesfälle in der Clarithromycin-Gruppe und 815 (37 %) Todesfälle in der Placebo-Gruppe, was einer Hazard Ratio für die Gesamtmortalität von 1,10 (95 % Konfidenzintervall 1,00 bis 1,21). Der Unterschied in der Zahl der Todesfälle trat nach einem Jahr oder länger nach Ende der Behandlung auf.
Die Ursache für den Unterschied in der Gesamtsterblichkeit wurde nicht festgestellt. Andere epidemiologische Studien zur Bewertung dieses Risikos haben unterschiedliche Ergebnisse gezeigt [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung von BIAXIN nach der Zulassung festgestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Blut- und Lymphsystem: Thrombozytopenie, Agranulozytose
Herz: Ventrikuläre Arrhythmie, ventrikuläre Tachykardie, Torsade de Pointes
Ohr und Labyrinth: Taubheit wurde hauptsächlich bei älteren Frauen berichtet und war normalerweise reversibel.
Magen-Darm: Es wurde über akute Pankreatitis, Zungenverfärbung, Zahnverfärbung berichtet, die nach Absetzen des Medikaments normalerweise durch professionelle Reinigung reversibel war.
Es gab Berichte über BIAXIN 250 mg XL Filmtab im Stuhl, von denen viele bei Patienten mit anatomischen (einschließlich Ileostomie oder Kolostomie) oder funktionellen gastrointestinalen Störungen mit verkürzten gastrointestinalen Transitzeiten auftraten. In mehreren Berichten sind Tablettenrückstände im Zusammenhang mit Durchfall aufgetreten. Es wird empfohlen, dass Patienten, bei denen Tablettenrückstände im Stuhl und keine Besserung ihres Zustands auftreten, auf eine andere Clarithromycin-Formulierung (z. B. Suspension) oder ein anderes antibakterielles Arzneimittel umgestellt werden.
Hepatobiliär: Leberversagen, hepatozelluläre Gelbsucht. Nebenwirkungen im Zusammenhang mit Leberfunktionsstörungen wurden mit Clarithromycin berichtet [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Infektionen und Schädlinge: Pseudomembranöse Kolitis [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ]
Immunsystem: Anaphylaktische Reaktionen, Angioödem
Untersuchungen: Prothrombinzeit verlängert, Leukozytenzahl erniedrigt, international normalisiertes Verhältnis erhöht. Im Zusammenhang mit Leberversagen wurde über abnormale Urinfarbe berichtet.
Stoffwechsel und Ernährung: Hypoglykämie wurde bei Patienten berichtet, die orale Antidiabetika oder Insulin einnahmen.
Bewegungsapparat und Bindegewebe: Myopathie Rhabdomyolyse wurde berichtet und in einigen der Berichte wurde Clarithromycin gleichzeitig mit Statinen, Fibraten, Colchicin oder Allopurinol verabreicht [siehe KONTRAINDIKATIONEN und WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Nervöses System: Parosmie, Anosmie, Ageusie, Parästhesien und Krämpfe
Psychiatrie: Abnormales Verhalten, Verwirrtheitszustand, Depersonalisation, Orientierungslosigkeit, Halluzination, Depression, manisches Verhalten, abnormaler Traum, psychotische Störung. Diese Störungen klingen normalerweise nach Absetzen des Medikaments ab.
Nieren und Harn: Interstitielle Nephritis, Nierenversagen
Haut und Unterhautgewebe: Stevens-Johnson-Syndrom, toxische epidermale Nekrolyse, Arzneimittelexanthem mit Eosinophilie und systemischen Symptomen (DRESS), Purpura Schönlein-Henoch, Akne, akute generalisierte exanthematische Pustulose
Gefäß: Blutung
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Es ist bekannt, dass die gleichzeitige Verabreichung von BIAXIN 250 mg CYP3A hemmt, und ein Arzneimittel, das hauptsächlich durch CYP3A metabolisiert wird, kann mit Erhöhungen der Arzneimittelkonzentrationen verbunden sein, die sowohl die therapeutischen als auch die Nebenwirkungen des gleichzeitig verabreichten Arzneimittels verstärken oder verlängern könnten.
BIAXIN sollte bei Patienten, die mit anderen Arzneimitteln behandelt werden, die bekanntermaßen CYP3A-Enzymsubstrate sind, mit Vorsicht angewendet werden, insbesondere wenn das CYP3A-Substrat eine enge Sicherheitsmarge hat (z. B. Carbamazepin) und/oder das Substrat extensiv durch dieses Enzym metabolisiert wird. Passen Sie gegebenenfalls die Dosierung an und überwachen Sie die Serumkonzentrationen von Arzneimitteln, die hauptsächlich durch CYP3A metabolisiert werden, engmaschig bei Patienten, die gleichzeitig Clarithromycin erhalten.
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Akute Überempfindlichkeitsreaktionen
Im Falle schwerer akuter Überempfindlichkeitsreaktionen wie Anaphylaxie, Stevens-Johnson-Syndrom, toxische epidermale Nekrolyse, Arzneimittelexanthem mit Eosinophilie und systemischen Symptomen (DRESS), Purpura Schönlein-Henoch und akuter generalisierter exanthematischer Pustulose ist die Behandlung mit BIAXIN 250 mg sofort abzubrechen und angemessene Behandlung einleiten.
QT-Verlängerung
BIAXIN 500 mg wurde mit einer Verlängerung des QT-Intervalls und seltenen Fällen von Arrhythmie in Verbindung gebracht. Fälle von Torsades de Pointes wurden während der Postmarketing-Überwachung bei Patienten, die BIAXIN erhielten, spontan berichtet. Es wurden Todesfälle gemeldet.
Vermeiden Sie BIAXIN bei den folgenden Patienten:
Ältere Patienten können anfälliger für arzneimittelbedingte Wirkungen auf das QT-Intervall sein [vgl Verwendung in bestimmten Bevölkerungsgruppen ].
Hepatotoxizität
Im Zusammenhang mit Clarithromycin wurde über Leberfunktionsstörungen, einschließlich erhöhter Leberenzyme, und hepatozelluläre und/oder cholestatische Hepatitis mit oder ohne Gelbsucht berichtet. Diese Leberfunktionsstörung kann schwerwiegend sein und ist normalerweise reversibel. In einigen Fällen wurde über Leberversagen mit tödlichem Ausgang berichtet, das im Allgemeinen mit schwerwiegenden Grunderkrankungen und/oder gleichzeitiger Medikation in Verbindung gebracht wurde. Zu den Symptomen einer Hepatitis können Anorexie, Gelbsucht, dunkler Urin, Pruritus oder druckschmerzhaftes Abdomen gehören. Setzen Sie BIAXIN 500 mg sofort ab, wenn Anzeichen und Symptome einer Hepatitis auftreten.
Schwerwiegende Nebenwirkungen aufgrund der gleichzeitigen Anwendung mit anderen Arzneimitteln
Medikamente, die durch CYP3A4 metabolisiert werden
Schwerwiegende Nebenwirkungen wurden bei Patienten berichtet, die BIAXIN gleichzeitig mit CYP3A4-Substraten einnahmen. Dazu gehören Colchicin-Toxizität mit Colchicin; Rhabdomyolyse mit Simvastatin, Lovastatin und Atorvastatin; Hypoglykämie und Herzrhythmusstörungen (z. B. Torsades de pointes) mit Disopyramid; Hypotonie und akute Nierenschädigung mit Kalziumkanalblockern, die durch CYP3A4 metabolisiert werden (z. B. Verapamil, Amlodipin, Diltiazem, Nifedipin). Die meisten Berichte über akute Nierenschädigungen mit Calciumkanalblockern, die durch CYP3A4 metabolisiert werden, betrafen ältere Patienten im Alter von 65 Jahren oder älter. Verwenden Sie BIAXIN 500 mg mit Vorsicht, wenn es gleichzeitig mit Medikamenten verabreicht wird, die das Cytochrom-CYP3A4-Enzym induzieren. Die Anwendung von BIAXIN 250 mg mit Simvastatin, Lovastatin, Ergotamin oder Dihydroergotamin ist kontraindiziert [siehe KONTRAINDIKATIONEN und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Colchicin
Bei mit BIAXIN und Colchicin behandelten Patienten wurde über lebensbedrohliche und tödliche Arzneimittelwechselwirkungen berichtet. Clarithromycin ist ein starker CYP3A4-Hemmer, und diese Wechselwirkung kann auftreten, wenn beide Arzneimittel in der empfohlenen Dosierung angewendet werden. Wenn die gleichzeitige Anwendung von BIAXIN und Colchicin bei Patienten mit normaler Nieren- und Leberfunktion erforderlich ist, reduzieren Sie die Dosis von Colchicin. Patienten auf klinische Symptome einer Colchicin-Toxizität überwachen. Die gleichzeitige Verabreichung von BIAXIN 500 mg und Colchicin ist bei Patienten mit eingeschränkter Nieren- oder Leberfunktion kontraindiziert [siehe KONTRAINDIKATIONEN und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
HMG-CoA-Reduktase-Hemmer (Statine)
Die gleichzeitige Anwendung von BIAXIN mit Lovastatin oder Simvastatin ist kontraindiziert [siehe KONTRAINDIKATIONEN ], da diese Statine weitgehend durch CYP3A4 metabolisiert werden und die gleichzeitige Behandlung mit BIAXIN ihre Plasmakonzentration erhöht, was das Risiko einer Myopathie, einschließlich Rhabdomyolyse, erhöht. Fälle von Rhabdomyolyse wurden bei Patienten berichtet, die BIAXIN gleichzeitig mit diesen Statinen einnahmen. Wenn eine Behandlung mit BIAXIN nicht vermieden werden kann, muss die Behandlung mit Lovastatin oder Simvastatin während der Behandlung ausgesetzt werden.
Seien Sie vorsichtig, wenn Sie BIAXIN 250 mg zusammen mit Atorvastatin oder Pravastatin verschreiben. In Situationen, in denen die gleichzeitige Anwendung von BIAXIN mit Atorvastatin oder Pravastatin nicht vermieden werden kann, sollte die Atorvastatin-Dosis 20 mg täglich und die Pravastatin-Dosis 40 mg täglich nicht überschreiten. Die Anwendung eines Statins, das nicht vom CYP3A-Metabolismus abhängt (z. B. Fluvastatin), kann in Erwägung gezogen werden. Es wird empfohlen, die niedrigste zugelassene Dosis zu verschreiben, wenn eine gleichzeitige Anwendung nicht vermieden werden kann.
Orale hypoglykämische Mittel/Insulin
Die gleichzeitige Anwendung von BIAXIN 500 mg und oralen Antidiabetika und/oder Insulin kann zu einer signifikanten Hypoglykämie führen. Bei bestimmten hypoglykämischen Arzneimitteln wie Nateglinid, Pioglitazon, Repaglinid und Rosiglitazon kann eine Hemmung des CYP3A-Enzyms durch Clarithromycin beteiligt sein und bei gleichzeitiger Anwendung Hypoglykämie verursachen. Eine sorgfältige Überwachung der Glukose wird empfohlen [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Quetiapin
Verwenden Sie Quetiapin und Clarithromycin gleichzeitig mit Vorsicht. Die gleichzeitige Anwendung könnte zu einer erhöhten Quetiapin-Exposition und Quetiapin-bedingten Toxizitäten wie Somnolenz, orthostatischer Hypotonie, Bewusstseinsstörungen, malignem neuroleptischem Syndrom und QT-Verlängerung führen. Siehe Quetiapin-Verschreibungsinformationen für Empfehlungen zur Dosisreduktion bei gleichzeitiger Anwendung mit CYP3A4-Inhibitoren wie Clarithromycin [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Orale Antikoagulanzien
Bei gleichzeitiger Gabe von BIAXIN und Warfarin besteht das Risiko schwerer Blutungen und signifikanter Erhöhungen der INR und der Prothrombinzeit. Überwachen Sie häufig die INR- und Prothrombinzeiten, während die Patienten gleichzeitig BIAXIN und orale Antikoagulanzien erhalten [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Benzodiazepine
Bei gleichzeitiger Gabe von BIAXIN 250 mg und Triazolobenzodiazepinen wie Triazolam und Midazolam wurde über verstärkte Sedierung und Verlängerung der Sedierung berichtet [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Gesamtmortalität bei Patienten mit koronarer Herzkrankheit 1 bis 10 Jahre nach BIAXIN-Exposition
In einer klinischen Studie, in der die Behandlung mit Clarithromycin hinsichtlich der Ergebnisse bei Patienten mit koronarer Herzkrankheit untersucht wurde, wurde bei Patienten, die randomisiert Clarithromycin erhielten, ein Anstieg des Risikos für Gesamtmortalität ein Jahr oder länger nach Behandlungsende beobachtet.1 Clarithromycin zur Behandlung von Koronarerkrankungen Arterienerkrankungen sind keine zugelassene Indikation. Die Ursache für das erhöhte Risiko wurde nicht festgestellt. Andere epidemiologische Studien zur Bewertung dieses Risikos haben unterschiedliche Ergebnisse gezeigt [siehe NEBENWIRKUNGEN ]. Erwägen Sie, dieses potenzielle Risiko gegen die Behandlungsvorteile abzuwägen, wenn Sie BIAXIN Patienten verschreiben, bei denen eine koronare Herzkrankheit vermutet oder bestätigt wurde.
Clostridium difficile assoziierter Durchfall
Clostridium difficile-assoziierte Diarrhoe (CDAD) wurde bei der Anwendung von fast allen antibakteriellen Mitteln, einschließlich BIAXIN, berichtet und kann in ihrer Schwere von leichter Diarrhoe bis hin zu tödlicher Colitis reichen. Die Behandlung mit antibakteriellen Mitteln verändert die normale Flora des Dickdarms, was zu einem übermäßigen Wachstum von C. difficile führt.
C. difficile produziert die Toxine A und B, die zur Entstehung von CDAD beitragen. Hypertoxin produzierende Stämme von C. difficile verursachen eine erhöhte Morbidität und Mortalität, da diese Infektionen gegenüber einer antimikrobiellen Therapie refraktär sein können und eine Kolektomie erfordern können. CDAD muss bei allen Patienten in Betracht gezogen werden, bei denen nach der Anwendung von Antibiotika Durchfall auftritt. Eine sorgfältige Anamnese ist erforderlich, da berichtet wurde, dass CDAD mehr als zwei Monate nach der Verabreichung von Antibiotika auftritt.
Wenn CDAD vermutet oder bestätigt wird, muss die laufende antibakterielle Anwendung, die nicht gegen C. difficile gerichtet ist, möglicherweise abgebrochen werden. Je nach klinischer Indikation sollte ein angemessenes Flüssigkeits- und Elektrolytmanagement, eine Proteinergänzung, eine antibakterielle Behandlung von C. difficile und eine chirurgische Untersuchung eingeleitet werden.
Embryofetale Toxizität
Clarithromycin sollte bei schwangeren Frauen nicht angewendet werden, außer unter klinischen Umständen, in denen keine alternative Therapie angebracht ist. Wenn BIAXIN 500 mg während der Schwangerschaft angewendet wird oder wenn eine Schwangerschaft eintritt, während die Patientin dieses Arzneimittel einnimmt, sollte die Patientin über die potenzielle Gefahr für den Fötus informiert werden. Clarithromycin hat bei Affen, Ratten, Mäusen und Kaninchen nachteilige Wirkungen auf den Schwangerschaftsausgang und/oder die embryofetale Entwicklung bei Dosen gezeigt, die Plasmaspiegel erzeugten, die das 2- bis 17-fache der Serumspiegel erreichten, die bei Menschen erreicht wurden, die mit den maximal empfohlenen Dosen für Menschen behandelt wurden [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Exazerbation von Myasthenia gravis
Bei Patienten, die mit BIAXIN 250 mg behandelt wurden, wurde über eine Verschlechterung der Symptome einer Myasthenia gravis und ein erneutes Auftreten von Symptomen eines myasthenischen Syndroms berichtet.
Entwicklung arzneimittelresistenter Bakterien
Die Verschreibung von BIAXIN in Ermangelung einer nachgewiesenen oder dringend vermuteten bakteriellen Infektion oder einer prophylaktischen Indikation wird dem Patienten wahrscheinlich keinen Nutzen bringen und das Risiko der Entwicklung arzneimittelresistenter Bakterien erhöhen.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Die folgenden In-vitro-Mutagenitätstests wurden mit Clarithromycin durchgeführt:
Alle Tests waren negativ, mit Ausnahme des In-vitro-Chromosomenaberrationstests, der in einem Test positiv und in einem anderen negativ war. Zusätzlich wurde ein bakterieller Rückmutationstest (Ames-Test) mit negativen Ergebnissen an Clarithromycin-Metaboliten durchgeführt.
Beeinträchtigung der Fruchtbarkeit
Fertilitäts- und Reproduktionsstudien haben gezeigt, dass Tagesdosen von bis zu 160 mg/kg/ bei männlichen und weiblichen Ratten keine negativen Auswirkungen auf den Östruszyklus, die Fertilität, die Geburt oder die Anzahl und Lebensfähigkeit der Nachkommenschaft hatten. Die Plasmaspiegel bei Ratten nach 150 mg/kg/Tag waren doppelt so hoch wie die Humanserumspiegel.
Hodenatrophie trat bei Ratten bei 7-facher Dosis, bei Hunden bei 3-facher Dosis und bei Affen bei 8-mal höherer Dosis als die maximale menschliche Tagesdosis (auf Basis der Körperoberfläche) auf.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Teratogene Wirkungen
Schwangerschaftskategorie C
Clarithromycin sollte bei schwangeren Frauen nicht angewendet werden, außer unter klinischen Umständen, in denen keine alternative Therapie angebracht ist. Wenn während der Einnahme dieses Arzneimittels eine Schwangerschaft eintritt, sollte die Patientin über die potenzielle Gefahr für den Fötus informiert werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Vier Teratogenitätsstudien an Ratten (drei mit oralen Dosen und eine mit intravenösen Dosen von bis zu 160 mg/kg/Tag, verabreicht während der Phase der Hauptorganogenese) und zwei an Kaninchen mit oralen Dosen von bis zu 125 mg/kg/Tag (ungefähr das Doppelte der empfohlene maximale Humandosis basierend auf mg/m²) oder intravenöse Dosen von 30 mg/kg/Tag, die während der Trächtigkeitstage 6 bis 18 verabreicht wurden, zeigten keine Teratogenität von Clarithromycin. Zwei zusätzliche orale Studien an einem anderen Rattenstamm mit ähnlichen Dosen und ähnlichen Bedingungen zeigten eine geringe Inzidenz kardiovaskulärer Anomalien bei Dosen von 150 mg/kg/Tag, die während der Trächtigkeitstage 6 bis 15 verabreicht wurden.
Die Plasmaspiegel nach 150 mg/kg/Tag waren doppelt so hoch wie die menschlichen Serumspiegel. Vier Studien an Mäusen zeigten eine unterschiedliche Inzidenz von Gaumenspalten nach oraler Gabe von 1000 mg/kg/Tag (das 2- bzw. 4-fache der empfohlenen maximalen Humandosis, basierend auf mg/m²) während der Trächtigkeitstage 6 bis 15. Gaumenspalten traten ebenfalls auf bei 500 mg/kg/Tag gesehen. Die Exposition gegenüber 1000 mg/kg/Tag führte zu Plasmaspiegeln, die das 17-fache der menschlichen Serumspiegel betrugen. Bei Affen führte eine orale Dosis von 70 mg/kg/Tag zu einer fötalen Wachstumsverzögerung bei Plasmaspiegeln, die doppelt so hoch waren wie die menschlichen Serumspiegel.
Stillende Mutter
Vorsicht ist geboten, wenn BIAXIN stillenden Frauen verabreicht wird. Die Entwicklung und der gesundheitliche Nutzen der Ernährung mit Muttermilch sollten zusammen mit dem klinischen Bedarf der Mutter an BIAXIN und möglichen Nebenwirkungen des Arzneimittels oder des zugrunde liegenden Zustands der Mutter auf das mit Muttermilch gefütterte Kind berücksichtigt werden.
Clarithromycin und sein aktiver Metabolit 14-Hydroxy-Clarithromycin werden in die Muttermilch ausgeschieden. Serum- und Milchproben wurden nach 3-tägiger Behandlung im Steady State aus einer veröffentlichten Studie mit 12 stillenden Frauen entnommen, die BIAXIN 250 mg zweimal täglich oral einnahmen. Basierend auf den begrenzten Daten aus dieser Studie und unter der Annahme einer Milchaufnahme von 150 ml/kg/Tag würde ein Säugling, der ausschließlich mit Muttermilch gefüttert wird, bei dieser mütterlichen Dosierung schätzungsweise durchschnittlich 136 mcg/kg/Tag Clarithromycin und seinen aktiven Metaboliten erhalten Regime. Dies sind weniger als 2 % der auf das Gewicht der Mutter angepassten Dosis (7,8 mg/kg/Tag, basierend auf dem durchschnittlichen Gewicht der Mutter von 64 kg) und weniger als 1 % der pädiatrischen Dosis (15 mg/kg/Tag). Kinder älter als 6 Monate.
Eine prospektive Beobachtungsstudie mit 55 gestillten Säuglingen von Müttern, die ein Makrolid-Antibiotikum einnahmen (6 waren Clarithromycin ausgesetzt), wurde mit 36 gestillten Säuglingen von Müttern verglichen, die Amoxicillin einnahmen. Die Nebenwirkungen waren in beiden Gruppen vergleichbar. Nebenwirkungen traten bei 12,7 % der Säuglinge auf, die Makroliden ausgesetzt waren, und schlossen Hautausschlag, Durchfall, Appetitlosigkeit und Somnolenz ein.
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von BIAXIN Filmtab und BIAXIN 500 mg Granulat wurde für die Behandlung der folgenden Beschwerden oder Krankheiten bei pädiatrischen Patienten ab 6 Monaten nachgewiesen. Die Anwendung bei diesen Indikationen basiert auf klinischen Studien bei pädiatrischen Patienten oder adäquaten und gut kontrollierten Studien bei Erwachsenen mit zusätzlichen Daten zur Pharmakokinetik und Sicherheit bei pädiatrischen Patienten:
Die Sicherheit und Wirksamkeit von BIAXIN 500 mg Filmtab und BIAXIN 500 mg Granulat wurden zur Prävention der disseminierten Mycobacterium avium-Komplex (MAC)-Erkrankung bei pädiatrischen Patienten ab 20 Monaten mit fortgeschrittener HIV-Infektion nachgewiesen. Es wurden keine Studien mit BIAXIN zur MAC-Prophylaxe in pädiatrischen Populationen durchgeführt und die für die Prophylaxe empfohlenen Dosen stammen aus pädiatrischen MAC-Behandlungsstudien.
Die Sicherheit und Wirksamkeit von BIAXIN 500 mg XL Filmtab bei der Behandlung von pädiatrischen Patienten wurde nicht nachgewiesen.
Die Sicherheit und Wirksamkeit von BIAXIN 250 mg bei pädiatrischen Patienten unter 6 Monaten wurde nicht nachgewiesen. Die Sicherheit von BIAXIN 500 mg wurde bei MAC-Patienten unter 20 Monaten nicht untersucht.
Geriatrische Verwendung
In einer Steady-State-Studie, in der gesunde ältere Probanden (im Alter von 65 bis 81 Jahren) alle 12 Stunden 500 mg BIAXIN erhielten, waren die maximalen Serumkonzentrationen und die Fläche unter den Kurven von Clarithromycin und 14-OH-Clarithromycin im Vergleich zu erhöht denen, die bei gesunden jungen Erwachsenen erreicht werden. Diese Veränderungen in der Pharmakokinetik gehen mit bekannten altersbedingten Abnahmen der Nierenfunktion einher. In klinischen Studien traten bei älteren Patienten im Vergleich zu jüngeren Patienten keine erhöhten Nebenwirkungen auf. Erwägen Sie eine Dosisanpassung bei älteren Patienten mit schwerer Nierenfunktionsstörung. Ältere Patienten können anfälliger für die Entwicklung von Torsades-de-pointes-Arrhythmien sein als jüngere Patienten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Die meisten Berichte über akute Nierenschäden mit Calciumkanalblockern, die durch CYP3A4 metabolisiert werden (z. B. Verapamil, Amlodipin, Diltiazem, Nifedipin), betrafen ältere Patienten im Alter von 65 Jahren oder älter [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Insbesondere bei älteren Patienten gab es Berichte über Colchicin-Toxizität bei gleichzeitiger Anwendung von Clarithromycin und Colchicin, von denen einige bei Patienten mit Niereninsuffizienz auftraten. Bei einigen Patienten wurde über Todesfälle berichtet [siehe KONTRAINDIKATIONEN und WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Nieren- und Leberfunktionsstörung
BIAXIN 500 mg wird hauptsächlich über Leber und Niere ausgeschieden. BIAXIN kann Patienten mit eingeschränkter Leberfunktion und normaler Nierenfunktion ohne Dosisanpassung verabreicht werden. Bei Vorliegen einer schweren Nierenfunktionsstörung mit oder ohne gleichzeitig bestehender Leberfunktionsstörung können jedoch eine verringerte Dosierung oder verlängerte Dosierungsintervalle angebracht sein [vgl DOSIERUNG UND ANWENDUNG ].
VERWEISE
1. Winkel P, Hilden J, Hansen JF, Kastrup J, Kolmos HJ, Kjøller E, et al. Clarithromycin bei stabiler koronarer Herzkrankheit erhöht in der randomisierten, verblindeten klinischen CLARICOR-Studie über 10 Jahre die Gesamtmortalität und die kardiovaskuläre Mortalität sowie die zerebrovaskuläre Morbidität. Int. J. Cardiol 2015;182:459-65.
ÜBERDOSIS
Eine Überdosierung von BIAXIN kann gastrointestinale Symptome wie Bauchschmerzen, Erbrechen, Übelkeit und Durchfall verursachen.
Behandeln Sie Nebenwirkungen, die mit einer Überdosierung einhergehen, durch sofortige Eliminierung nicht resorbierter Arzneimittel und unterstützende Maßnahmen. Wie bei anderen Makroliden wird erwartet, dass die Serumkonzentrationen von BIAXIN durch Hämodialyse oder Peritonealdialyse nicht nennenswert beeinflusst werden.
KONTRAINDIKATIONEN
Überempfindlichkeit
BIAXIN ist kontraindiziert bei Patienten mit bekannter Überempfindlichkeit gegenüber Clarithromycin, Erythromycin oder einem der Makrolid-Antibiotika [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Herzrhythmusstörungen
Die gleichzeitige Verabreichung von BIAXIN mit Cisaprid und Pimozid ist kontraindiziert [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Es gab Postmarketing-Berichte über Arzneimittelwechselwirkungen bei gleichzeitiger Anwendung von Clarithromycin mit Cisaprid oder Pimozid, die zu Herzrhythmusstörungen (QT-Verlängerung, ventrikuläre Tachykardie, Kammerflimmern und Torsades de Pointes) führten, höchstwahrscheinlich aufgrund der Hemmung des Metabolismus dieser Arzneimittel durch BIAXIN . Es wurden Todesfälle gemeldet.
Cholestatische Gelbsucht/Leberfunktionsstörung
BIAXIN ist kontraindiziert bei Patienten mit cholestatischem Ikterus oder Leberfunktionsstörungen in der Vorgeschichte im Zusammenhang mit der vorherigen Anwendung von Clarithromycin.
Colchicin
Die gleichzeitige Verabreichung von BIAXIN und Colchicin ist bei Patienten mit eingeschränkter Nieren- oder Leberfunktion kontraindiziert.
HMG-CoA-Reduktase-Inhibitoren
Verwenden Sie BIAXIN nicht gleichzeitig mit HMG-CoA-Reduktase-Hemmern (Statinen), die weitgehend durch CYP3A4 (Lovastatin oder Simvastatin) metabolisiert werden, aufgrund des erhöhten Risikos einer Myopathie, einschließlich Rhabdomyolyse [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Ergotalkaloide
Die gleichzeitige Verabreichung von Clarithromycin und Ergotamin oder Dihydroergotamin ist kontraindiziert [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Kontraindikationen für gleichzeitig verabreichte Arzneimittel
Informationen zu Kontraindikationen anderer Arzneimittel, die in Kombination mit BIAXIN indiziert sind, finden Sie in deren vollständigen Verschreibungsinformationen (Abschnitt „Kontraindikationen“).
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Clarithromycin ist ein Makrolid-Antibiotikum [siehe Mikrobiologie ].
Pharmakokinetik
Absorption
BIAXIN 250 mg Filmtab Tabletten mit sofortiger Freisetzung
Die absolute Bioverfügbarkeit von 250-mg-Clarithromycin-Tabletten betrug etwa 50 %. Bei einer Einzeldosis von 500 mg Clarithromycin verzögert Nahrung den Beginn der Resorption von Clarithromycin geringfügig, wodurch die Spitzenzeit von etwa 2 auf 2,5 Stunden verlängert wird. Nahrung erhöht auch die maximale Plasmakonzentration von Clarithromycin um etwa 24 %, beeinflusst jedoch nicht das Ausmaß der Bioverfügbarkeit von Clarithromycin. Nahrung hat keinen Einfluss auf den Beginn der Bildung des aktiven Metaboliten 14-OH-Clarithromycin oder seine maximale Plasmakonzentration, verringert jedoch leicht das Ausmaß der Metabolitenbildung, was durch eine 11 %ige Abnahme der Fläche unter der Plasmakonzentrations-Zeit-Kurve (AUC) angezeigt wird. . Daher kann BIAXIN Filmtab unabhängig von Nahrung verabreicht werden. Bei gesunden menschlichen Probanden (männlich und weiblich), die nicht nüchtern waren, wurden maximale Plasmakonzentrationen innerhalb von 2 bis 3 Stunden nach oraler Gabe erreicht.
BIAXIN 500 mg XL Filmtab Retardtabletten
Clarithromycin-Retardtabletten bieten eine verlängerte Resorption von Clarithromycin aus dem Gastrointestinaltrakt nach oraler Verabreichung. Im Vergleich zu einer gleichen Tagesgesamtdosis von Clarithromycin-Tabletten mit sofortiger Wirkstofffreisetzung liefern Clarithromycin-Retardtabletten niedrigere und spätere Steady-State-Spitzenplasmakonzentrationen, aber äquivalente 24-Stunden-AUCs für Clarithromycin und seinen mikrobiologisch aktiven Metaboliten 14-OH-Clarithromycin. Während das Ausmaß der Bildung von 14-OH-Clarithromycin nach Verabreichung von BIAXIN 500 mg XL Filmtab (2 x 500 mg Tabletten einmal täglich) nicht durch Nahrung beeinflusst wird, ist die Verabreichung unter nüchternen Bedingungen mit einer etwa 30 % niedrigeren AUC von Clarithromycin im Vergleich zur Einnahme mit Nahrung verbunden . Daher sollte BIAXIN 250 mg XL Filmtab mit einer Mahlzeit eingenommen werden.
Abbildung 2: Steady-State-Clarithromycin-Plasmakonzentrations-Zeit-Profile 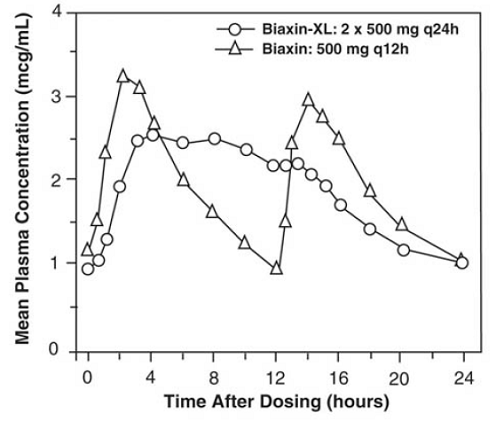
BIAXIN Granulat zur oralen Suspension
Als 250-mg-Dosen von Clarithromycin als BIAXIN als orale Suspension an nüchterne gesunde erwachsene Probanden verabreicht wurden, wurden maximale Plasmakonzentrationen etwa 3 Stunden nach der Einnahme erreicht.
Bei erwachsenen Patienten ist die Bioverfügbarkeit von 10 ml der 125-mg/5-ml-Suspension oder 10 ml der 250-mg/5-ml-Suspension ähnlich der einer 250-mg- bzw. 500-mg-Tablette.
Bei Erwachsenen, denen 250 mg Clarithromycin als Suspension verabreicht wurden (n = 22), schien Nahrung die mittleren Clarithromycin-Spitzenkonzentrationen im Plasma von 1,2 (± 0,4) µg/ml auf 1,0 (± 0,4) µg/ml und das Ausmaß der Resorption von 7,2 (± 2,5) Std.•µg/ml bis 6,5 (± 3,7) Std.•µg/ml.
Verteilung
Clarithromycin und der 14-OH-Clarithromycin-Metabolit verteilen sich leicht in Körpergewebe und -flüssigkeiten. Es liegen keine Daten zur Penetration von Liquor cerebrospinalis vor. Aufgrund der hohen intrazellulären Konzentrationen sind die Gewebekonzentrationen höher als die Serumkonzentrationen. Beispiele für Gewebe- und Serumkonzentrationen sind unten angegeben.
Stoffwechsel und Ausscheidung
BIAXIN 500 mg Filmtab Tabletten mit sofortiger Freisetzung
Steady-State-Spitzenplasmakonzentrationen von Clarithromycin wurden innerhalb von 3 Tagen erreicht und betrugen etwa 1 µg/ml bis 2 µg/ml bei einer alle 12 Stunden verabreichten Dosis von 250 mg und 3 µg/ml bis 4 µg/ml bei einer alle 12 Stunden verabreichten Dosis von 500 mg 8 Stunden bis 12 Stunden. Die Eliminationshalbwertszeit von Clarithromycin betrug etwa 3 Stunden bis 4 Stunden bei einer Gabe von 250 mg alle 12 Stunden, erhöhte sich jedoch auf 5 Stunden bis 7 Stunden bei einer Gabe von 500 mg alle 8 Stunden bis 12 Stunden. Die Nichtlinearität der Pharmakokinetik von Clarithromycin ist bei den empfohlenen Dosen von 250 mg und 500 mg, die alle 8 bis 12 Stunden verabreicht werden, gering. Bei einer Dosierung von 250 mg alle 12 Stunden erreicht der Hauptmetabolit, 14-OH-Clarithromycin, eine maximale Steady-State-Konzentration von etwa 0,6 µg/ml und hat eine Eliminationshalbwertszeit von 5 bis 6 Stunden. Bei einer Dosierung von 500 mg alle 8 bis 12 Stunden ist die maximale Steady-State-Konzentration von 14-OH-Clarithromycin etwas höher (bis zu 1 µg/ml), und seine Eliminationshalbwertszeit beträgt etwa 7 bis 9 Stunden. Bei jedem dieser Dosierungsschemata wird die Steady-State-Konzentration dieses Metaboliten im Allgemeinen innerhalb von 3 bis 4 Tagen erreicht.
Nach einer 250-mg-Tablette alle 12 Stunden werden etwa 20 % der Dosis als Clarithromycin im Urin ausgeschieden, während nach einer 500-mg-Tablette alle 12 Stunden die Urinausscheidung von Clarithromycin mit etwa 30 % etwas größer ist. Im Vergleich dazu werden nach einer oralen Dosis von 250 mg (125 mg/5 ml) Suspension alle 12 Stunden etwa 40 % als Clarithromycin im Urin ausgeschieden. Die renale Clearance von Clarithromycin ist jedoch relativ unabhängig von der Dosisgröße und nähert sich der normalen glomerulären Filtrationsrate. Der Hauptmetabolit im Urin ist 14-OH-Clarithromycin, das weitere 10 % bis 15 % der Dosis ausmacht, wenn entweder eine 250-mg- oder eine 500-mg-Tablette alle 12 Stunden verabreicht wird.
BIAXIN 250 mg XL Filmtab Retardtabletten
Bei gesunden Probanden wurden Plasmaspitzenkonzentrationen von Clarithromycin im Steady State von etwa 2 µg/ml bis 3 µg/ml etwa 5 Stunden bis 8 Stunden nach oraler Gabe von 1000 mg BIAXIN 250 mg XL Filmtab einmal täglich erreicht; für 14-OH-Clarithromycin wurden Steady-State-Spitzenplasmakonzentrationen von etwa 0,8 µg/ml etwa 6 Stunden bis 9 Stunden nach der Einnahme erreicht. Maximale Clarithromycin-Plasmakonzentrationen im Steady-State von ungefähr 1 µg/ml bis 2 µg/ml wurden etwa 5 Stunden bis 6 Stunden nach oraler Gabe einer einzelnen 500 mg BIAXIN XL Filmtab einmal täglich erreicht; für 14-OH-Clarithromycin wurden Steady-State-Spitzenplasmakonzentrationen von etwa 0,6 µg/ml etwa 6 Stunden nach der Einnahme erreicht.
Steady-State-Spitzenplasmakonzentrationen wurden nach 2 bis 3 Tagen erreicht und betrugen etwa 2 µg/ml für Clarithromycin und 0,7 µg/ml für 14-OH-Clarithromycin, wenn 250-mg-Dosen der Clarithromycin-Suspension alle 12 Stunden verabreicht wurden. Die Eliminationshalbwertszeit von Clarithromycin (3 Stunden bis 4 Stunden) und die von 14-OH-Clarithromycin (5 Stunden bis 7 Stunden) waren ähnlich denen, die im Steady State nach Verabreichung äquivalenter Dosen von BIAXIN Filmtab beobachtet wurden.
Spezifische Populationen für BIAXIN Filmtab, BIAXIN 500 mg XL Filmtab und BIAXIN 250 mg Granulatformulierungen
BIAXIN Granulat zur oralen Suspension bei pädiatrischen Patienten
Clarithromycin dringt in die Mittelohrflüssigkeit von pädiatrischen Patienten mit sekretorischer Mittelohrentzündung ein.
Als pädiatrische Patienten (n = 10) eine orale Einzeldosis von 7,5 mg/kg BIAXIN 500 mg als Suspension zum Einnehmen erhielten, erhöhte die Nahrung die mittleren Clarithromycin-Plasmakonzentrationen von 3,6 (± 1,5) µg/ml auf 4,6 (± 2,8) µg/ml. ml und das Ausmaß der Absorption von 10,0 (± 5,5) Std.•µg/ml bis 14,2 (± 9,4) Std.•µg/ml.
Bei pädiatrischen Patienten, die eine antibakterielle Therapie benötigten, führte die Verabreichung von 7,5 mg/kg alle 12 Stunden von BIAXIN als Suspension zum Einnehmen im Allgemeinen zu maximalen Plasmakonzentrationen im Steady State von 3 µg/ml bis 7 µg/ml für Clarithromycin und 1 µg/ml bis 2 mcg/ml für 14-OH-Clarithromycin.
Bei HIV-infizierten pädiatrischen Patienten, die alle 12 Stunden 15 mg/kg BIAXIN als orale Suspension einnahmen, lagen die Spitzenkonzentrationen von Clarithromycin im Steady State im Allgemeinen im Bereich von 6 µg/ml bis 15 µg/ml.
HIV infektion
Steady-State-Konzentrationen von Clarithromycin und 14-OH-Clarithromycin, die nach Gabe von 500 mg Clarithromycin alle 12 Stunden bei erwachsenen Patienten mit HIV-Infektion beobachtet wurden, waren ähnlich denen, die bei gesunden Probanden beobachtet wurden. Bei erwachsenen HIV-infizierten Patienten, die alle 12 Stunden eine Dosis von 500 mg oder 1000 mg Clarithromycin einnahmen, lagen die Steady-State-Cmax-Werte von Clarithromycin im Bereich von 2 µg/ml bis 4 µg/ml bzw. 5 µg/ml bis 10 µg/ml .
Leberfunktionsstörung
Die Steady-State-Konzentrationen von Clarithromycin bei Probanden mit eingeschränkter Leberfunktion unterschieden sich nicht von denen bei gesunden Probanden; die 14-OH-Clarithromycin-Konzentrationen waren jedoch bei den Patienten mit eingeschränkter Leberfunktion niedriger. Die verringerte Bildung von 14-OH-Clarithromycin wurde zumindest teilweise durch eine Erhöhung der renalen Clearance von Clarithromycin bei den Probanden mit eingeschränkter Leberfunktion im Vergleich zu gesunden Probanden ausgeglichen.
Nierenfunktionsstörung
Die Pharmakokinetik von Clarithromycin war auch bei Patienten mit eingeschränkter Nierenfunktion verändert [siehe Verwendung in bestimmten Bevölkerungsgruppen und DOSIERUNG UND ANWENDUNG ].
Wechselwirkungen mit anderen Medikamenten
Fluconazol
Nach Verabreichung von täglich 200 mg Fluconazol und zweimal täglich 500 mg Clarithromycin an 21 gesunde Probanden erhöhten sich Cmin und AUC von Clarithromycin im Steady State um 33 % bzw. 18 %. Die Clarithromycin-Exposition war erhöht und die Steady-State-Konzentrationen von 14-OH-Clarithromycin wurden durch die gleichzeitige Gabe von Fluconazol nicht signifikant beeinflusst.
Colchicin
Wenn eine Einzeldosis von 0,6 mg Colchicin zusammen mit 250 mg Clarithromycin zweimal täglich über 7 Tage verabreicht wurde, stieg die Cmax von Colchicin um 197 % und die AUC0-∞ um 239 % im Vergleich zur alleinigen Gabe von Colchicin.
Atazanavir
Nach Verabreichung von Clarithromycin (500 mg zweimal täglich) mit Atazanavir (400 mg einmal täglich) stieg die AUC von Clarithromycin um 94 %, die AUC von 14-OH-Clarithromycin nahm um 70 % ab und die AUC von Atazanavir stieg um 28 %.
Ritonavir
Die gleichzeitige Verabreichung von Clarithromycin und Ritonavir (n = 22) führte zu einem Anstieg der AUC von Clarithromycin um 77 % und einer Abnahme der AUC von 14-OH-Clarithromycin um 100 %.
Saquinavir
Nach Verabreichung von Clarithromycin (500 mg zweimal täglich) und Saquinavir (Weichgelatinekapseln, 1200 mg dreimal täglich) an 12 gesunde Probanden erhöhten sich die AUC und Cmax von Saquinavir im Steady State um 177 % bzw. 187 % im Vergleich zur alleinigen Verabreichung von Saquinavir. Die AUC und Cmax von Clarithromycin erhöhten sich um 45 % bzw. 39 %, während die AUC und Cmax von 14-OH-Clarithromycin um 24 % bzw. 34 % abnahmen, verglichen mit der Verabreichung von Clarithromycin allein.
Didanosin
Die gleichzeitige Verabreichung von Clarithromycin-Tabletten und Didanosin an 12 HIV-infizierte erwachsene Patienten führte zu keiner statistisch signifikanten Veränderung der Pharmakokinetik von Didanosin.
Zidovudin
Nach Gabe von Clarithromycin 500 mg Tabletten zweimal täglich mit Zidovudin 100 mg alle 4 Stunden verringerte sich die AUC von Zidovudin im Steady State um 12 % im Vergleich zur Gabe von Zidovudin allein (n = 4). Die einzelnen Werte reichten von einem Rückgang von 34 % bis zu einem Anstieg von 14 %. Wenn Clarithromycin-Tabletten zwei bis vier Stunden vor Zidovudin eingenommen wurden, stieg die Steady-State-Cmax von Zidovudin um 100 %, während die AUC unbeeinflusst blieb (n = 24).
Omeprazol
Clarithromycin 500 mg alle 8 Stunden wurde in Kombination mit Omeprazol 40 mg täglich an gesunde erwachsene Probanden verabreicht. Die Steady-State-Plasmakonzentrationen von Omeprazol waren durch die gleichzeitige Gabe von Clarithromycin erhöht (Anstieg von Cmax, AUC0-24 und t½ um 30 %, 89 % bzw. 34 %).
Die Plasmaspiegel von Clarithromycin und 14-OH-Clarithromycin wurden durch die gleichzeitige Verabreichung von Omeprazol erhöht. Bei Clarithromycin war die mittlere Cmax um 10 % höher, die mittlere Cmin um 27 % höher und die mittlere AUC0-8 um 15 % höher, wenn Clarithromycin zusammen mit Omeprazol verabreicht wurde, als wenn Clarithromycin allein verabreicht wurde. Ähnliche Ergebnisse wurden für 14-OH-Clarithromycin beobachtet, die mittlere Cmax war um 45 % höher, die mittlere Cmin war um 57 % höher und die mittlere AUC0-8 war um 45 % höher. Clarithromycin-Konzentrationen im Magengewebe und Schleim wurden auch durch die gleichzeitige Gabe von Omeprazol erhöht.
Clarithromycin-Gewebekonzentrationen 2 Stunden nach der Einnahme (µg/ml)/(µg/g)
Theophyllin
In zwei Studien, in denen Theophyllin zusammen mit Clarithromycin verabreicht wurde (eine Theophyllin-Retardformulierung wurde entweder mit 6,5 mg/kg oder 12 mg/kg zusammen mit 250 oder 500 mg Clarithromycin alle 12 Stunden dosiert), lagen die Steady-State-Spiegel von Cmax, Cmin, und die Fläche unter der Serumkonzentrations-Zeit-Kurve (AUC) von Theophyllin nahm um etwa 20 % zu.
Midazolam
Bei gleichzeitiger Gabe einer Einzeldosis Midazolam mit Clarithromycin-Tabletten (500 mg zweimal täglich über 7 Tage) stieg die AUC von Midazolam nach intravenöser Gabe von Midazolam um 174 % und nach oraler Gabe um 600 %.
Informationen zu anderen Arzneimitteln, die in Kombination mit BIAXIN indiziert sind, finden Sie in den vollständigen Verschreibungsinformationen. KLINISCHE PHARMAKOLOGIE Sektion.
Mikrobiologie
Wirkmechanismus
Clarithromycin übt seine antibakterielle Wirkung aus, indem es an die ribosomale 50S-Untereinheit empfindlicher Bakterien bindet, was zu einer Hemmung der Proteinsynthese führt.
Widerstand
Die Hauptwege der Resistenz sind die Modifikation der 23S-rRNA in der ribosomalen 50S-Untereinheit gegenüber Insensitivität oder Medikamenten-Efflux-Pumpen. Die Beta-Lactamase-Produktion sollte keinen Einfluss auf die Aktivität von Clarithromycin haben.
Die meisten Isolate Methicillin-resistenter und Oxacillin-resistenter Staphylokokken sind resistent gegen Clarithromycin.
Wenn H. pylori nach der Behandlung mit Clarithromycin-haltigen Kombinationsschemata nicht eradiziert wird, können Patienten in H. pylori-Isolaten eine Clarithromycin-Resistenz entwickeln. Daher sollte bei Patienten, bei denen die Therapie versagt, nach Möglichkeit ein Clarithromycin-Empfindlichkeitstest durchgeführt werden. Patienten mit Clarithromycin-resistentem H. pylori sollten nicht mit einem der folgenden behandelt werden: Omeprazol/Clarithromycin-Dualtherapie; Dreifachtherapie mit Omeprazol/Clarithromycin/Amoxicillin; Dreifachtherapie mit Lansoprazol/Clarithromycin/Amoxicillin; oder andere Behandlungsschemata, die Clarithromycin als einzigen antibakteriellen Wirkstoff enthalten.
Antimikrobielle Aktivität
Es wurde gezeigt, dass Clarithromycin gegen die meisten Isolate der folgenden Mikroorganismen sowohl in vitro als auch bei klinischen Infektionen aktiv ist [siehe INDIKATIONEN UND VERWENDUNG ].
Gram-positive Bakterien
Gramnegative Bakterien
Andere Mikroorganismen
Mindestens 90 Prozent der unten aufgeführten Mikroorganismen weisen minimale In-vitro-Hemmkonzentrationen (MHK) auf, die kleiner oder gleich dem Clarithromycin-empfindlichen MHK-Grenzwert für Organismen ähnlicher Art sind, wie sie in Tabelle 11 gezeigt sind. Die Wirksamkeit von Clarithromycin bei der Behandlung klinischer Infektionen aufgrund dieser Mikroorganismen wurde in angemessenen und gut kontrollierten klinischen Studien nicht nachgewiesen.
Gram-positive Bakterien
Gramnegative Bakterien
Anaerobe Bakterien
Empfindlichkeitsprüfung
Spezifische Informationen zu den Interpretationskriterien von Empfindlichkeitstests und zugehörigen Testmethoden und Qualitätskontrollstandards, die von der FDA für dieses Medikament anerkannt sind, finden Sie unter: http://www.fda.gov/STIC.
Tiertoxikologie und/oder Pharmakologie
Hornhauttrübung trat bei Hunden bei Dosen auf, die das 12-Fache und bei Affen bei Dosen, die 8-mal höher waren als die maximale Tagesdosis beim Menschen (bezogen auf die Körperoberfläche), auftraten. Eine lymphoide Depletion trat bei Hunden bei Dosen auf, die dreimal höher waren als bei Affen, und bei Dosen, die zweimal höher waren als die maximale menschliche Tagesdosis (auf Basis der Körperoberfläche).
Klinische Studien
Mykobakterielle Infektionen
Prophylaxe mykobakterieller Infektionen
In einer randomisierten, doppelblinden klinischen Studie (Studie 3) wurde Clarithromycin 500 mg zweimal täglich mit Placebo bei Patienten mit CDC-definiertem AIDS und einer CD4-Zahl von weniger als 100 Zellen/μl verglichen. An dieser Studie nahmen von November 1992 bis Januar 1994 682 Patienten teil, mit einer medianen CD4-Zellzahl bei Eintritt von 30 Zellen/μl. Die mediane Dauer von BIAXIN 500 mg betrug 10,6 Monate gegenüber 8,2 Monaten für Placebo. Mehr Patienten im Placebo-Arm als im BIAXIN-Arm brachen die Studie vorzeitig ab (75,6 % bzw. 67,4 %). Wenn jedoch vorzeitiges Absetzen aufgrund von Mycobacterium avium-Komplex (MAC) oder Tod ausgeschlossen wird, brachen ungefähr gleiche Prozentsätze der Patienten in jedem Arm (54,8 %) unter BIAXIN und 52,5 % unter Placebo) das Studienmedikament aus anderen Gründen vorzeitig ab. Die Studie wurde entwickelt, um die folgenden Endpunkte zu bewerten:
MAC Bakteriämie
Bei Patienten, die für BIAXIN randomisiert wurden, war das Risiko einer MAC-Bakteriämie im Vergleich zu Placebo um 69 % reduziert. Der Unterschied zwischen den Gruppen war statistisch signifikant (p
Überleben
Es wurde ein statistisch signifikanter Überlebensvorteil von BIAXIN im Vergleich zu Placebo beobachtet (siehe Abbildung 3 und Tabelle 13). Da die Analyse nach 18 Monaten Patienten umfasst, die keine Prophylaxe mehr erhalten, kann der Überlebensvorteil von BIAXIN 250 mg unterschätzt werden.
Abbildung 3: Überleben aller randomisierten AIDS-Patienten im Laufe der Zeit in Studie 3 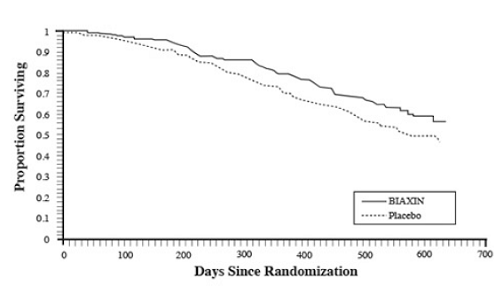
Klinisch signifikante disseminierte MAC-Erkrankung
In Verbindung mit der verringerten Inzidenz von MAC-Bakteriämie zeigten Patienten in der Gruppe, die randomisiert BIAXIN erhalten hatte, eine Verringerung der Anzeichen und Symptome einer disseminierten MAC-Erkrankung, einschließlich Fieber, Nachtschweiß, Gewichtsverlust und Anämie.
Behandlung mykobakterieller Infektionen
Dosisbereichs-Monotherapie-Studien bei erwachsenen AIDS-Patienten mit MAC
Zwei randomisierte klinische Studien (Studien 1 und 2) verglichen unterschiedliche Dosierungen von BIAXIN bei Patienten mit CDC-definiertem AIDS und einer CD4-Zahl von weniger als 100 Zellen/μl. An diesen Studien nahmen Patienten von Mai 1991 bis März 1992 teil. Studie 500 war eine randomisierte, doppelblinde Studie; Studie 577 war eine Open-Label-Compassionate-Use-Studie. In beiden Studien wurden BIAXIN-Dosierungen von 500 mg und 1000 mg zweimal täglich verwendet; Studie 1 hatte auch eine Gruppe mit 2000 mg zweimal täglich BIAXIN 500 mg. In Studie 1 wurden 154 erwachsene Patienten und in Studie 2 469 erwachsene Patienten eingeschlossen. Die Mehrheit der Patienten hatte zu Studienbeginn eine CD4-Zellzahl von weniger als 50 Zellen/μl. Die Studien wurden entwickelt, um die folgenden Endpunkte zu bewerten:
Die Ergebnisse für Versuch 1 sind nachstehend beschrieben. Die Ergebnisse von Versuch 2 waren ähnlich wie die Ergebnisse von Versuch 1.
MAC Bakteriämie
Ein Rückgang der MAC-Bakteriämie oder negativer Blutkulturen wurde bei der Mehrzahl der Patienten in allen 500-mg-BIAXIN-Dosierungsgruppen beobachtet. Die durchschnittliche Verringerung der MAC-koloniebildenden Einheiten (KBE) gegenüber dem Ausgangswert nach 4-wöchiger Therapie in der Dosierung mit 1000 mg (n = 32) zweimal täglich und 2000 mg (n = 26) zweimal täglich betrug 2,3 log KBE im Vergleich zu 1,5 log KBE das BIAXIN 500 mg zweimal täglich (n = 35) Schema. Eine separate Studie mit einem Regime aus vier Medikamenten2 (Ciprofloxacin, Ethambutol, Rifampicin und Clofazimin) hatte eine mittlere Reduktion von 1,4 log KBE.
Die mit den verschiedenen Dosierungsschemata der Clarithromycin-Monotherapie bewerteten klinischen Ergebnisse sind in Tabelle 14 dargestellt. Die Dosierungen von 1000 mg und 2000 mg zweimal täglich zeigten eine signifikant bessere Kontrolle der Bakteriämie während der ersten vier Wochen der Therapie. Über diesen Punkt hinaus wurden keine signifikanten Unterschiede festgestellt. Alle Isolate hatten vor der Behandlung eine MHK von weniger als 8 mcg/ml. Ein Rückfall wurde fast immer von einem Anstieg der MHK begleitet.
Klinisch signifikante disseminierte MAC-Erkrankung
Bei 84 % der Patienten, bei denen vor der Therapie Nachtschweiß auftrat, kam es irgendwann während der 12-wöchigen Behandlung mit BIAXIN in Dosen von 500 mg bis 2000 mg zweimal täglich zu einer Besserung oder Besserung. In ähnlicher Weise berichteten 77 % der Patienten irgendwann von einem Rückgang oder einer Verbesserung des Fiebers. Ansprechraten für klinische Anzeichen von MAC sind in Tabelle 15 unten angegeben.
Die mediane Dauer des Ansprechens, definiert als Verbesserung oder Abklingen der klinischen Anzeichen und Symptome, betrug 2 Wochen bis 6 Wochen.
Da die Studie nicht darauf ausgelegt war, den Nutzen einer Monotherapie über 12 Wochen hinaus zu bestimmen, kann die Dauer des Ansprechens bei den 25 % bis 33 % der Patienten, die nach 12 Wochen weiterhin ein klinisches Ansprechen zeigten, unterschätzt werden.
Überleben
Die mediane Überlebenszeit ab Studieneintritt (Studie 1) betrug 249 Tage bei der Dosis von 500 mg zweimal täglich im Vergleich zu 215 Tagen bei der Dosis von 1000 mg zweimal täglich. Während der ersten 12 Behandlungswochen gab es jedoch 2 Todesfälle bei 53 Patienten in der Gruppe mit zweimal täglich 500 mg gegenüber 13 Todesfällen bei 51 Patienten in der Gruppe mit zweimal täglich 1000 mg. Der Grund für diesen offensichtlichen Sterblichkeitsunterschied ist nicht bekannt. Das Überleben in den beiden Gruppen war über 12 Wochen hinaus ähnlich. Die medianen Überlebenszeiten für diese Dosierungen waren bei Behandlung mit Kombinationstherapien ähnlich denen kürzlich durchgeführter historischer Kontrollen mit MAC.2
Die mediane Überlebenszeit ab Eintritt in Studie 2 betrug 199 Tage für die Dosis von 500 mg zweimal täglich und 179 Tage für die Dosis von 1000 mg zweimal täglich. Während die Patienten in den ersten vier Behandlungswochen ihre ursprünglich zugewiesene Dosis beibehielten, gab es 11 Todesfälle bei 255 Patienten, die zweimal täglich 500 mg einnahmen, und 18 Todesfälle bei 214 Patienten, die zweimal täglich 1000 mg einnahmen.
Dosisbereichs-Monotherapie-Studien bei pädiatrischen AIDS-Patienten mit MAC
Studie 4 war eine pädiatrische Studie mit 3,75 mg/kg, 7,5 mg/kg und 15 mg/kg BIAXIN zweimal täglich bei Patienten mit CDC-definiertem AIDS und einer CD4-Zahl von weniger als 100 Zellen/μl. In die Studie wurden 25 Patienten im Alter von 1 bis 20 Jahren aufgenommen. Die Studie bewertete die gleichen Endpunkte wie in den Erwachsenenstudien 1 und 2. Die Ergebnisse der 7,5 mg/kg zweimal täglichen Dosis in der pädiatrischen Studie waren mit denen der 500 mg vergleichbar zweimal täglich in den Studien mit Erwachsenen.
Kombinationstherapie bei AIDS-Patienten mit disseminiertem MAC
Studie 5 verglich die Sicherheit und Wirksamkeit von BIAXIN 250 mg in Kombination mit Ethambutol mit BIAXIN 250 mg in Kombination mit Ethambutol und Clofazimin zur Behandlung von disseminierter MAC (dMAC)-Infektion. In diese 24-wöchige Studie wurden 106 Patienten mit AIDS und dMAC aufgenommen, wobei 55 Patienten randomisiert BIAXIN 500 mg und Ethambutol und 51 Patienten randomisiert Clarithromycin, Ethambutol und Clofazime erhielten. Die Baseline-Charakteristika zwischen den Behandlungsarmen waren ähnlich, mit Ausnahme der medianen CFU-Zahlen, die im Arm mit BIAXIN 500 mg, Ethambutol und Clofazim mindestens 1 log höher waren.
Im Vergleich zu früheren Erfahrungen mit der Clarithromycin-Monotherapie verlängerte die Zwei-Drogen-Therapie mit Clarithromycin und Ethambutol die Zeit bis zum mikrobiologischen Rückfall, hauptsächlich durch die Unterdrückung des Auftretens von Clarithromycin-resistenten Stämmen. Die Zugabe von Clofazimin zum Regime brachte jedoch keinen zusätzlichen mikrobiologischen oder klinischen Nutzen. Die Verträglichkeit beider Kombinationstherapien war vergleichbar, wobei die häufigsten unerwünschten Ereignisse gastrointestinaler Natur waren. Patienten, die das Clofazimin-haltige Regime erhielten, hatten reduzierte Überlebensraten; jedoch waren ihre Ausgangswerte für mykobakterielle Kolonien höher. Die Ergebnisse dieser Studie unterstützen die Zugabe von Ethambutol zu Clarithromycin zur Behandlung anfänglicher dMAC-Infektionen, unterstützen jedoch nicht die Zugabe von Clofazimin als drittem Wirkstoff.
Mittelohrentzündung
Otitis-Media-Studie mit BIAXIN vs. oralem Cephalosporin
In einer kontrollierten klinischen Studie an pädiatrischen Patienten mit akuter Mittelohrentzündung, die in den Vereinigten Staaten durchgeführt wurde und in der signifikante Raten von Beta-Lactamase-produzierenden Organismen gefunden wurden, wurde BIAXIN 500 mg mit einem oralen Cephalosporin verglichen. In dieser Studie wurden strenge Bewertungskriterien verwendet, um das klinische Ansprechen zu bestimmen. Bei den 223 Patienten, die auf klinische Wirksamkeit untersucht wurden, betrug die klinische Erfolgsrate (dh Heilung plus Besserung) beim Besuch nach der Therapie 88 % für BIAXIN 500 mg und 91 % für Cephalosporin.
Bei einer kleineren Anzahl von Patienten wurden mikrobiologische Bestimmungen beim Besuch vor der Behandlung durchgeführt. Die voraussichtlichen Ergebnisse der bakteriellen Eradikation/klinischen Heilung (d. h. klinischer Erfolg) sind in Tabelle 16 aufgeführt.
Otitis-Media-Studien zu BIAXIN vs. antimikrobiellem/Beta-Lactamase-Inhibitor
In zwei anderen kontrollierten klinischen Studien zu akuter Mittelohrentzündung, die in den Vereinigten Staaten durchgeführt wurden und in denen signifikante Raten von Beta-Lactamase-produzierenden Organismen festgestellt wurden, wurde BIAXIN mit einem oralen antimikrobiellen Mittel verglichen, das einen spezifischen Beta-Lactamase-Hemmer enthielt. In diesen Studien wurden strenge Bewertungskriterien verwendet, um das klinische Ansprechen zu bestimmen. Bei den 233 Patienten, die auf klinische Wirksamkeit untersucht wurden, betrug die kombinierte klinische Erfolgsrate (dh Heilung und Besserung) beim Besuch nach der Therapie 91 % sowohl für BIAXIN 500 mg als auch für die Kontrolle.
Für die Patienten, bei denen beim Besuch vor der Behandlung mikrobiologische Untersuchungen durchgeführt wurden, sind die voraussichtlichen Ergebnisse der bakteriellen Eradikation/klinischen Heilung (d. h. der klinische Erfolg) in Tabelle 17 aufgeführt.
H. pylori-Eradikation zur Verringerung des Risikos eines erneuten Auftretens von Zwölffingerdarmgeschwüren
BIAXIN + Lansoprazol und Amoxicillin
Zwei randomisierte, doppelblinde klinische Studien in den USA (Studie 6 und Studie 7) bei Patienten mit H. pylori und Zwölffingerdarmgeschwüren (definiert als aktives Geschwür oder aktives Geschwür in der Vorgeschichte innerhalb eines Jahres) untersuchten die Wirksamkeit von BIAXIN 500 mg zweimal täglich in Kombination mit Lansoprazol 30 mg zweimal täglich und Amoxicillin 1 g zweimal täglich als 14-tägige Dreifachtherapie zur Eradikation von H. pylori.
H. pylori-Eradikation wurde als zwei negative Tests (Kultur und Histologie) 4 bis 6 Wochen nach Behandlungsende definiert.
Die Kombination von BIAXIN plus Lansoprazol und Amoxicillin als Dreifachtherapie war bei der Eradikation von H. pylori wirksam (siehe Ergebnisse in Tabelle 18). Es wurde gezeigt, dass die Eradikation von H. pylori das Risiko eines erneuten Auftretens von Zwölffingerdarmgeschwüren verringert.
Eine randomisierte, doppelblinde klinische Studie (Studie 8), die in den USA bei Patienten mit H. pylori und Zwölffingerdarmgeschwüren (definiert als aktives Geschwür oder Vorgeschichte eines Geschwürs innerhalb eines Jahres) durchgeführt wurde, verglich die Wirksamkeit von BIAXIN 250 mg in Kombination mit Lansoprazol und Amoxicillin als Dreifachtherapie für 10 Tage und 14 Tage. Diese Studie stellte fest, dass die 10-tägige Dreifachtherapie der 14-tägigen Dreifachtherapie bei der Eradikation von H. pylori gleichwertig war (siehe Ergebnisse in Tabelle 18).
BIAXIN + Omeprazol und Amoxicillin-Therapie
Drei randomisierte, doppelblinde klinische Studien in den USA bei Patienten mit H.-pylori-Infektion und Ulcus duodeni (n = 558) verglichen BIAXIN plus Omeprazol und Amoxicillin mit BIAXIN 250 mg plus Amoxicillin. Zwei Studien (Studien 9 und 10) wurden bei Patienten mit einem aktiven Zwölffingerdarmgeschwür durchgeführt, und die dritte Studie (Studie 11) wurde bei Patienten mit einem Zwölffingerdarmgeschwür in den letzten 5 Jahren durchgeführt, jedoch ohne dass zum Zeitpunkt der Aufnahme ein Geschwür bestand . Das Dosierungsschema in den Studien war BIAXIN 500 mg zweimal täglich plus Omeprazol 20 mg zweimal täglich plus Amoxicillin 1 Gramm zweimal täglich für 10 Tage. In den Studien 9 und 10 erhielten Patienten, die das Omeprazol-Regime einnahmen, zusätzlich 18 Tage lang einmal täglich 20 mg Omeprazol. Die untersuchten Endpunkte waren die Eradikation von H. pylori und die Heilung von Zwölffingerdarmgeschwüren (nur Studien 9 und 10). Der H. pylori-Status wurde in allen drei Studien durch CLOtest®, Histologie und Kultur bestimmt. Bei einem bestimmten Patienten galt H. pylori als ausgerottet, wenn mindestens zwei dieser Tests negativ und keiner positiv war. Die Kombination von BIAXIN plus Omeprazol und Amoxicillin war bei der Eradikation von H. pylori wirksam (siehe Ergebnisse in Tabelle 19).
BIAXIN + Omeprazol-Therapie
Vier randomisierte, doppelblinde, multizentrische Studien (Studien 12, 13, 14 und 15) untersuchten BIAXIN 500 mg dreimal täglich plus Omeprazol 40 mg einmal täglich für 14 Tage, gefolgt von Omeprazol 20 mg einmal täglich ( Studien 12, 13 und 15) oder durch Omeprazol 40 mg einmal täglich (Studie 14) für weitere 14 Tage bei Patienten mit aktivem Zwölffingerdarmgeschwür in Verbindung mit H. pylori. Die Studien 12 und 13 wurden in den USA und Kanada durchgeführt und schlossen 242 bzw. 256 Patienten ein. H.-pylori-Infektion und Zwölffingerdarmgeschwür wurden bei 219 Patienten in Studie 12 und 228 Patienten in Studie 13 bestätigt. Diese Studien verglichen das Kombinationsschema mit Omeprazol- und BIAXIN-Monotherapien. Die Studien 14 und 15 wurden in Europa durchgeführt und schlossen 154 bzw. 215 Patienten ein. H.-pylori-Infektion und Zwölffingerdarmgeschwür wurden bei 148 Patienten in Studie 14 und 208 Patienten in Studie 15 bestätigt. In diesen Studien wurde das Kombinationsschema mit einer Omeprazol-Monotherapie verglichen. Die Ergebnisse der Wirksamkeitsanalysen für diese Studien sind in den Tabellen 20, 21 und 22 beschrieben.
Heilung von Zwölffingerdarmgeschwüren
Die Kombination von BIAXIN 250 mg und Omeprazol war bei der Heilung von Zwölffingerdarmgeschwüren genauso wirksam wie Omeprazol allein (siehe Tabelle 20).
Ausrottung von H. pylori im Zusammenhang mit Zwölffingerdarmgeschwür
Die Kombination von BIAXIN 500 mg und Omeprazol war bei der Eradikation von H. pylori wirksam (siehe Tabelle 21). H. pylori-Eradikation wurde definiert als kein positiver Test (Kultur oder Histologie) 4 Wochen nach Ende der Behandlung, und zwei negative Tests waren erforderlich, um als ausgerottet zu gelten. In der Per-Protocol-Analyse wurden die folgenden Patienten ausgeschlossen: Dropouts, Patienten mit schwerwiegenden Protokollverstößen, Patienten mit fehlenden H.-pylori-Tests nach der Behandlung und Patienten, die 4 Wochen nach Ende der Behandlung nicht auf H.-pylori-Eradikation untersucht wurden Behandlung, weil bei ihnen am Ende der Behandlung ein nicht geheiltes Geschwür festgestellt wurde.
Rezidiv des Zwölffingerdarmgeschwürs
Das Wiederauftreten von Geschwüren 6 Monate und 12 Monate nach Ende der Behandlung wurde bei Patienten beurteilt, bei denen Geschwüre nach der Behandlung geheilt waren (siehe die Ergebnisse in Tabelle 22). Somit reduzierte die Eradikation von H. pylori bei Patienten mit Zwölffingerdarmgeschwür in Verbindung mit einer H. pylori-Infektion das Wiederauftreten von Geschwüren.
VERWEISE
2. Kemper CA, et al. Behandlung von Mycobacterium avium-Komplex-Bakterämie bei AIDS mit einem oralen Vier-Drogen-Regime. Ann Intern Med. 1992;116:466-472.
INFORMATIONEN ZUM PATIENTEN
Stellen Sie Patienten die folgenden Anweisungen oder Informationen über BIAXIN 250 mg zur Verfügung: