Myambutol 200mg, 400mg, 600mg, 800mg Ethambutol Hydrochloride Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Myambutol und wie wird es angewendet?
Myambutol ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Tuberkulose. Myambutol 400 mg kann allein oder zusammen mit anderen Medikamenten verwendet werden.
Myambutol gehört zu einer Klasse von Arzneimitteln, die Antituberkulosemittel genannt werden.
Es ist nicht bekannt, ob Myambutol 800 mg bei Kindern unter 13 Jahren sicher und wirksam ist.
Welche Nebenwirkungen kann Myambutol 800mg haben?
Myambutol kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Myambutol gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Myambutol. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
MYAMBUTOL (Ethambutolhydrochlorid) ist ein orales Chemotherapeutikum, das speziell gegen aktiv wachsende Mikroorganismen der Gattung Mycobacterium, einschließlich M. tuberculosis, wirksam ist. Die Strukturformel lautet:
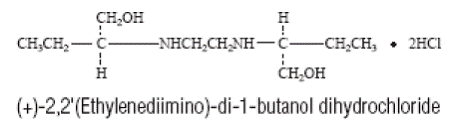
MYAMBUTOL (Ethambutolhydrochlorid) 100 und 400 mg Tabletten enthalten die folgenden Hilfsstoffe: Gelatine, Hydroxypropylmethylcellulose, Magnesiumstearat, Natriumlaurylsulfat, Sorbitol, Stearinsäure, Saccharose, Titandioxid und andere Inhaltsstoffe.
INDIKATIONEN
MYAMBUTOL ist angezeigt zur Behandlung von Lungentuberkulose. Es sollte nicht als einziges Antituberkulose-Medikament verwendet werden, sondern sollte in Verbindung mit mindestens einem anderen Antituberkulose-Medikament verwendet werden. Die Auswahl des Begleitmedikaments sollte auf klinischer Erfahrung, Überlegungen zur vergleichenden Sicherheit und geeigneten In-vitro-Empfindlichkeitsstudien basieren. Bei Patienten, die keine vorangegangene antituberkulöse Therapie, d. h. Erstbehandlung, erhalten haben, waren die am häufigsten angewendeten Regime die folgenden:
MYAMBUTOL plus Isoniazid
MYAMBUTOL 800 mg plus Isoniazid plus Streptomycin.
Bei Patienten, die zuvor eine antituberkulöse Therapie erhalten haben, ist eine mykobakterielle Resistenz gegenüber anderen Arzneimitteln, die in der Anfangstherapie verwendet wurden, häufig. Folglich sollte MYAMBUTOL bei solchen Nachbehandlungspatienten mit mindestens einem der Zweitlinienmedikamente kombiniert werden, die dem Patienten zuvor noch nicht verabreicht wurden und für die eine bakterielle Empfindlichkeit durch geeignete In-vitro-Studien nachgewiesen wurde. Antituberkulose-Medikamente, die mit MYAMBUTOL verwendet werden, umfassen Cycloserin, Ethionamid, Pyrazinamid, Viomycin und andere Medikamente. Isoniazid, Aminosalicylsäure und Streptomycin wurden ebenfalls in mehreren Arzneimittelschemata verwendet. Es wurden auch alternierende Arzneimittelregime verwendet.
DOSIERUNG UND ANWENDUNG
MYAMBUTOL 200 mg sollte nicht allein, in der Erstbehandlung oder in der Folgebehandlung angewendet werden. MYAMBUTOL 400 mg sollte nur einmal alle 24 Stunden verabreicht werden. Die Resorption wird durch die Einnahme zusammen mit Nahrung nicht wesentlich verändert. Die Therapie sollte im Allgemeinen fortgesetzt werden, bis die bakteriologische Konversion dauerhaft geworden ist und eine maximale klinische Besserung eingetreten ist.
MYAMBUTOL wird nicht für die Anwendung bei pädiatrischen Patienten unter 13 Jahren empfohlen, da keine sicheren Anwendungsbedingungen ermittelt wurden.
Erstbehandlung: Verabreichen Sie Patienten, die zuvor keine antituberkulöse Therapie erhalten haben, MYAMBUTOL 15 mg/kg (7 mg/lb) Körpergewicht als orale Einzeldosis einmal alle 24 Stunden. In den neueren Studien wurde Isoniazid gleichzeitig in einer einzigen, täglichen, oralen Dosis verabreicht.
Nachbehandlung: Bei Patienten, die zuvor eine antituberkulöse Therapie erhalten haben, MYAMBUTOL 25 mg/kg (11 mg/lb) Körpergewicht als orale Einzeldosis einmal alle 24 Stunden verabreichen. Verabreichen Sie gleichzeitig mindestens ein anderes Antituberkulose-Medikament, für das die Organismen durch geeignete In-vitro-Tests nachweislich empfindlich sind. Geeignete Arzneimittel bestehen üblicherweise aus solchen, die zuvor nicht bei der Behandlung des Patienten verwendet wurden. Verringern Sie die Dosis nach 60 Tagen der Verabreichung von MYAMBUTOL 600 mg auf 15 mg/kg (7 mg/lb) Körpergewicht und verabreichen Sie es einmal alle 24 Stunden als orale Einzeldosis.
Während der Zeit, in der ein Patient eine Tagesdosis von 25 mg/kg erhält, werden monatliche Augenuntersuchungen empfohlen.
Siehe Tabelle für eine einfache Auswahl der Tablette(n) mit der richtigen Gewichtsdosis.
Gewicht-Dosis-Tabelle
WIE GELIEFERT
Ethambutolhydrochlorid Tabletten USP
100mg – runde, konvexe, weiße Filmtabletten mit der Prägung „E6“ auf einer Seite werden wie folgt geliefert:
NDC 54879-001-01 - 100er Flasche NDC 54879-001-00 – 10 Blisterpackungen x 10 Tabletten
400mg – runde, konvexe, weiße Filmtabletten mit Bruchkerbe, in die auf einer Seite links von der Bruchkerbe „E“ und rechts von der Bruchkerbe „7“ eingeprägt sind, werden wie folgt geliefert:
NDC 54879-002-01 - 100er Flasche NDC 54879-002-00 - 10 Blisterpackungen x 10 Tabletten
Bei kontrollierter Raumtemperatur von 20° bis 25°C (68° bis 77°F) lagern.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden
Hergestellt für und vertrieben von: STI Pharma, LLC Langhorne, PA 19047. Überarbeitet im März 2013
NEBENWIRKUNGEN
MYAMBUTOL kann eine Abnahme der Sehschärfe hervorrufen, einschließlich irreversibler Erblindung, die auf eine Optikusneuritis zurückzuführen zu sein scheint. Eine Optikusneuropathie, einschließlich Optikusneuritis oder retrobulbärer Neuritis, die im Zusammenhang mit einer Behandlung mit Ethambutol auftritt, kann durch eines oder mehrere der folgenden Ereignisse gekennzeichnet sein: verminderte Sehschärfe, Skotom, Farbenblindheit und/oder Sehstörung. Diese Ereignisse wurden auch ohne Diagnose einer Optikus- oder Retrobulbärneuritis berichtet.
Die Patienten sollten darauf hingewiesen werden, dass sie unverzüglich ihrem Arzt jede Änderung der Sehschärfe mitteilen.
Die Veränderung der Sehschärfe kann einseitig oder beidseitig sein und daher muss jedes Auge separat und beide Augen zusammen getestet werden. Die Sehschärfe sollte vor Beginn der MYAMBUTOL-Therapie und in regelmäßigen Abständen während der Arzneimittelverabreichung getestet werden, außer dass sie monatlich durchgeführt werden sollte, wenn ein Patient eine Dosis von mehr als 15 mg pro Kilogramm pro Tag erhält. Snellen-Sehtafeln werden zum Testen der Sehschärfe empfohlen. Studien haben gezeigt, dass es bei vielen Tuberkulosepatienten, die MYAMBUTOL nicht erhalten, deutliche Schwankungen von ein oder zwei Linien des Snellen-Diagramms in der Sehschärfe gibt.

Die folgende Tabelle kann bei der Interpretation möglicher Veränderungen der Sehschärfe, die auf MYAMBUTOL zurückzuführen sind, hilfreich sein.
Im Allgemeinen können Änderungen der Sehschärfe, die geringer sind als die unter „Erhebliche Anzahl von Linien“ und „Verringerte Anzahl von Punkten“ angegebenen, auf zufällige Schwankungen, Einschränkungen des Testverfahrens oder physiologische Schwankungen zurückzuführen sein. Umgekehrt weisen Veränderungen der Sehschärfe, die denen unter „Signifikante Anzahl von Linien“ und „Verringerte Anzahl von Punkten“ entsprechen oder diese übersteigen, darauf hin, dass ein erneuter Test und eine sorgfältige Bewertung des Sehstatus des Patienten erforderlich sind. Wenn eine sorgfältige Untersuchung das Ausmaß der visuellen Veränderung bestätigt und keine andere Ursache aufzeigt, sollte MYAMBUTOL 400 mg abgesetzt und der Patient in regelmäßigen Abständen erneut untersucht werden. Eine fortschreitende Abnahme der Sehschärfe während der Therapie muss auf MYAMBUTOL zurückgeführt werden.
Wenn vor der Behandlung eine Korrekturbrille verwendet wird, muss diese während der Sehschärfenprüfung getragen werden. Während 1 bis 2 Jahren Therapie kann sich eine Fehlsichtigkeit entwickeln, die korrigiert werden muss, um genaue Testergebnisse zu erhalten. Die Prüfung der Sehschärfe durch eine Lochblende eliminiert Fehlsichtigkeiten. Patienten, die während der Behandlung mit MYAMBUTOL 800 mg Sehstörungen entwickeln, können vor oder gleichzeitig mit der Abnahme der Sehschärfe subjektive visuelle Symptome zeigen, und alle Patienten, die MYAMBUTOL erhalten, sollten regelmäßig zu verschwommenem Sehen und anderen subjektiven Augensymptomen befragt werden.
Die Wiederherstellung der Sehschärfe erfolgt im Allgemeinen über einen Zeitraum von Wochen bis Monaten nach Absetzen des Arzneimittels. Einige Patienten haben nach einer solchen Genesung erneut MYAMBUTOL (Ethambutolhydrochlorid) erhalten, ohne dass der Verlust der Sehschärfe erneut auftrat.
Andere berichtete Nebenwirkungen umfassen: Überempfindlichkeit, anaphylaktische/anaphylaktoide Reaktion, Dermatitis, Erythema multiforme, Juckreiz und Gelenkschmerzen; Anorexie, Übelkeit, Erbrechen, Magen-Darm-Störungen und Bauchschmerzen; Fieber, Unwohlsein, Kopfschmerzen und Schwindel; geistige Verwirrung, Orientierungslosigkeit und mögliche Halluzinationen; Thrombozytopenie, Leukopenie und Neutropenie. Taubheit und Kribbeln der Extremitäten aufgrund peripherer Neuritis wurden berichtet.
Es treten erhöhte Harnsäurespiegel im Serum auf und es wurde über Fälle von akuter Gicht berichtet. Lungeninfiltrate mit oder ohne Eosinophilie wurden auch während der MYAMBUTOL-Therapie berichtet. Lebertoxizitäten, einschließlich Todesfällen, wurden berichtet (siehe WARNUNGEN .) Da MYAMBUTOL 400 mg zur Therapie in Verbindung mit einem oder mehreren anderen Antituberkulose-Medikamenten empfohlen wird, können diese Veränderungen mit der gleichzeitigen Therapie zusammenhängen. Überempfindlichkeitssyndrom bestehend aus Hautreaktionen (wie Ausschlag oder exfoliative Dermatitis), Eosinophilie und einer oder mehreren der folgenden Erkrankungen: Hepatitis, Pneumonitis, Nephritis, Myokarditis, Perikarditis. Fieber und Lymphadenopathie können vorhanden sein.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Die Ergebnisse einer Studie zur gleichzeitigen Verabreichung von MYAMBUTOL (50 mg/kg) mit einem aluminiumhydroxidhaltigen Antazidum bei 13 Patienten mit Tuberkulose zeigten eine Verringerung der mittleren Serumkonzentrationen und der Urinausscheidung von Ethambutol um etwa 20 % bzw. 13 %, was darauf hindeutet, dass die Die orale Resorption von Ethambutol kann durch diese Antazida reduziert werden. Es wird empfohlen, die gleichzeitige Verabreichung von Ethambutol mit aluminiumhydroxidhaltigen Antazida für mindestens 4 Stunden nach der Verabreichung von Ethambutol zu vermeiden.
WARNUNGEN
MYAMBUTOL 600 mg kann zu einer Abnahme der Sehschärfe führen, die auf eine Optikusneuritis zurückzuführen zu sein scheint. Dieser Effekt kann mit der Dosis und Dauer der Behandlung zusammenhängen. Dieser Effekt ist im Allgemeinen reversibel, wenn die Verabreichung des Arzneimittels sofort beendet wird. Es wurde jedoch über irreversible Erblindung berichtet. (Sehen VORSICHTSMASSNAHMEN und NEBENWIRKUNGEN ).
Lebertoxizitäten, einschließlich Todesfälle, wurden berichtet (siehe NEBENWIRKUNGEN ). Es sollten eine Grundlinien- und eine regelmäßige Beurteilung der Leberfunktion durchgeführt werden.
VORSICHTSMASSNAHMEN
MYAMBUTOL 800 mg Ethambutolhydrochlorid wird nicht für die Anwendung bei pädiatrischen Patienten unter 13 Jahren empfohlen, da keine sicheren Bedingungen für die Anwendung ermittelt wurden.
Bei Patienten mit eingeschränkter Nierenfunktion muss die Dosis gemäß den Serumspiegeln von MYAMBUTOL reduziert werden, da der Hauptausscheidungsweg dieses Arzneimittels über die Nieren verläuft.
Da dieses Medikament negative Auswirkungen auf das Sehvermögen haben kann, sollte die körperliche Untersuchung Ophthalmoskopie, Fingerperimetrie und Tests zur Farbunterscheidung umfassen. Bei Patienten mit Sehstörungen wie Katarakt, wiederkehrenden entzündlichen Erkrankungen des Auges, Optikusneuritis und diabetischer Retinopathie ist die Beurteilung von Veränderungen der Sehschärfe schwieriger, und es sollte darauf geachtet werden, dass die Sehstörungen nicht darauf zurückzuführen sind die zugrunde liegenden Krankheitszustände. Bei solchen Patienten sollte das Verhältnis zwischen dem erwarteten Nutzen und einer möglichen Verschlechterung des Sehvermögens berücksichtigt werden, da die Beurteilung von Sehveränderungen schwierig ist. (Empfohlene Verfahren finden Sie in den nächsten Abschnitten unter NEBENWIRKUNGEN ).
Wie bei jedem potenten Medikament sollte eine Grundlinien- und regelmäßige Beurteilung der Organsystemfunktionen, einschließlich Nieren-, Leber- und hämatopoetischer Funktionen, durchgeführt werden.
Schwangerschaft
Teratogene Wirkungen
Schwangerschaftskategorie C.
Es liegen keine adäquaten und gut kontrollierten Studien bei Schwangeren vor. Es gibt Berichte über ophthalmologische Anomalien bei Säuglingen, die von Frauen geboren wurden, die eine antituberkulöse Therapie erhielten, zu der auch MYAMBUTOL gehörte. MYAMBUTOL sollte während der Schwangerschaft nur angewendet werden, wenn der Nutzen das potenzielle Risiko für den Fötus rechtfertigt.
MYAMBUTOL 200 mg hat sich bei trächtigen Mäusen und Kaninchen als teratogen erwiesen, wenn es in hohen Dosen verabreicht wurde. Wenn trächtige Mäuse oder Kaninchen mit hohen Dosen Ethambutolhydrochlorid behandelt wurden, war die fötale Sterblichkeit leicht, aber nicht signifikant (P > 0,05) erhöht. Weibliche Ratten, die mit Ethambutolhydrochlorid behandelt wurden, zeigten leichte, aber unbedeutende (P > 0,05) Abnahmen der Fruchtbarkeit und Wurfgröße.
Bei Föten, die von Mäusen geboren wurden, die während der Schwangerschaft mit hohen Dosen von MYAMBUTOL 400 mg behandelt wurden, wurde eine geringe Inzidenz von Gaumenspalten, Exenzephalie und Anomalien der Wirbelsäule beobachtet. Bei neugeborenen Ratten, die während der Trächtigkeit mit hohen Dosen Ethambutolhydrochlorid behandelt wurden, wurden geringfügige Anomalien der Halswirbel beobachtet. Kaninchen, die während der Trächtigkeit hohe Dosen MYAMBUTOL erhielten, brachten zwei Föten mit Monophthalmie zur Welt, einen mit einem verkürzten rechten Unterarm, begleitet von einer bilateralen Handgelenkskontraktur, und einen mit Hasenscharte und Gaumenspalte.
Stillende Mutter
MYAMBUTOL wird in die Muttermilch ausgeschieden. Die Anwendung von MYAMBUTOL sollte nur in Betracht gezogen werden, wenn der erwartete Nutzen für die Mutter das potenzielle Risiko für den Säugling überwiegt.
Pädiatrische Verwendung
MYAMBUTOL (Ethambutolhydrochlorid) wird nicht für die Anwendung bei pädiatrischen Patienten unter 13 Jahren empfohlen, da keine sicheren Anwendungsbedingungen ermittelt wurden.
Geriatrische Verwendung
Es liegen begrenzte Daten zur Anwendung von Ethambutol bei älteren Menschen vor. Eine Studie mit 101 Patienten im Alter von 65 Jahren und älter, die mehrere Arzneimittel gegen Tuberkulose erhielten, umfasste 94 Patienten, die Ethambutol erhielten. Bei diesen Patienten wurden keine Unterschiede in der Sicherheit oder Verträglichkeit im Vergleich zu den Ergebnissen bei Erwachsenen im Allgemeinen beobachtet. Andere berichtete klinische Erfahrungen haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt, aber eine größere Empfindlichkeit einiger älterer Personen kann nicht ausgeschlossen werden.
ÜBERDOSIS
Keine Informationen bereitgestellt
KONTRAINDIKATIONEN
MYAMBUTOL ist kontraindiziert bei Patienten mit bekannter Überempfindlichkeit gegenüber diesem Arzneimittel. Es ist auch bei Patienten mit bekannter Optikusneuritis kontraindiziert, es sei denn, die klinische Beurteilung ergibt, dass es verwendet werden kann. MYAMBUTOL ist kontraindiziert bei Patienten, die visuelle Nebenwirkungen oder Veränderungen des Sehvermögens nicht einschätzen und melden können (z. B. kleine Kinder, bewusstlose Patienten).
KLINISCHE PHARMAKOLOGIE
MYAMBUTOL 600 mg erreicht nach einer oralen Einzeldosis von 25 mg/kg Körpergewicht 2 bis 4 Stunden nach der Verabreichung einen Spitzenwert von 2 bis 5 mg/ml im Serum. Wenn das Medikament in dieser Dosis über einen längeren Zeitraum täglich verabreicht wird, sind die Serumspiegel ähnlich. Der Serumspiegel von MYAMBUTOL fällt 24 Stunden nach der letzten Dosis auf ein nicht mehr nachweisbares Niveau, außer bei einigen Patienten mit anomaler Nierenfunktion. Die intrazellulären Erythrozytenkonzentrationen erreichen Spitzenwerte, die etwa doppelt so hoch sind wie die des Plasmas, und halten dieses Verhältnis über 24 Stunden aufrecht.
Während der 24 Stunden nach oraler Gabe von MYAMBUTOL werden etwa 50 Prozent der Anfangsdosis unverändert im Urin ausgeschieden, während weitere 8 bis 15 Prozent in Form von Metaboliten auftreten. Der Hauptstoffwechselweg scheint eine anfängliche Oxidation des Alkohols zu einem aldehydischen Zwischenprodukt zu sein, gefolgt von einer Umwandlung in eine Dicarbonsäure. 20 bis 22 Prozent der Anfangsdosis werden als unveränderter Wirkstoff mit den Fäzes ausgeschieden. Bei aufeinanderfolgenden täglichen Einzeldosen von 25 mg/kg wurde bei Patienten mit normaler Nierenfunktion keine Arzneimittelakkumulation beobachtet, obwohl eine deutliche Akkumulation bei Patienten mit Niereninsuffizienz nachgewiesen wurde.
MYAMBUTOL diffundiert in aktiv wachsende Mykobakterienzellen wie Tuberkelbazillen. MYAMBUTOL 800 mg scheint die Synthese eines oder mehrerer Metaboliten zu hemmen, was zu einer Beeinträchtigung des Zellstoffwechsels, einem Stillstand der Vermehrung und zum Zelltod führt. Es wurde keine Kreuzresistenz mit anderen verfügbaren antimykobakteriellen Wirkstoffen nachgewiesen.
MYAMBUTOL 200 mg hat sich als wirksam gegen Stämme von Mycobacterium tuberculosis erwiesen, scheint aber nicht gegen Pilze, Viren oder andere Bakterien wirksam zu sein. Mycobacterium tuberculosis-Stämme, die MYAMBUTOL zuvor nicht ausgesetzt waren, waren einheitlich empfindlich gegenüber Konzentrationen von 8 oder weniger µg/ml, abhängig von der Beschaffenheit des Kulturmediums. Wenn MYAMBUTOL allein zur Behandlung von Tuberkulose angewendet wurde, haben Tuberkelbazillen dieser Patienten in In-vitro-Empfindlichkeitstests eine Resistenz gegen MYAMBUTOL (Ethambutolhydrochlorid) entwickelt; Die Entwicklung von Resistenzen war unvorhersehbar und scheint schrittweise zu erfolgen. Es wurden keine Kreuzresistenzen zwischen MYAMBUTOL und anderen Antituberkulose-Medikamenten berichtet. MYAMBUTOL hat die Häufigkeit des Auftretens einer mykobakteriellen Resistenz gegen Isoniazid verringert, wenn beide Arzneimittel gleichzeitig angewendet wurden.
Zur Bestimmung der MYAMBUTOL-Konzentrationen in Serum und Urin kann ein mikrobiologischer Agar-Diffusionstest auf der Grundlage der Hemmung von Mycobacterium smegmatis (ATCC 607) verwendet werden.
Tierpharmakologie
Toxikologische Studien an Hunden mit hohen Langzeitdosen ergaben Hinweise auf Myokardschädigung und -versagen sowie Depigmentierung des Tapetum lucidum der Augen, deren Bedeutung nicht bekannt ist. Bei Hunden, die Ethambutolhydrochlorid über einen längeren Zeitraum erhielten, wurden auch degenerative Veränderungen des Zentralnervensystems beobachtet, die offensichtlich nicht dosisabhängig waren.
Bei Rhesusaffen traten nach Behandlung mit täglich hohen Dosen über mehrere Monate neurologische Symptome auf. Diese wurden mit spezifischen Serumspiegeln von Ethambutol und mit eindeutigen neuroanatomischen Veränderungen im Zentralnervensystem korreliert. Eine fokale interstitielle Karditis wurde auch bei Affen beobachtet, die Ethambutolhydrochlorid in hohen Dosen über einen längeren Zeitraum erhielten.
INFORMATIONEN ZUM PATIENTEN
Keine Informationen bereitgestellt. Bitte wende dich an die WARNUNGEN und VORSICHTSMASSNAHMEN Abschnitte.