Augmentin 250/125mg, 500/125mg, 750/250mg, 875/125mg Clavulanate Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Augmentin 875 mg und wie wird es angewendet?
Augmentin 250 mg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome vieler verschiedener bakterieller Infektionen wie Infektionen der unteren Atemwege, chronisch obstruktive Lungenerkrankung, bakterielle Sinusitis, Tier-/Mensch-Bisswunden und Hautinfektionen. Augmentin 125 mg kann allein oder zusammen mit anderen Medikamenten verwendet werden.
Welche Nebenwirkungen kann Augmentin haben?
Augmentin 750 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Augmentin gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Augmentin. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
AUGMENTIN 500 mg ist eine orale antibakterielle Kombination, die aus Amoxicillin und dem Beta-Lactamase-Hemmer Clavulanat-Kalium (dem Kaliumsalz der Clavulansäure) besteht.
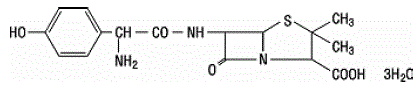
Amoxicillin ist ein Analogon von Ampicillin, abgeleitet vom grundlegenden Penicillinkern, 6-Aminopenicillansäure. Die Molekularformel von Amoxicillin ist C16H19N3O5S·3H2O und das Molekulargewicht beträgt 419,46. Chemisch gesehen ist Amoxicillin (2S,5R,6R)-6-[(R)-(-)-2-Amino-2-(p-hydroxyphenyl)acetamido]-3,3-dimethyl-7-oxo-4-thia -1-Azabicyclo[3.2.0]heptan-2-carbonsäuretrihydrat und kann strukturell dargestellt werden als:
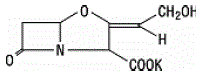
Clavulansäure wird durch Fermentation von Streptomyces clavuligerus hergestellt. Es ist ein Beta-Lactam, das strukturell mit den Penicillinen verwandt ist und die Fähigkeit besitzt, einige Beta-Lactamasen zu inaktivieren, indem es die aktiven Zentren dieser Enzyme blockiert. Die Molekularformel von Clavulanat-Kalium ist C8H8KNO5 und das Molekulargewicht beträgt 237,25. Chemisch gesehen ist Clavulanat-Kalium Kalium (Z)(2R,5R)-3-(2-hydroxyethyliden)-7-oxo-4-oxa-1-azabicyclo[3.2.0]-heptan-2-carboxylat und kann strukturell dargestellt werden wie:
Inaktive Zutaten
INDIKATIONEN
Um die Entwicklung arzneimittelresistenter Bakterien zu verringern und die Wirksamkeit von AUGMENTIN (Amoxicillin/Clavulanat-Kalium) und anderen antibakteriellen Arzneimitteln aufrechtzuerhalten, sollte AUGMENTIN 500 mg nur zur Behandlung von Infektionen angewendet werden, die nachweislich oder mit starkem Verdacht auf empfindliche Bakterien zurückzuführen sind. Wenn Kultur- und Empfindlichkeitsinformationen verfügbar sind, sollten diese bei der Auswahl oder Änderung der antibakteriellen Therapie berücksichtigt werden. In Ermangelung solcher Daten können lokale Epidemiologie und Anfälligkeitsmuster zur empirischen Auswahl der Therapie beitragen.
AUGMENTIN® ist ein kombiniertes Antibiotikum der Penicillin-Klasse und Beta-Lactamase-Hemmer, das zur Behandlung von Infektionen angezeigt ist, die durch empfindliche Isolate der bezeichneten Bakterien bei den unten aufgeführten Erkrankungen verursacht werden*:
Infektionen der unteren Atemwege
Verursacht durch beta-Lactamase-produzierende Isolate von Haemophilus influenzae und Moraxella catarrhalis.
Akute bakterielle Mittelohrentzündung
Verursacht durch beta-Lactamase-produzierende Isolate von H. influenzae und M. catarrhalis.
Sinusitis
Verursacht durch beta-Lactamase-produzierende Isolate von H. influenzae und M. catarrhalis.
Haut- und Hautstrukturinfektionen
Verursacht durch Beta-Lactamase-produzierende Isolate von Staphylococcus aureus-, Escherichia coli- und Klebsiella-Spezies.
Harnwegsinfektion
Verursacht durch beta-Lactamase-produzierende Isolate von E. coli, Klebsiella-Spezies und Enterobacter-Spezies.
Nutzungsbeschränkungen
Wenn die Ergebnisse von Empfindlichkeitstests eine Empfindlichkeit gegenüber Amoxicillin zeigen, was darauf hindeutet, dass keine Beta-Lactamase-Produktion erfolgt, sollte AUGMENTIN nicht verwendet werden.
DOSIERUNG UND ANWENDUNG
AUGMENTIN 875 mg kann unabhängig von den Mahlzeiten eingenommen werden; Die Resorption von Clavulanat-Kalium wird jedoch verstärkt, wenn AUGMENTIN 250 mg zu Beginn einer Mahlzeit verabreicht wird. Um das Risiko einer gastrointestinalen Unverträglichkeit zu minimieren, sollte AUGMENTIN 125 mg zu Beginn einer Mahlzeit eingenommen werden.
Erwachsene
Die übliche Dosis für Erwachsene ist eine 500-mg-Tablette AUGMENTIN alle 12 Stunden oder eine 250-mg-Tablette AUGMENTIN 125 mg alle 8 Stunden. Bei schwereren Infektionen und Infektionen der Atemwege sollte die Dosis eine 875-mg-Tablette AUGMENTIN 875 mg alle 12 Stunden oder eine 500-mg-Tablette AUGMENTIN alle 8 Stunden betragen. Erwachsene mit Schluckbeschwerden können die 125-mg/5-ml- oder 250-mg/5-ml-Suspension anstelle der 500-mg-Tablette erhalten. Die 200-mg/5-ml-Suspension oder die 400-mg/5-ml-Suspension kann anstelle der 875-mg-Tablette verwendet werden.
Eine 500-mg-Tablette AUGMENTIN darf nicht durch zwei 250-mg-Tabletten AUGMENTIN ersetzt werden. Da sowohl die 250-mg- als auch die 500-mg-Tablette AUGMENTIN dieselbe Menge Clavulansäure (125 mg als Kaliumsalz) enthalten, entsprechen zwei 250-mg-Tabletten nicht einer 500-mg-Tablette AUGMENTIN.
Die 250-mg-Tablette AUGMENTIN und die 250-mg-Kautablette sollten nicht gegeneinander ausgetauscht werden, da sie nicht austauschbar sind. Die 250-mg-Tablette AUGMENTIN 250 mg und die 250-mg-Kautablette enthalten nicht die gleiche Menge an Clavulansäure (wie das Kaliumsalz). Die 250-mg-Tablette AUGMENTIN enthält 125 mg Clavulansäure, während die 250-mg-Kautablette 62,5 mg Clavulansäure enthält.
Pädiatrische Patienten
Basierend auf der Amoxicillin-Komponente sollte AUGMENTIN wie folgt dosiert werden:
Neugeborene und Kleinkinder
Die empfohlene Dosis von AUGMENTIN beträgt 30 mg/kg/Tag, aufgeteilt alle 12 Stunden, basierend auf der Amoxicillin-Komponente. Die Erfahrungen mit der 200-mg/5-ml-Formulierung in dieser Altersgruppe sind begrenzt, und daher wird die Anwendung der 125-mg/5-ml-Suspension zum Einnehmen empfohlen.
Patienten im Alter von 12 Wochen (3 Monaten) und älter
Siehe Dosierungsschemata in Tabelle 1. Das Schema alle 12 Stunden wird empfohlen, da es mit deutlich weniger Durchfall einhergeht [siehe Klinische Studien ]. Die Suspension zum Einnehmen alle 12 Stunden (200 mg/5 ml und 400 mg/5 ml) und die Kautabletten (200 mg und 400 mg) enthalten jedoch Aspartam und sollten von Phenylketonurikern nicht eingenommen werden. [sehen WARNUNGEN UND VORSICHTSMASSNAHMEN ]
Patienten mit einem Gewicht von 40 kg oder mehr
Kinder und Jugendliche mit einem Gewicht von 40 kg oder mehr sollten gemäß den Empfehlungen für Erwachsene dosiert werden.
Die 250-mg-Tablette AUGMENTIN sollte aufgrund des unterschiedlichen Verhältnisses von Amoxicillin zu Clavulansäure in der 250-mg-Tablette AUGMENTIN (250/125) im Vergleich zur 250-mg-Kautablette nicht angewendet werden, bis das Kind mindestens 40 kg wiegt AUGMENTIN (250/62,5).
Patienten mit eingeschränkter Nierenfunktion
Patienten mit eingeschränkter Nierenfunktion benötigen im Allgemeinen keine Dosisreduktion, es sei denn, die Beeinträchtigung ist schwerwiegend. Patienten mit eingeschränkter Nierenfunktion und einer glomerulären Filtrationsrate von
Hämodialysepatienten sollten je nach Schweregrad der Infektion alle 24 Stunden 500 mg oder 250 mg erhalten. Sie sollten sowohl während als auch am Ende der Dialyse eine zusätzliche Dosis erhalten.
Anleitung zum Mischen der Suspension zum Einnehmen
Bereiten Sie zum Zeitpunkt der Abgabe eine Suspension wie folgt vor: Klopfen Sie an die Flasche, bis das gesamte Pulver frei fließt. Etwa 2/3 der Gesamtmenge an Wasser zur Rekonstitution hinzufügen (siehe Tabelle 2 unten) und kräftig schütteln, um das Pulver zu suspendieren. Restliches Wasser zugeben und erneut kräftig schütteln.
Notiz: Suspension zum Einnehmen vor Gebrauch gut schütteln. Die rekonstituierte Suspension muss gekühlt gelagert und nach 10 Tagen entsorgt werden.
WIE GELIEFERT
Darreichungsformen und Stärken
Tablets
Pulver zur oralen Suspension
Kautabletten
Die 250-mg-Tablette von AUGMENTIN 750 mg und die 250-mg-Kautablette sollten NICHT gegeneinander ausgetauscht werden, da sie nicht austauschbar sind, und die 250-mg-Tablette sollte nicht bei Kindern mit einem Körpergewicht unter 40 kg angewendet werden. Die 250-mg-Tablette AUGMENTIN und die 250-mg-Kautablette enthalten nicht die gleiche Menge an Clavulansäure. Die 250-mg-Tablette AUGMENTIN enthält 125 mg Clavulansäure, während die 250-mg-Kautablette 62,5 mg Clavulansäure enthält.
Zwei 250-mg-Tabletten AUGMENTIN 750 mg sollten NICHT durch eine 500-mg-Tablette AUGMENTIN ersetzt werden. Da sowohl die 250-mg- als auch die 500-mg-Tablette AUGMENTIN dieselbe Menge Clavulansäure (125 mg als Kaliumsalz) enthalten, entsprechen zwei 250-mg-Tabletten AUGMENTIN 750 mg nicht einer 500-mg-Tablette AUGMENTIN.
Lagerung und Handhabung
Tablets
250 mg/125 mg Tabletten: Jede weiße ovale Filmtablette mit der Prägung AUGMENTIN 750 mg auf der einen Seite und 250/125 auf der anderen Seite enthält 250 mg Amoxicillin als Trihydrat und 125 mg Clavulansäure als Kaliumsalz.
NDC 43598-018-30 Flaschen zu 30 Stück NDC 43598-018-78 Einzeldosis (10 x 10) 100 Tabletten
500 mg/125 mg Tabletten: Jede weiße ovale Filmtablette mit der Prägung AUGMENTIN auf der einen Seite und 500/125 auf der anderen Seite enthält 500 mg Amoxicillin als Trihydrat und 125 mg Clavulansäure als Kaliumsalz.
NDC 43598-006-14 Flaschen à 20 Stück NDC 43598-006-78 Einzeldosis (10 x 10) 100 Tabletten
875 mg/125 mg Tabletten: Jede weiße kapselförmige Tablette mit Bruchkerbe, auf der einen Seite mit AUGMENTIN 875 geprägt und auf der anderen Seite mit Bruchrille, enthält 875 mg Amoxicillin als Trihydrat und 125 mg Clavulansäure als Kaliumsalz.
NDC 43598-021-14 Flaschen zu 20 Stück NDC 43598-021-78 Einzeldosis (10 x 10) 100 Tabletten
Pulver zur Herstellung einer Suspension zum Einnehmen: 125 mg/31,25 mg pro 5 ml: Pulver mit Bananengeschmack zur Herstellung einer Suspension zum Einnehmen (je 5 ml der rekonstituierten Suspension enthalten 125 mg Amoxicillin und 31,25 mg Clavulansäure als Kaliumsalz).
NDC 43598-012-51 75-ml-Flasche NDC 43598-012-52 100-ml-Flasche NDC 43598-012-53 150-ml-Flasche
200 mg/28,5 mg pro 5 ml: Orangenpulver zur Herstellung einer Suspension zum Einnehmen (je 5 ml der rekonstituierten Suspension enthalten 200 mg Amoxicillin und 28,5 mg Clavulansäure als Kaliumsalz).
NDC 43598-013-50 50-ml-Flasche NDC 43598-013-51 75-ml-Flasche NDC 43598-013-52 100-ml-Flasche
250 mg/62,5 mg pro 5 ml: Pulver mit Orangengeschmack zur Herstellung einer Suspension zum Einnehmen (je 5 ml der rekonstituierten Suspension enthalten 250 mg Amoxicillin und 62,5 mg Clavulansäure als Kaliumsalz).
NDC 43598-004-51 75-ml-Flasche NDC 43598-004-52 100-ml-Flasche NDC 43598-004-53 150-ml-Flasche
400 mg/57 mg pro 5 ml Pulver mit Orangengeschmack zur Herstellung einer Suspension zum Einnehmen (je 5 ml der rekonstituierten Suspension enthalten 400 mg Amoxicillin und 57,0 mg Clavulansäure als Kaliumsalz).
NDC 43598-008-50 50-ml-Flasche NDC 43598-008-51 75-ml-Flasche NDC 43598-008-52 100-ml-Flasche
Kautabletten:125 mg/31,25 mg Kautabletten: Jede gelb gesprenkelte, runde Tablette mit Zitronen-Limetten-Geschmack, mit der Prägung BMP 189, enthält 125 mg Amoxicillin und 31,25 mg Clavulansäure als Kaliumsalz.
NDC 43598-014-31 Karton mit 30 (5x6) Tabletten
200 mg/28,5 mg Kautabletten: Jede rosa gesprenkelte, runde, bikonvexe Tablette mit Kirsch-Bananen-Geschmack und der Prägung AUGMENTIN 200 enthält 200 mg Amoxicillin und 28,5 mg Clavulansäure als Kaliumsalz.
NDC 43598-015-14 Karton mit 20 Tabletten
250 mg/62,5 mg Kautabletten: Jede gesprenkelte, gelbe, runde Tablette mit Zitronen-Limetten-Geschmack, mit der Prägung BMP 190, enthält 250 mg Amoxicillin und 62,5 mg Clavulansäure als Kaliumsalz.
NDC 43598-016-31 Karton mit 30 (5x6) Tabletten
400 mg/57 mg Kautabletten: Jede rosa gesprenkelte, runde, bikonvexe Tablette mit Kirsch-Bananen-Geschmack und der Prägung AUGMENTIN 400 enthält 400 mg Amoxicillin und 57,0 mg Clavulansäure als Kaliumsalz.
NDC 43598-017-14 Karton mit 20 Tabletten
Im Originalgebinde abgeben.
Tabletten und Trockenpulver bei oder unter 25 °C (77 °F) lagern.
Rekonstituierte Suspension gekühlt lagern. Nicht verwendete Suspension nach 10 Tagen verwerfen. Von Kindern fern halten.
VERWEISE
1. Swanson-Biearman B, Dean BS, Lopez G, Krenzelok EP. Die Auswirkungen der Einnahme von Penicillin und Cephalosporin bei Kindern unter sechs Jahren.Vet Hum Toxicol. 1988; 30: 66 67.
2. Institut für klinische und Laborstandards (CLSI). Methoden zur Verdünnung Antimikrobielle Empfindlichkeitstests für Bakterien, die aerob wachsen; Anerkannter Standard – 8thed. CLSI-Dokument M7-A9. CLSI, 940 West Valley Road, Suite 1400, Wayne, PA, 19087, 2012.
3. Clinical and Laboratory Standards Institute (CLSI). Leistungsstandard für antimikrobielle Disk-Empfindlichkeitstests; Genehmigter Standard – 11. Platz. CLSI-Dokument M2-A11. CLSI, 940 West Valley Road, Suite 1400, Wayne, PA, 19087, 2012.
4. CLSI. Leistungsstandards für antimikrobielle Empfindlichkeitstests: 22. Informationsergänzung. CLSI-Dokument M100-S22. CLSI, Wayne, Pennsylvania, 2012.
Vertrieb durch: Dr. Reddy's Laboratories Inc. Bridgewater, NJ 08807. Überarbeitet: März 2013
NEBENWIRKUNGEN
Folgendes wird in anderen Abschnitten der Kennzeichnung ausführlicher behandelt:
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Die am häufigsten berichteten Nebenwirkungen waren Durchfall/weicher Stuhl (9 %), Übelkeit (3 %), Hautausschläge und Nesselsucht (3 %), Erbrechen (1 %) und Vaginitis (1 %). Weniger als 3 % der Patienten brachen die Therapie wegen arzneimittelbedingter Nebenwirkungen ab. Die Gesamthäufigkeit von Nebenwirkungen und insbesondere Durchfall nahm mit der höheren empfohlenen Dosis zu. Andere weniger häufig berichtete Nebenwirkungen (
Bei pädiatrischen Patienten (im Alter von 2 Monaten bis 12 Jahren) wurde eine klinische Studie in den USA/Kanada durchgeführt, in der 45/6,4 mg/kg/Tag (aufgeteilt alle 12 Stunden) von AUGMENTIN über 10 Tage mit 40/10 mg/kg/Tag verglichen wurden (aufgeteilt alle 8 Stunden) von AUGMENTIN 125 mg für 10 Tage zur Behandlung einer akuten Mittelohrentzündung. Insgesamt wurden 575 Patienten aufgenommen, und in dieser Studie wurden nur die Suspensionsformulierungen verwendet. Insgesamt waren die beobachteten Nebenwirkungen mit den oben genannten vergleichbar; es gab jedoch Unterschiede in den Raten von Durchfall, Hautausschlägen/Urtikaria und Ausschlägen im Windelbereich. [Sehen Klinische Studien ]
Postmarketing-Erfahrung
Zusätzlich zu den aus klinischen Studien berichteten Nebenwirkungen wurden die folgenden Nebenwirkungen während der Anwendung von AUGMENTIN nach der Markteinführung festgestellt. Da sie freiwillig aus einer Population unbekannter Größe gemeldet wurden, können keine Schätzungen zur Häufigkeit vorgenommen werden. Diese Ereignisse wurden aufgrund einer Kombination aus Schweregrad, Meldehäufigkeit oder potenziellem Kausalzusammenhang mit AUGMENTIN für die Aufnahme ausgewählt.
Magen-Darm
Verdauungsstörungen, Gastritis, Stomatitis, Glossitis, schwarze „haarige“ Zunge, mukokutane Candidiasis, Enterokolitis und hämorrhagische/pseudomembranöse Kolitis. Das Auftreten pseudomembranöser Colitis-Symptome kann während oder nach einer Antibiotikabehandlung auftreten. [sehen WARNUNGEN UND VORSICHTSMASSNAHMEN ]
Überempfindlichkeitsreaktionen
Juckreiz, Angioödem, serumkrankheitsähnliche Reaktionen (Urtikaria oder Hautausschlag begleitet von Arthritis, Arthralgie, Myalgie und häufig Fieber), Erythema multiforme, Stevens-Johnson-Syndrom, akute generalisierte exanthematische Pustulose, Überempfindlichkeitsvaskulitis und Fälle von exfoliativer Dermatitis (einschließlich toxischer epidermaler Nekrolyse) wurden berichtet. [sehen WARNUNGEN UND VORSICHTSMASSNAHMEN ]
Leber
Unter AUGMENTIN wurde über Leberfunktionsstörungen, einschließlich Hepatitis und cholestatischer Gelbsucht, Anstieg der Serumtransaminasen (AST und/oder ALT), des Serumbilirubins und/oder der alkalischen Phosphatase berichtet. Es wurde häufiger bei älteren Menschen, bei Männern oder bei Patienten mit längerer Behandlung berichtet. Die histologischen Befunde der Leberbiopsie bestanden überwiegend aus einer cholestatischen Behandlung. Die histologischen Befunde der Leberbiopsie bestanden aus überwiegend cholestatischen, hepatozellulären oder gemischt cholestatischen hepatozellulären Veränderungen. Das Auftreten von Anzeichen/Symptomen einer Leberfunktionsstörung kann während oder mehrere Wochen nach Absetzen der Therapie auftreten. Die Leberfunktionsstörung, die schwerwiegend sein kann, ist normalerweise reversibel. Es wurden Todesfälle gemeldet. [sehen KONTRAINDIKATIONEN , WARNUNGEN UND VORSICHTSMASSNAHMEN ]
Nieren
Über interstitielle Nephritis, Hämaturie und Kristallurie wurde berichtet. [sehen ÜBERDOSIS ]

Hemisches und lymphatisches System
Anämie einschließlich hämolytischer Anämie, Thrombozytopenie, thrombozytopenischer Purpura, Eosinophilie, Leukopenie und Agranulozytose wurde berichtet. Diese Reaktionen sind in der Regel nach Absetzen der Therapie reversibel und es wird angenommen, dass es sich um Überempfindlichkeitsphänomene handelt. Bei weniger als 1 % der mit AUGMENTIN behandelten Patienten wurde eine Thrombozytose festgestellt. Es liegen Berichte über eine verlängerte Prothrombinzeit bei Patienten vor, die AUGMENTIN 125 mg und gleichzeitig eine Therapie mit Antikoagulanzien erhielten. [sehen WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ]
Zentrales Nervensystem
Unruhe, Angst, Verhaltensänderungen, Verwirrtheit, Krämpfe, Schwindel, Schlaflosigkeit und reversible Hyperaktivität wurden berichtet.
Sonstig
Zahnverfärbung (braune, gelbe oder graue Verfärbung) wurde berichtet. Die meisten Berichte traten bei pädiatrischen Patienten auf. Verfärbungen wurden in den meisten Fällen durch Bürsten oder Zahnreinigung reduziert oder beseitigt.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Probenecid
Probenecid verringert die renale tubuläre Sekretion von Amoxicillin, verzögert jedoch nicht die renale Ausscheidung von Clavulansäure. Die gleichzeitige Anwendung mit AUGMENTIN 875 mg kann zu erhöhten und verlängerten Blutkonzentrationen von Amoxicillin führen. Die gleichzeitige Verabreichung von Probenecid wird nicht empfohlen.
Orale Antikoagulanzien
Bei Patienten, die Amoxicillin und orale Antikoagulanzien erhielten, wurde über eine abnormale Verlängerung der Prothrombinzeit (erhöhte international normalisierte Ratio [INR]) berichtet. Wenn Antikoagulanzien gleichzeitig mit AUGMENTIN verschrieben werden, sollte eine angemessene Überwachung erfolgen. Anpassungen der Dosis von oralen Antikoagulanzien können erforderlich sein, um das gewünschte Niveau der Antikoagulation aufrechtzuerhalten.
Allopurinol
Die gleichzeitige Verabreichung von Allopurinol und Amoxicillin erhöht die Häufigkeit von Hautausschlägen bei Patienten, die beide Arzneimittel erhalten, im Vergleich zu Patienten, die Amoxicillin allein erhalten. Es ist nicht bekannt, ob diese Potenzierung von Amoxicillin-Ausschlägen auf Allopurinol oder die bei diesen Patienten vorhandene Hyperurikämie zurückzuführen ist.
Orale Kontrazeptiva
AUGMENTIN 750 mg kann die Darmflora beeinträchtigen, was zu einer geringeren Östrogenreabsorption und einer verringerten Wirksamkeit von kombinierten oralen Östrogen/Progesteron-Kontrazeptiva führt.
Auswirkungen auf Labortests
Hohe Amoxicillin-Konzentrationen im Urin können zu falsch-positiven Reaktionen führen, wenn mit CLINITEST®, Benedict's Solution oder Fehling's Solution auf Glucose im Urin getestet wird. Da dieser Effekt auch bei AUGMENTIN auftreten kann, wird empfohlen, Glukosetests auf Basis enzymatischer Glukoseoxidasereaktionen durchzuführen.
Nach der Verabreichung von Amoxicillin an schwangere Frauen wurde eine vorübergehende Abnahme der Plasmakonzentration von Gesamt-konjugiertem Estriol, Estriol-Glucuronid, konjugiertem Estron und Estradiol festgestellt.
WARNUNGEN
Eingeschlossen als Teil der "VORSICHTSMASSNAHMEN" Abschnitt
VORSICHTSMASSNAHMEN
Überempfindlichkeitsreaktionen
Schwerwiegende und gelegentlich tödliche Überempfindlichkeitsreaktionen (anaphylaktische Reaktionen) wurden bei Patienten berichtet, die Beta-Lactam-Antibiotika, einschließlich AUGMENTIN, erhielten. Diese Reaktionen treten mit größerer Wahrscheinlichkeit bei Personen mit einer Vorgeschichte von Penicillin-Überempfindlichkeit und/oder einer Vorgeschichte von Empfindlichkeit gegenüber mehreren Allergenen auf. Vor Beginn der Therapie mit AUGMENTIN 250 mg sollte sorgfältig nach früheren Überempfindlichkeitsreaktionen auf Penicilline, Cephalosporine oder andere Allergene gefragt werden. Wenn eine allergische Reaktion auftritt, sollte AUGMENTIN abgesetzt und eine geeignete Therapie eingeleitet werden.
Leberfunktionsstörung
Leberfunktionsstörungen, einschließlich Hepatitis und cholestatischer Gelbsucht, wurden mit der Anwendung von AUGMENTIN in Verbindung gebracht. Die Lebertoxizität ist normalerweise reversibel; Es wurden jedoch Todesfälle gemeldet. Die Leberfunktion sollte bei Patienten mit eingeschränkter Leberfunktion in regelmäßigen Abständen überwacht werden.
Clostridium difficile assoziierter Durchfall (CDAD)
Clostridium difficile-assoziierte Diarrhoe (CDAD) wurde bei der Anwendung von fast allen antibakteriellen Mitteln, einschließlich AUGMENTIN 250 mg, berichtet und kann in ihrer Schwere von leichter Diarrhoe bis hin zu tödlicher Colitis reichen. Die Behandlung mit antibakteriellen Mitteln verändert die normale Flora des Dickdarms, was zu einem übermäßigen Wachstum von C. difficile führt.
C. difficile produziert die Toxine A und B, die zur Entstehung von CDAD beitragen. Hypertoxinproduzierende Stämme von C. difficile verursachen eine erhöhte Morbidität und Mortalität, da diese Infektionen gegenüber einer antimikrobiellen Therapie refraktär sein können und eine Kolektomie erfordern können. CDAD muss bei allen Patienten in Betracht gezogen werden, bei denen nach der Anwendung von Antibiotika Durchfall auftritt. Eine sorgfältige Anamnese ist erforderlich, da über das Auftreten von CDAD über 2 Monate nach der Verabreichung von Antibiotika berichtet wurde.
Wenn CDAD vermutet oder bestätigt wird, muss die laufende antibakterielle Anwendung, die nicht gegen C. difficile gerichtet ist, möglicherweise abgebrochen werden. Je nach klinischer Indikation sollte ein angemessenes Flüssigkeits- und Elektrolytmanagement, eine Proteinergänzung, eine antibakterielle Behandlung von C. difficile und eine chirurgische Untersuchung eingeleitet werden.
Hautausschlag bei Patienten mit Mononukleose
Ein hoher Prozentsatz der Patienten mit Mononukleose, die Amoxicillin erhalten, entwickelt einen erythematösen Hautausschlag. Daher sollte AUGMENTIN Patienten mit Mononukleose nicht verabreicht werden.
Potenzial für mikrobielles Überwachsen
Die Möglichkeit von Superinfektionen mit pilzlichen oder bakteriellen Erregern sollte während der Therapie berücksichtigt werden. Wenn eine Superinfektion auftritt, sollte Amoxicillin/Clavulanat-Kalium abgesetzt und eine geeignete Therapie eingeleitet werden.
Phenylketonurika
AUGMENTIN 500 mg Kautabletten und AUGMENTIN Pulver zur Herstellung einer Lösung zum Einnehmen enthalten Aspartam, das Phenylalanin enthält. Jede 200-mg-Kautablette AUGMENTIN 750 mg enthält 2,1 mg Phenylalanin; jede 400-mg-Kautablette enthält 4,2 mg Phenylalanin; jeweils 5 ml der 200 mg/5 ml oder 400 mg/5 ml Suspension zum Einnehmen enthalten 7 mg Phenylalanin. Die anderen Formulierungen von AUGMENTIN 875 mg enthalten kein Phenylalanin.
Entwicklung arzneimittelresistenter Bakterien
Die Verschreibung von AUGMENTIN 250 mg ohne nachgewiesene oder dringend vermutete bakterielle Infektion bringt dem Patienten wahrscheinlich keinen Nutzen und erhöht das Risiko der Entwicklung arzneimittelresistenter Bakterien.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Es wurden keine Langzeitstudien an Tieren zur Bewertung des kanzerogenen Potenzials durchgeführt.
AUGMENTIN (Formulierung von Amoxicillin:Clavulanat im Verhältnis 4:1) war im bakteriellen Ames-Mutationsassay und im Hefe-Genumwandlungsassay nicht mutagen. AUGMENTIN war im Maus-Lymphom-Assay schwach positiv, aber der Trend zu erhöhten Mutationshäufigkeiten in diesem Assay trat bei Dosen auf, die auch mit einem verringerten Überleben der Zellen verbunden waren. AUGMENTIN war im Maus-Mikrokerntest und im Dominant-Letal-Assay bei Mäusen negativ. Kaliumclavulanat allein wurde im Ames-Bakterienmutationstest und im Maus-Mikrokerntest getestet und war in jedem dieser Tests negativ.
Es wurde festgestellt, dass AUGMENTIN (Amoxicillin:Clavulanat-Formulierung im Verhältnis 2:1) in oralen Dosen von bis zu 1.200 mg/kg/Tag keine Auswirkungen auf die Fertilität und Reproduktionsleistung bei Ratten hatte. Basierend auf der Körperoberfläche entspricht diese Amoxicillin-Dosis etwa dem Vierfachen der maximal empfohlenen oralen Dosis für Erwachsene (875 mg alle 12 Stunden). Für Clavulanat ist das Dosismultiplikator etwa 9-mal höher als die maximal empfohlene orale Dosis für Erwachsene (125 mg alle 8 Stunden), ebenfalls basierend auf der Körperoberfläche.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Teratogene Wirkungen
Schwangerschaftskategorie B. Reproduktionsstudien an trächtigen Ratten und Mäusen, denen AUGMENTIN (Amoxicillin:Clavulanat-Formulierung im Verhältnis 2:1) in oralen Dosen von bis zu 1200 mg/kg/Tag verabreicht wurde, ergaben keine Hinweise auf eine Schädigung des Fötus durch AUGMENTIN. Die Amoxicillin-Dosen bei Ratten und Mäusen (basierend auf der Körperoberfläche) waren etwa das 4- bis 2-fache der maximal empfohlenen oralen Dosis für Erwachsene (875 mg alle 12 Stunden). Für Clavulanat betrugen diese Mehrfachdosen etwa das 9- bis 4-fache der maximal empfohlenen oralen Dosis für Erwachsene (125 mg alle 8 Stunden). Es gibt jedoch keine adäquaten und gut kontrollierten Studien bei Schwangeren. Da Reproduktionsstudien an Tieren die menschliche Reaktion nicht immer vorhersagen, sollte dieses Medikament während der Schwangerschaft nur angewendet werden, wenn dies eindeutig erforderlich ist.
Arbeit und Lieferung
Orale Antibiotika der Ampicillin-Klasse werden während der Geburt schlecht resorbiert. Es ist nicht bekannt, ob die Anwendung von Amoxicillin/Clavulanat-Kalium beim Menschen während der Wehen oder der Entbindung unmittelbare oder verzögerte Nebenwirkungen auf den Fötus hat, die Dauer der Wehen verlängert oder die Wahrscheinlichkeit der Notwendigkeit eines geburtshilflichen Eingriffs erhöht.
Stillende Mutter
Es wurde gezeigt, dass Amoxicillin in die Muttermilch übergeht. Die Anwendung von Amoxicillin/Clavulanat-Kalium durch stillende Mütter kann zu einer Sensibilisierung von Säuglingen führen. Vorsicht ist geboten, wenn Amoxicillin/Clavulanat-Kalium einer stillenden Frau verabreicht wird.
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von AUGMENTIN Pulver zur Herstellung einer Suspension zum Einnehmen und Kautabletten wurden bei pädiatrischen Patienten nachgewiesen. Die Anwendung von AUGMENTIN 125 mg bei pädiatrischen Patienten wird gestützt durch Nachweise aus Studien zu AUGMENTIN Tabletten bei Erwachsenen mit zusätzlichen Daten aus einer Studie zu AUGMENTIN Pulver zur Herstellung einer Suspension zum Einnehmen bei pädiatrischen Patienten im Alter von 2 Monaten bis 12 Jahren mit akuter Mittelohrentzündung. [sehen Klinische Studien ]
Aufgrund der unvollständig entwickelten Nierenfunktion bei Neugeborenen und jungen Säuglingen kann die Elimination von Amoxicillin verzögert sein; Die Ausscheidung von Clavulanat ist in dieser Altersgruppe unverändert. Die Dosierung von AUGMENTIN 500 mg sollte bei pädiatrischen Patienten im Alter von DOSIERUNG UND ANWENDUNG ]
Geriatrische Verwendung
Von den 3.119 Patienten in einer Analyse klinischer Studien mit AUGMENTIN waren 32 % ≥ 65 Jahre und 14 % ≥ 75 Jahre alt. Insgesamt wurden keine Unterschiede in der Sicherheit oder Wirksamkeit zwischen diesen Probanden und jüngeren Probanden beobachtet, und andere berichtete klinische Erfahrungen haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt, aber eine größere Empfindlichkeit einiger älterer Personen kann nicht ausgeschlossen werden.
Es ist bekannt, dass dieses Medikament im Wesentlichen über die Nieren ausgeschieden wird, und das Risiko von Nebenwirkungen dieses Medikaments kann bei Patienten mit eingeschränkter Nierenfunktion größer sein. Da bei älteren Patienten mit größerer Wahrscheinlichkeit eine eingeschränkte Nierenfunktion vorliegt, sollte die Dosis sorgfältig ausgewählt werden, und es kann sinnvoll sein, die Nierenfunktion zu überwachen.
Dosierung bei eingeschränkter Nierenfunktion
Amoxicillin wird hauptsächlich über die Nieren ausgeschieden, und bei Patienten mit schwerer Nierenfunktionsstörung (GFR Patienten mit eingeschränkter Nierenfunktion für spezifische Empfehlungen bei Patienten mit eingeschränkter Nierenfunktion.
ÜBERDOSIS
Im Falle einer Überdosierung die Medikation absetzen, symptomatisch behandeln und gegebenenfalls unterstützende Maßnahmen einleiten. Eine prospektive Studie an 51 pädiatrischen Patienten in einem Giftkontrollzentrum deutete darauf hin, dass Überdosierungen von weniger als 250 mg/kg Amoxicillin nicht mit signifikanten klinischen Symptomen verbunden sind1.
Bei Patienten nach Überdosierung mit Amoxicillin/Clavulanat-Kalium wurde über interstitielle Nephritis berichtet, die zu oligurischem Nierenversagen führte.
Kristallurie, die in einigen Fällen zu Nierenversagen führte, wurde auch nach einer Überdosierung von Amoxicillin/Clavulanat-Kalium bei erwachsenen und pädiatrischen Patienten berichtet. Im Falle einer Überdosierung sollten eine ausreichende Flüssigkeitszufuhr und eine ausreichende Diurese aufrechterhalten werden, um das Risiko einer Amoxicillin/Clavulanat-Kalium-Kristallurie zu verringern. Die Nierenfunktionsstörung scheint nach Beendigung der Arzneimittelgabe reversibel zu sein. Hohe Blutspiegel können bei Patienten mit eingeschränkter Nierenfunktion aufgrund der verringerten renalen Clearance von Amoxicillin/Clavulanat-Kalium leichter auftreten. Amoxicillin/Clavulanat-Kalium kann durch Hämodialyse aus dem Kreislauf entfernt werden. [sehen DOSIERUNG UND ANWENDUNG ]
KONTRAINDIKATIONEN
Schwerwiegende Überempfindlichkeitsreaktionen
AUGMENTIN ist kontraindiziert bei Patienten mit schweren Überempfindlichkeitsreaktionen (z. B. Anaphylaxie oder Stevens-Johnson-Syndrom) auf Amoxicillin, Clavulanat oder andere Beta-Lactam-Antibiotika (z. B. Penicilline und Cephalosporine).
Cholestatische Gelbsucht/Leberfunktionsstörung
AUGMENTIN 250 mg ist kontraindiziert bei Patienten mit cholestatischer Gelbsucht/Leberfunktionsstörung in der Vorgeschichte im Zusammenhang mit AUGMENTIN.
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
AUGMENTIN ist ein antibakterielles Medikament. [sehen Mikrobiologie ]
Pharmakokinetik
Die mittleren pharmakokinetischen Parameter von Amoxicillin und Clavulanat-Kalium bei normalen Erwachsenen nach Verabreichung von AUGMENTIN 250 mg Tabletten sind in Tabelle 3 und nach Verabreichung von AUGMENTIN 250 mg Pulver zur Herstellung einer Suspension zum Einnehmen und Kautabletten sind in Tabelle 4 aufgeführt.
Die orale Verabreichung von 5 ml einer 250-mg/5-ml-Suspension von AUGMENTIN oder der entsprechenden Dosis von 10 ml einer 125-mg/5-ml-Suspension von AUGMENTIN führt zu durchschnittlichen maximalen Serumkonzentrationen etwa 1 Stunde nach der Einnahme von 6,9 µg/ml für Amoxicillin und 1,6 µg /ml für Clavulansäure. Die Flächen unter den Serumkonzentrationskurven, die während der ersten 4 Stunden nach der Verabreichung erhalten wurden, betrugen 12,6 µg*h/ml für Amoxicillin und 2,9 µg*h/ml für Clavulansäure, wenn 5 ml einer 250-mg/5-ml-Suspension von AUGMENTIN oder einer äquivalenten Dosis von AUGMENTIN verabreicht wurden Normalen Erwachsenen wurden 10 ml einer 125-mg/5-ml-Suspension von AUGMENTIN verabreicht. Eine 250-mg-Kautablette AUGMENTIN oder zwei 125-mg-Kautabletten AUGMENTIN entsprechen 5 ml einer 250-mg/5-ml-Suspension von AUGMENTIN und liefern ähnliche Serumkonzentrationen von Amoxicillin und Clavulansäure.
Die mit AUGMENTIN 250 mg erzielten Amoxicillin-Serumkonzentrationen ähneln denen, die durch die orale Verabreichung äquivalenter Dosen von Amoxicillin allein erreicht werden. Es hat sich gezeigt, dass die Zeit oberhalb der minimalen Hemmkonzentration von 1 µg/ml für Amoxicillin nach entsprechenden Dosierungsschemata alle 12 Stunden und alle 8 Stunden von AUGMENTIN 250 mg bei Erwachsenen und Kindern ähnlich ist.
Absorption
Die Einnahme im nüchternen oder satten Zustand hat nur minimale Auswirkungen auf die Pharmakokinetik von Amoxicillin. Während AUGMENTIN unabhängig von den Mahlzeiten verabreicht werden kann, ist die Resorption von Clavulanat-Kalium bei Einnahme mit Nahrung im Vergleich zum nüchternen Zustand größer. In einer Studie war die relative Bioverfügbarkeit von Clavulanat verringert, wenn AUGMENTIN 30 und 150 Minuten nach Beginn eines fettreichen Frühstücks verabreicht wurde.
Verteilung
Keine der Komponenten in AUGMENTIN ist stark proteingebunden; Clavulansäure wird zu etwa 25 % an Humanserum und Amoxicillin zu etwa 18 % gebunden. Amoxicillin diffundiert leicht in die meisten Körpergewebe und -flüssigkeiten mit Ausnahme des Gehirns und der Rückenmarksflüssigkeit.
Zwei Stunden nach oraler Verabreichung einer Einzeldosis von 35 mg/kg AUGMENTIN 500 mg Suspension an nüchterne Kinder wurden im Mittelohrerguss durchschnittliche Konzentrationen von 3 µg/ml Amoxicillin und 0,5 µg/ml Clavulansäure nachgewiesen.
Stoffwechsel und Ausscheidung
Die Halbwertszeit von Amoxicillin nach oraler Gabe von AUGMENTIN 125 mg beträgt 1,3 Stunden und die von Clavulansäure 1 Stunde.
Etwa 50 % bis 70 % des Amoxicillins und etwa 25 % bis 40 % der Clavulansäure werden während der ersten 6 Stunden nach Verabreichung einer einzelnen 250-mg- oder 500-mg-Tablette AUGMENTIN unverändert mit dem Urin ausgeschieden.
Mikrobiologie
Amoxicillin ist ein halbsynthetisches Antibiotikum mit bakterizider In-vitro-Aktivität gegen grampositive und gramnegative Bakterien. Amoxicillin ist jedoch anfällig für den Abbau durch Beta-Lactamasen, und daher umfasst das Aktivitätsspektrum keine Organismen, die diese Enzyme produzieren. Clavulansäure ist ein Beta-Lactam, das strukturell mit den Penicillinen verwandt ist und die Fähigkeit besitzt, einige Beta-Lactamase-Enzyme zu inaktivieren, die häufig in Mikroorganismen vorkommen, die gegen Penicilline und Cephalosporine resistent sind. Insbesondere hat es eine gute Aktivität gegen die klinisch wichtigen Plasmid-vermittelten Betalactamasen, die häufig für übertragene Arzneimittelresistenzen verantwortlich sind.
Die Formulierung von Amoxicillin und Clavulansäure in AUGMENTIN schützt Amoxicillin vor dem Abbau durch einige Beta-Lactamase-Enzyme und erweitert das antibiotische Spektrum von Amoxicillin um viele Bakterien, die normalerweise gegen Amoxicillin resistent sind.
Amoxicillin/Clavulansäure hat sich als wirksam gegen die meisten Isolate der folgenden Bakterien erwiesen, sowohl in vitro als auch bei klinischen Infektionen, wie im Abschnitt INDIKATIONEN UND ANWENDUNG beschrieben.
Gram-positive Bakterien
Staphylococcus aureus
Gramnegative Bakterien
Enterobacter-Spezies Escherichia coli Haemophilus influenzae Klebsiella-Spezies Moraxella catarrhalis
Die folgenden In-vitro-Daten sind verfügbar, ihre klinische Bedeutung ist jedoch unbekannt . Mindestens 90 Prozent der folgenden Bakterien weisen eine minimale In-vitro-Hemmkonzentration (MHK) auf, die kleiner oder gleich dem Empfindlichkeitsgrenzwert für Amoxicillin/Clavulansäure ist. Die Wirksamkeit von Amoxicillin/Clavulansäure bei der Behandlung klinischer Infektionen aufgrund dieser Bakterien ist jedoch nicht gegeben war nicht in adäquaten und gut kontrollierten klinischen Studien etabliert.
Gram-positive Bakterien
Enterococcus faecalis Staphylococcus epidermidis Staphylococcus saprophyticus Streptococcus pneumoniae Streptococcus pyogenes Streptococcus der Viridans-Gruppe
Gramnegative Bakterien
Eikenellacorrodens Proteus mirabilis
Anaerobe Bakterien
Bacteroides-Spezies einschließlich Bacteroides fragilis Fusobacterium-Spezies Peptostreptococcus-Spezies
Empfindlichkeitstestmethoden
Sofern verfügbar, sollte das klinisch-mikrobiologische Labor die Ergebnisse von In-vitro-Empfindlichkeitstests für antimikrobielle Arzneimittel, die in niedergelassenen Krankenhäusern verwendet werden, dem Arzt als regelmäßige Berichte zur Verfügung stellen, die das Empfindlichkeitsprofil von nosokomialen und ambulant erworbenen Krankheitserregern beschreiben. Diese Berichte sollen dem Arzt bei der Auswahl eines antibakteriellen Arzneimittels für die Behandlung helfen.
Verdünnungstechniken
Zur Bestimmung der minimalen Hemmkonzentrationen (MHK) von antimikrobiellen Mitteln werden quantitative Methoden verwendet. Diese MICs liefern Schätzungen der Empfindlichkeit von Bakterien gegenüber antimikrobiellen Verbindungen. Die MHK sollten mit einer standardisierten Testmethode2,3 (Brühe und/oder Agar) bestimmt werden. Die MHK-Werte sollten gemäß den in Tabelle 5 angegebenen Kriterien interpretiert werden.
Diffusionstechniken
Quantitative Methoden, die die Messung von Zonendurchmessern erfordern, können auch reproduzierbare Schätzungen der Empfindlichkeit von Bakterien gegenüber antimikrobiellen Verbindungen liefern. Die Zonengröße liefert eine Schätzung der Empfindlichkeit von Bakterien gegenüber antimikrobiellen Verbindungen. Die Zonengröße sollte mit einem standardisierten Testverfahren bestimmt werden3,4. Bei diesem Verfahren werden mit 30 µg Amoxicillin/Clavulansäure (20 µg Amoxicillin plus 10 µg Clavulansäure) imprägnierte Papierscheiben verwendet, um die Empfindlichkeit von Bakterien gegenüber Amoxicillin/Clavulansäure zu testen. Die Interpretationskriterien für die Bandscheibendiffusion sind in Tabelle 5 aufgeführt.
Qualitätskontrolle
Standardisierte Empfindlichkeitstestverfahren erfordern die Verwendung von Laborkontrollen, um die Genauigkeit und Präzision der im Assay verwendeten Materialien und Reagenzien sowie die Techniken der Personen, die den Test durchführen, zu überwachen und sicherzustellen2,3,4. Standard-Amoxicillin/Clavulansäure-Pulver sollte den folgenden Bereich von MHK-Werten aufweisen, die in Tabelle 6 für die Diffusionstechnik unter Verwendung der 30-µg-Amoxicillin/Clavulansäure-Blättchen (20 µg Amoxicillin plus 10 µg Clavulansäure) angegeben sind, die Kriterien in Tabelle 6 sollten erreicht werden .
Klinische Studien
Untere Atemwege und komplizierte Harnwegsinfektionen
Daten aus 2 zulassungsrelevanten Studien mit 1.191 Patienten, die entweder wegen Infektionen der unteren Atemwege oder wegen komplizierter Harnwegsinfektionen behandelt wurden, verglichen ein Behandlungsschema mit 875-mg-Tabletten AUGMENTIN alle 12 Stunden mit 500-mg-Tabletten AUGMENTIN 125 mg alle 8 Stunden (584 bzw. 607 Patienten ). Eine vergleichbare Wirksamkeit wurde zwischen den Dosierungsschemata alle 12 Stunden und alle 8 Stunden gezeigt. Es gab keinen signifikanten Unterschied im Prozentsatz der unerwünschten Ereignisse in jeder Gruppe. Die am häufigsten berichtete Nebenwirkung war Durchfall; die Inzidenzraten waren bei den Dosierungsschemata 875 mg alle 12 Stunden und 500 mg alle 8 Stunden ähnlich (15 % bzw. 14 %). es gab jedoch einen statistisch signifikanten Unterschied (p
In einer dieser zulassungsrelevanten Studien wurden Patienten entweder mit Pyelonephritis (n = 361) oder einer komplizierten Harnwegsinfektion (d. h. Patienten mit Anomalien der Harnwege, die zu einem Rückfall der Bakteriurie nach Eradikation prädisponieren, n = 268) randomisiert (1: 1) entweder 875-mg-Tabletten AUGMENTIN 125 mg alle 12 Stunden (n = 308) oder 500-mg-Tabletten AUGMENTIN alle 8 Stunden (n = 321).
Die Anzahl der bakteriologisch auswertbaren Patienten war zwischen den beiden Dosierungsschemata vergleichbar. AUGMENTIN 250 mg führte bei Patienten, die 2 bis 4 Tage unmittelbar nach Therapieende untersucht wurden, zu vergleichbaren bakteriologischen Erfolgsraten. Die bakteriologischen Wirksamkeitsraten waren bei einem der Nachsorgebesuche (5 bis 9 Tage nach der Therapie) und bei einem späteren Besuch nach der Therapie (in den meisten Fällen 2 bis 4 Wochen nach der Therapie) vergleichbar, wie in der Tabelle zu sehen ist 7.
Wie bereits erwähnt, gab es zwischen den Regimen einen statistisch signifikanten Unterschied in den Raten von schwerem Durchfall oder Abbruch mit Durchfall, obwohl es keinen signifikanten Unterschied im Prozentsatz der unerwünschten Ereignisse in jeder Gruppe gab.
Akute bakterielle Mittelohrentzündung und Durchfall bei pädiatrischen Patienten
Es wurde eine klinische Studie in den USA/Kanada durchgeführt, in der 45/6,4 mg/kg/Tag (aufgeteilt alle 12 Stunden) von AUGMENTIN über 10 Tage mit 40/10 mg/kg/Tag (aufgeteilt alle 8 Stunden) von AUGMENTIN über 10 Tage verglichen wurden die Behandlung einer akuten Mittelohrentzündung. In diesem Versuch wurden nur die Suspensionsformulierungen verwendet. Insgesamt wurden 575 pädiatrische Patienten (im Alter von 2 Monaten bis 12 Jahren) aufgenommen, mit einer gleichmäßigen Verteilung auf die beiden Behandlungsgruppen und einer vergleichbaren Anzahl von Patienten, die auswertbar waren (dh ³ 84 %) pro Behandlungsgruppe. Otitis media-spezifische Kriterien waren für die Eignung erforderlich, und am Ende der Therapie und Nachsorge wurde eine starke Korrelation zwischen diesen Kriterien und der Beurteilung des klinischen Ansprechens durch den Arzt festgestellt. Die klinischen Wirksamkeitsraten am Ende des Therapiebesuchs (definiert als 2 bis 4 Tage nach Abschluss der Therapie) und beim Nachsorgebesuch (definiert als 22 bis 28 Tage nach Abschluss der Therapie) waren für die beiden Behandlungsgruppen mit den folgenden vergleichbar Heilungsraten der auswertbaren Patienten: Am Ende der Therapie 87 % (n = 265) und 82 % (n = 260) für 45 mg/kg/Tag alle 12 Stunden bzw. 40 mg/kg/Tag alle 8 Stunden . Bei der Nachbeobachtung 67 % (n = 249) und 69 % (n = 243) für 45 mg/kg/Tag alle 12 Stunden bzw. 40 mg/kg/Tag alle 8 Stunden.
Durchfall wurde definiert als: (a) 3 oder mehr wässrige oder 4 oder mehr lockere/wässrige Stühle an einem Tag; ODER (b) 2 wässrige Stühle pro Tag oder 3 lockere/wässrige Stühle pro Tag an 2 aufeinanderfolgenden Tagen. Die Inzidenz von Durchfall war bei Patienten, die alle 12 Stunden behandelt wurden, signifikant niedriger als bei Patienten, die alle 8 Stunden behandelt wurden (14 % bzw. 34 %). Darüber hinaus war die Anzahl der Patienten mit schwerem Durchfall oder Patienten, die wegen Durchfall abgesetzt wurden, in der alle 12 Stunden behandelten Gruppe signifikant niedriger (3 % bzw. 8 % für alle 12 Stunden/10 Tage bzw. alle 8 Stunden/10 Tage). ). In der Behandlungsgruppe alle 12 Stunden wurden 3 Patienten (1 %) wegen einer allergischen Reaktion abgesetzt, während 1 Patient in der Gruppe alle 8 Stunden aus diesem Grund abgesetzt wurde. Die Anzahl der Patienten mit einer Candida-Infektion im Windelbereich betrug 4 % bzw. 6 % für die Gruppen alle 12 Stunden bzw. alle 8 Stunden.
Es ist nicht bekannt, ob der Befund einer statistisch signifikanten Verringerung der Diarrhoe bei den alle 12 Stunden verabreichten Suspensionen zum Einnehmen im Vergleich zu den alle 8 Stunden verabreichten Suspensionen auf die Kautabletten extrapoliert werden kann. Das Vorhandensein von Mannitol in den Kautabletten kann zu einem anderen Durchfallprofil beitragen. Die Suspensionen zum Einnehmen alle 12 Stunden (200 mg/5 ml und 400 mg/5 ml) sind mit Aspartam gesüßt.
INFORMATIONEN ZUM PATIENTEN
Die Patienten sollten darüber informiert werden, dass AUGMENTIN je nach verschriebener Dosis alle 8 Stunden oder alle 12 Stunden eingenommen werden kann. Jede Dosis sollte mit einer Mahlzeit oder einem Snack eingenommen werden, um die Möglichkeit von Magen-Darm-Störungen zu verringern.
Die Patienten sollten darauf hingewiesen werden, dass antibakterielle Arzneimittel, einschließlich AUGMENTIN 125 mg, nur zur Behandlung bakterieller Infektionen angewendet werden sollten. Sie behandeln keine Virusinfektionen (z. B. Erkältung). Wenn AUGMENTIN zur Behandlung einer bakteriellen Infektion verschrieben wird, sollten die Patienten darüber aufgeklärt werden, dass sie sich zwar zu Beginn der Therapie besser fühlen, das Medikament jedoch genau nach Anweisung eingenommen werden sollte. Das Auslassen von Dosen oder das Nichtbeenden des vollständigen Therapieverlaufs kann: (1) die Wirksamkeit der sofortigen Behandlung verringern und (2) die Wahrscheinlichkeit erhöhen, dass Bakterien Resistenzen entwickeln und in Zukunft nicht mehr mit AUGMENTIN 250 mg oder anderen antibakteriellen Arzneimitteln behandelbar sind .
Weisen Sie die Patienten darauf hin, dass Durchfall ein häufiges Problem ist, das durch Antibiotika verursacht wird und normalerweise endet, wenn das Antibiotikum abgesetzt wird. Manchmal können Patienten nach Beginn der Behandlung mit Antibiotika wässrigen und blutigen Stuhl (mit oder ohne Magenkrämpfe und Fieber) sogar noch 2 oder mehr Monate nach Einnahme ihrer letzten Dosis des Antibiotikums entwickeln. Wenn der Durchfall schwerwiegend ist oder länger als 2 oder 3 Tage anhält, sollten die Patienten ihren Arzt kontaktieren.
Patienten sollten angewiesen werden, die Suspension gekühlt aufzubewahren. Vor Gebrauch gut schütteln. Wenn Sie einem Kind die Suspension (Flüssigkeit) von AUGMENTIN 125 mg verabreichen, verwenden Sie einen Dosierlöffel oder eine Pipette. Achten Sie darauf, den Löffel oder die Pipette nach jedem Gebrauch auszuspülen. Flaschen mit AUGMENTIN-Suspension können mehr Flüssigkeit als erforderlich enthalten. Befolgen Sie die Anweisungen Ihres Arztes bezüglich der anzuwendenden Menge und der Behandlungstage, die Ihr Kind benötigt. Entsorgen Sie nicht verwendetes Arzneimittel.
Patienten sollten sich darüber im Klaren sein, dass AUGMENTIN 125 mg ein Arzneimittel der Penicillin-Klasse enthält, das bei manchen Personen allergische Reaktionen hervorrufen kann.