Cipro 1000mg, 250mg, 500mg, 750mg Ciprofloxacin Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Cipro 750 mg und wie wird es angewendet?
Cipro 500 mg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome bakterieller Infektionen. Cipro kann allein oder mit anderen Medikamenten verwendet werden.
Cipro gehört zu einer Klasse von Medikamenten namens Fluorchinolone.
Es ist nicht bekannt, ob Cipro 750 mg bei Kindern unter 1 Jahr sicher und wirksam ist.
Was sind mögliche Nebenwirkungen von Cipro?
Cipro kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Die häufigsten Nebenwirkungen von Cipro 1000 mg sind:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Cipro. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
WARNUNG
SCHWERWIEGENDE NEBENWIRKUNGEN EINSCHLIESSLICH SEHNENENTZÜNDUNG, SEHNENRUPTION, PERIPHERE NEUROPATHIE, AUSWIRKUNGEN AUF DAS ZENTRALE NERVENSYSTEM UND EXAKRBATION VON MYASTHENIA GRAVIS
Setzen Sie Cipro 750 mg sofort ab und vermeiden Sie die Anwendung von Fluorchinolonen, einschließlich Cipro, bei Patienten, bei denen eine dieser schwerwiegenden Nebenwirkungen auftritt [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ]
BEZEICHNUNG
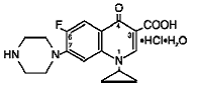
Cipro (Cipro 750 mg Floxacin*) Retardtabletten enthalten Cipro 500 mg Floxacin, ein synthetisches antimikrobielles Mittel zur oralen Verabreichung. Cipro 1000 mg Tabletten sind überzogene Zweischichttabletten, die aus einer Schicht mit sofortiger Freisetzung und einer Schicht mit kontrollierter Freisetzung vom Erosionsmatrixtyp bestehen. Die Tabletten enthalten eine Kombination aus zwei Arten von Ciprofloxacin-Wirkstoff, Ciprofloxacin-Hydrochlorid und Ciprofloxacin-Betain (Base). Cipro 750 mg Floxacinhydrochlorid ist 1-Cyclopropyl-6-fluor-1,4-dihydro-4-oxo-7-(1-piperazinyl)-3-chinolincarbonsäurehydrochlorid. Es wird als Mischung des Monohydrats und des Sesquihydrats bereitgestellt. Die empirische Formel des Monohydrats ist C17H18FN3O3. HCl . H2O und sein Molekulargewicht beträgt 385,8. Die Summenformel des Sesquihydrats ist C17H18FN3O3. HCl . 1,5 H2O und sein Molekulargewicht beträgt 394,8. Der Wirkstoff ist eine schwach gelbliche bis hellgelbe kristalline Substanz. Die chemische Struktur des Monohydrats ist wie folgt:
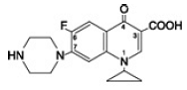
Cipro 1000 mg Floxacinbetain ist 1-Cyclopropyl-6-fluor-1,4-dihydro-4-oxo-7-(1-piperazinyl)-3-chinolincarbonsäure. Als Hydrat ist seine empirische Formel C17H18FN3O3 . 3,5 H2O und sein Molekulargewicht beträgt 394,3. Es ist eine blassgelbe bis hellgelbe kristalline Substanz und hat folgende chemische Struktur:
Cipro ist in Tablettenstärken von 500 mg und 1000 mg (Cipro 500 mg Floxacin-Äquivalent) erhältlich. Cipro-Tabletten sind fast weiße bis leicht gelbliche Filmtabletten mit länglicher Form. Jede Cipro 500 mg Tablette enthält 500 mg Ciprofloxacin als Ciprofloxacin-HCl (287,5 mg, berechnet als Ciprofloxacin auf Trockenbasis) und Cipro 1000 mgfloxacin† (212,6 mg, berechnet auf Trockenbasis). Jede Cipro 1000 mg Tablette enthält 1000 mg Ciprofloxacin als Ciprofloxacin-HCl (574,9 mg, berechnet als Ciprofloxacin auf Trockenbasis) und Cipro 750 mgfloxacin† (425,2 mg, berechnet auf Trockenbasis). Die inaktiven Bestandteile sind Crospovidon, Hypromellose, Magnesiumstearat, Polyethylenglykol, hochdisperses Siliciumdioxid, Bernsteinsäure und Titandioxid.
* da cipro 500 mgfloxacin† und cipro 250 mgfloxacinhydrochlorid † nicht mit dem Trocknungsverlusttest und dem Glührückstandstest der USP-Monographie übereinstimmen.
INDIKATIONEN
Haut- und Hautstrukturinfektionen
CIPRO 1000 mg ist angezeigt bei erwachsenen Patienten zur Behandlung von Haut- und Hautstrukturinfektionen, die durch Escherichia coli, Klebsiella pneumoniae, Enterobacter cloacae, Proteus mirabilis, Proteus vulgaris, Providencia stuartii, Morganella morganii, Citrobacter freundii, Pseudomonas aeruginosa, Methicillin-empfindlicher Staphylococcus aureus, Methicillin-empfindlicher Staphylococcus epidermidis oder Streptococcus pyogenes.
Knochen- und Gelenkinfektionen
CIPRO 750 mg ist bei erwachsenen Patienten zur Behandlung von Knochen- und Gelenkinfektionen indiziert, die durch Enterobacter cloacae, Serratia marcescens oder Pseudomonas aeruginosa verursacht werden.
Komplizierte intraabdominelle Infektionen
CIPRO 250 mg ist angezeigt bei erwachsenen Patienten zur Behandlung von komplizierten intraabdominalen Infektionen (in Kombination mit Metronidazol), die durch Escherichia coli, Pseudomonas aeruginosa, Proteus mirabilis, Klebsiella pneumoniae oder Bacteroides fragilis verursacht werden.
Ansteckender Durchfall
CIPRO 500 mg ist angezeigt bei erwachsenen Patienten zur Behandlung von infektiösem Durchfall, der durch Escherichia coli (enterotoxigene Isolate), Campylobacter jejuni, Shigella boydii †, Shigella dysenteriae, Shigella flexneri oder Shigella sonnei† verursacht wird, wenn eine antibakterielle Therapie indiziert ist.
†Obwohl die Behandlung von Infektionen durch diesen Organismus in diesem Organsystem ein klinisch signifikantes Ergebnis zeigte, wurde die Wirksamkeit bei weniger als 10 Patienten untersucht.
Typhus (Darmfieber)
CIPRO 1000 mg ist angezeigt bei erwachsenen Patienten zur Behandlung von Typhus (Darmfieber), verursacht durch Salmonella typhi. Die Wirksamkeit von Ciprofloxacin bei der Eradikation des chronischen Typhusträgerstatus wurde nicht nachgewiesen.
Unkomplizierte zervikale und urethrale Gonorrhoe
CIPRO ist indiziert bei erwachsenen Patienten zur Behandlung von unkomplizierter zervikaler und urethraler Gonorrhoe aufgrund von Neisseria gonorrhoeae [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Inhalativer Anthrax (Post-Exposition)
CIPRO 250 mg ist bei Erwachsenen und pädiatrischen Patienten von der Geburt bis zum Alter von 17 Jahren bei Inhalationsmilzbrand (nach Exposition) indiziert, um das Auftreten oder Fortschreiten der Erkrankung nach Exposition gegenüber aerosolisiertem Bacillus anthracis zu verringern.
Die beim Menschen erzielten Serumkonzentrationen von 500 mg Floxacin von Cipro dienten als Surrogat-Endpunkt, der mit ziemlicher Wahrscheinlichkeit den klinischen Nutzen vorhersagen konnte, und bildeten die anfängliche Grundlage für die Zulassung dieser Indikation.1 Unterstützende klinische Informationen für Ciprofloxacin zur Milzbrand-Postexpositionsprophylaxe wurden während der Anthrax-Bioterroranschläge im Oktober erhalten 2001 [vgl Klinische Studien ].
Pest
CIPRO 1000 mg ist zur Behandlung von Pest, einschließlich Lungenpest und septikämischer Pest, aufgrund von Yersinia pestis (Y. pestis) und zur Prophylaxe der Pest bei Erwachsenen und pädiatrischen Patienten von der Geburt bis zum Alter von 17 Jahren indiziert. Wirksamkeitsstudien zu Cipro 250 mg Floxacin konnten aus Machbarkeitsgründen nicht bei Menschen mit Pest durchgeführt werden. Daher basiert diese Indikation auf einer Wirksamkeitsstudie, die nur an Tieren durchgeführt wurde [siehe Klinische Studien ].
Chronische bakterielle Prostatitis
CIPRO ist angezeigt bei erwachsenen Patienten zur Behandlung von chronischer bakterieller Prostatitis, die durch Escherichia coli oder Proteus mirabilis verursacht wird.
Infektionen der unteren Atemwege
CIPRO 750 mg ist angezeigt bei erwachsenen Patienten zur Behandlung von Infektionen der unteren Atemwege, die durch Escherichia coli, Klebsiella pneumoniae, Enterobacter cloacae, Proteus mirabilis, Pseudomonas aeruginosa, Haemophilus influenzae, Haemophilus parainfluenzae oder Streptococcus pneumoniae verursacht werden.
CIPRO ist kein Medikament der ersten Wahl bei der Behandlung von vermuteter oder bestätigter Lungenentzündung infolge von Streptococcus pneumoniae.
CIPRO ist angezeigt zur Behandlung akuter Exazerbationen einer chronischen Bronchitis (AECB), die durch Moraxella catarrhalis verursacht werden.
Da Fluorchinolone, einschließlich CIPRO, mit schwerwiegenden Nebenwirkungen in Verbindung gebracht wurden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ] und bei einigen Patienten AECB selbstlimitierend ist, reservieren Sie CIPRO 750 mg für die Behandlung von AECB bei Patienten, die keine alternativen Behandlungsoptionen haben.
Harnwegsinfektion
Harnwegsinfektionen bei Erwachsenen
CIPRO 500 mg ist angezeigt bei erwachsenen Patienten zur Behandlung von Harnwegsinfektionen, die durch Escherichia coli, Klebsiella pneumoniae, Enterobacter cloacae, Serratia marcescens, Proteus mirabilis, Providencia rettgeri, Morganella morganii, Citrobacter koseri, Citrobacter freundii, Pseudomonas aeruginosa, Methicillin-empfindlicher Staphylococcus epidermidis verursacht werden B. Staphylococcus saprophyticus oder Enterococcus faecalis.
Akute unkomplizierte Zystitis
CIPRO 750 mg ist angezeigt bei erwachsenen Patientinnen zur Behandlung von akuter unkomplizierter Zystitis, die durch Escherichia coli oder Staphylococcus saprophyticus verursacht wird.
Da Fluorchinolone, einschließlich CIPRO, mit schwerwiegenden Nebenwirkungen in Verbindung gebracht wurden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ] und bei einigen Patienten eine akute unkomplizierte Zystitis selbstlimitierend ist, sollte CIPRO der Behandlung einer akuten unkomplizierten Zystitis bei Patienten vorbehalten bleiben, für die keine alternativen Behandlungsoptionen zur Verfügung stehen.
Komplizierte Harnwegsinfektionen und Pyelonephritis bei pädiatrischen Patienten
CIPRO ist indiziert bei pädiatrischen Patienten im Alter von 1 bis 17 Jahren zur Behandlung von komplizierten Harnwegsinfektionen (cUTI) und Pyelonephritis aufgrund von Escherichia coli [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Obwohl es in klinischen Studien wirksam war, ist CIPRO kein Medikament der ersten Wahl in der pädiatrischen Population, da es im Vergleich zu Kontrollen häufiger zu Nebenwirkungen kommt, einschließlich Reaktionen im Zusammenhang mit Gelenken und/oder umgebendem Gewebe. CIPRO 250 mg wird wie andere Fluorchinolone mit Arthropathie und histopathologischen Veränderungen in gewichtstragenden Gelenken von Jungtieren in Verbindung gebracht [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN , NEBENWIRKUNGEN , Verwendung in bestimmten Bevölkerungsgruppen und Nichtklinische Toxikologie ].
Akute Sinusitis
CIPRO ist angezeigt bei erwachsenen Patienten zur Behandlung einer akuten Sinusitis, die durch Haemophilus influenzae, Streptococcus pneumoniae oder Moraxella catarrhalis verursacht wird.
Da Fluorchinolone, einschließlich CIPRO, mit schwerwiegenden Nebenwirkungen in Verbindung gebracht wurden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ] und bei einigen Patienten ist die akute Sinusitis selbstlimitierend, reservieren Sie CIPRO für die Behandlung der akuten Sinusitis bei Patienten, die keine alternativen Behandlungsoptionen haben.
Verwendungszweck
Um die Entwicklung von arzneimittelresistenten Bakterien zu verringern und die Wirksamkeit von CIPRO 1000 mg und anderen antibakteriellen Arzneimitteln aufrechtzuerhalten, sollte CIPRO 500 mg nur zur Behandlung oder Vorbeugung von Infektionen angewendet werden, die nachweislich oder mit starkem Verdacht auf empfindliche Bakterien zurückzuführen sind. Wenn Kultur- und Empfindlichkeitsinformationen verfügbar sind, sollten diese bei der Auswahl oder Änderung der antibakteriellen Therapie berücksichtigt werden. In Ermangelung solcher Daten können lokale Epidemiologie und Anfälligkeitsmuster zur empirischen Auswahl der Therapie beitragen.
Wenn der Verdacht besteht, dass anaerobe Organismen zur Infektion beitragen, sollte eine geeignete Therapie eingeleitet werden. Vor der Behandlung sollten geeignete Kultur- und Empfindlichkeitstests durchgeführt werden, um infektionsverursachende Organismen zu isolieren und zu identifizieren und ihre Empfindlichkeit gegenüber Ciprofloxacin zu bestimmen. Eine Therapie mit CIPRO kann begonnen werden, bevor die Ergebnisse dieser Tests bekannt sind; Sobald Ergebnisse vorliegen, sollte eine geeignete Therapie fortgesetzt werden.
Wie bei anderen Arzneimitteln können einige Isolate von Pseudomonas aeruginosa während der Behandlung mit Cipro 1000 mg Floxacin ziemlich schnell Resistenzen entwickeln. Während der Therapie regelmäßig durchgeführte Kultur- und Empfindlichkeitstests geben nicht nur Aufschluss über die therapeutische Wirkung des antimikrobiellen Mittels, sondern auch über das mögliche Auftreten einer bakteriellen Resistenz.
DOSIERUNG UND ANWENDUNG
CIPRO 1000 mg Tabletten und orale Suspension sollten oral verabreicht werden, wie in den entsprechenden Dosierungsrichtlinientabellen beschrieben.
Dosierung bei Erwachsenen
Bei der Bestimmung von Dosierung und Dauer für einen bestimmten Patienten müssen die Schwere und Art der Infektion, die Anfälligkeit des verursachenden Mikroorganismus, die Unversehrtheit der Wirtsabwehrmechanismen des Patienten und der Status der Nieren- und Leberfunktion berücksichtigt werden . CIPRO-Tabletten oder CIPRO-Suspension zum Einnehmen können nach Ermessen des Arztes erwachsenen Patienten verabreicht werden, wenn dies klinisch angezeigt ist. Verabreichen Sie CIPRO zur Herstellung einer Suspension zum Einnehmen mit dem beigepackten graduierten Löffel [siehe DOSIERUNG UND ANWENDUNG ].
Umstellung von IV auf orale Dosierung bei Erwachsenen
Patienten, deren Therapie mit CIPRO IV begonnen wird, können nach Ermessen des Arztes auf CIPRO 750 mg Tabletten oder Suspension zum Einnehmen umgestellt werden, wenn dies klinisch angezeigt ist (Tabelle 2) [siehe KLINISCHE PHARMAKOLOGIE ].
Dosierung bei pädiatrischen Patienten
Die Dosierung und der anfängliche Therapieweg (d. h. intravenös oder oral) für cUTI oder Pyelonephritis sollten von der Schwere der Infektion bestimmt werden. CIPRO sollte wie in Tabelle 3 beschrieben verabreicht werden. CIPRO als Suspension zum Einnehmen mit dem beigepackten graduierten Löffel verabreichen [siehe DOSIERUNG UND ANWENDUNG ].
Dosierungsänderungen bei Patienten mit eingeschränkter Nierenfunktion
Cipro 250 mg Floxacin wird hauptsächlich renal ausgeschieden; das Arzneimittel wird jedoch auch metabolisiert und teilweise durch das Gallensystem der Leber und durch den Darm ausgeschieden. Diese alternativen Eliminationswege scheinen die reduzierte renale Ausscheidung bei Patienten mit eingeschränkter Nierenfunktion zu kompensieren. Dennoch wird eine gewisse Modifikation der Dosierung empfohlen, insbesondere bei Patienten mit schwerer Nierenfunktionsstörung. Dosierungsrichtlinien für die Anwendung bei Patienten mit eingeschränkter Nierenfunktion sind in Tabelle 4 aufgeführt.
Wenn nur die Serumkreatininkonzentration bekannt ist, können die folgenden Formeln verwendet werden, um die Kreatininclearance abzuschätzen:
Das Serumkreatinin sollte einen stabilen Zustand der Nierenfunktion darstellen.
Bei Patienten mit schweren Infektionen und schwerer Nierenfunktionsstörung kann eine Einzeldosis von 750 mg in den oben angegebenen Intervallen verabreicht werden. Die Patienten sollten sorgfältig überwacht werden.
Pädiatrische Patienten mit mittelschwerer bis schwerer Niereninsuffizienz wurden von der klinischen Studie zu cUTI und Pyelonephritis ausgeschlossen. Es liegen keine Informationen über erforderliche Dosisanpassungen bei pädiatrischen Patienten mit mittelschwerer bis schwerer Niereninsuffizienz (d. h. einer Kreatinin-Clearance von
Wichtige Verwaltungsanweisungen
Mit mehrwertigen Kationen
Verabreichen Sie CIPRO mindestens 2 Stunden vor oder 6 Stunden nach Magnesium-/Aluminium-Antazida; polymere Phosphatbinder (zB Sevelamer, Lanthancarbonat) oder Sucralfat; Videx® (Didanosin) Kautabletten/gepufferte Tabletten oder pädiatrisches Pulver zur Herstellung einer Lösung zum Einnehmen; andere stark gepufferte Arzneimittel; oder andere kalzium-, eisen- oder zinkhaltige Produkte.
Mit Milchprodukten
Die gleichzeitige Verabreichung von CIPRO 500 mg mit Milchprodukten (wie Milch oder Joghurt) oder mit Kalzium angereicherten Säften allein sollte vermieden werden, da eine verminderte Resorption möglich ist; CIPRO kann jedoch mit einer Mahlzeit eingenommen werden, die diese Produkte enthält.
Flüssigkeitszufuhr von Patienten, die CIPRO erhalten
Stellen Sie bei Patienten, die CIPRO 1000 mg erhalten, eine ausreichende Flüssigkeitszufuhr sicher, um die Bildung von hochkonzentriertem Urin zu verhindern. Bei Chinolonen wurde über Kristallurie berichtet.
Weisen Sie den Patienten auf die richtige Anwendung von CIPRO 1000 mg hin [siehe Informationen zur Patientenberatung ].
Verpasste Dosen
Wenn eine Dosis ausgelassen wurde, sollte sie zu einem beliebigen Zeitpunkt eingenommen werden, jedoch nicht später als 6 Stunden vor der nächsten planmäßigen Dosis. Wenn bis zur nächsten Dosis weniger als 6 Stunden verbleiben, sollte die vergessene Dosis nicht eingenommen und die Behandlung wie verordnet mit der nächsten planmäßigen Dosis fortgesetzt werden. Doppelte Dosen sollten nicht eingenommen werden, um eine vergessene Dosis auszugleichen.
Splitten von CIPRO 1000 mg Tabletten
CIPRO 750 mg Tabletten, 250 mg und 500 mg sind Tabletten mit funktioneller Bruchkerbe, die an der Bruchkerbe in zwei Hälften geteilt werden können, um eine Stärke von 125 mg bzw. 250 mg zu erhalten.
Anleitung zur Rekonstitution der CIPRO 500 mg Mikrokapseln zur Herstellung einer Suspension zum Einnehmen
CIPRO 750 mg Suspension zum Einnehmen ist in Stärken von 5 % (5 g Ciprofloxacin in 100 ml) und 10 % (10 g Cipro 750 mg Floxacin in 100 ml) erhältlich. CIPRO 250 mg Suspension zum Einnehmen besteht aus zwei Komponenten (Mikrokapseln und Verdünnungsmittel), die vor der Verabreichung kombiniert werden müssen.
Vorbereitung der Suspension
Schritt 1
Die kleine Flasche enthält die Mikrokapseln, die große Flasche das Verdünnungsmittel.

Schritt 2
Öffnen Sie beide Flaschen. Kindersicherungskappe: Drücken Sie gemäß den Anweisungen auf der Kappe nach unten, während Sie sie nach links drehen.

Schritt 3
 Gießen Sie die Mikrokapseln vollständig in die größere Flasche mit Verdünnungsmittel. Fügen Sie der Suspension kein Wasser hinzu .
Schritt 4
 Entfernen Sie die oberste Schicht des Etiketts der Verdünnungsmittelflasche (um das Etikett der CIPRO 1000 mg Suspension zum Einnehmen freizulegen). Verschließen Sie die große Flasche gemäß den Anweisungen auf dem Deckel vollständig und schütteln Sie sie etwa 15 Sekunden lang kräftig. Die Aufhängung ist gebrauchsfertig.
Schritt 5
Schreiben Sie das Verfallsdatum der rekonstituierten Suspension zum Einnehmen auf das Flaschenetikett.
Das rekonstituierte Produkt kann 14 Tage lang unter 30 °C (86 °F) gelagert werden. Vor Frost schützen.
Der fertig gemischten Ciprofloxacin-Suspension dürfen keine Zusätze hinzugefügt werden. CIPRO 1000 mg Suspension zum Einnehmen sollte aufgrund seiner physikalischen Eigenschaften nicht über die Ernährung oder Magensonden (NG) verabreicht werden.
Verabreichungsanleitung für CIPRO zur oralen Suspension nach Rekonstitution
Abbildung 1: Mitverpackter graduierter 5-ml-Teelöffel
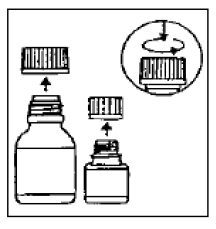
Der mitverpackte graduierte Teelöffel (5 ml) wird mit Markierungen für ½ (2,5 ml) und 1/1 (5 ml) geliefert.
Dosierung von CIPRO zur oralen Suspension mit dem beigepackten Löffel bei Erwachsenen und pädiatrischen Patienten
WIE GELIEFERT
Darreichungsformen und Stärken
Tablets
Mündliche Suspendierung
Lagerung und Handhabung
CIPRO (Cipro 750 mg Floxacinhydrochlorid) Tabletten sind als runde, leicht gelbliche Filmtabletten mit 250 mg Cipro 500 mg Floxacin erhältlich. Die 250-mg-Tablette ist auf einer Seite mit dem Wort „BAYER“ kodiert und auf der Rückseite mit einer funktionellen Bruchrille und Gravur „CIP 250“ versehen. CIPRO ist auch als kapselförmige, leicht gelbliche Filmtablette mit 500 mg Ciprofloxacin erhältlich. Die 500-mg-Tablette ist auf einer Seite mit dem Wort „BAYER“ kodiert und auf der Rückseite mit einer funktionellen Bruchkerbe und Gravur „CIP 500“ versehen. CIPRO 250 mg und 500 mg sind in Flaschen mit 100 Stück erhältlich.
Bei 20° bis 25°C (68° bis 77°F) lagern; Exkursionen erlaubt bis 15° bis 30°C (59° bis 86°F) [siehe USP kontrollierte Raumtemperatur ].
CIPRO Oral Suspension wird in Stärken von 5 % und 10 % geliefert. Das Arzneimittel besteht aus zwei Komponenten (Mikrokapseln mit Wirkstoff und Verdünnungsmittel), die vom Apotheker gemischt werden müssen [vgl DOSIERUNG UND ANWENDUNG ].
Mikrokapseln und Verdünnungsmittel unter 25 °C (77 °F) lagern; Exkursionen sind von 15°C bis 30°C (59°F bis 86°F) erlaubt [siehe USP kontrollierte Raumtemperatur ]. Vor Frost schützen.
Das rekonstituierte Produkt kann 14 Tage lang bei 25 °C (77 °F) gelagert werden; Exkursionen sind von 15°C bis 30°C (59°F bis 86°F) erlaubt [siehe USP kontrollierte Raumtemperatur ]. Vor Frost schützen.
Ein graduierter Teelöffel (5 ml) mit den Markierungen ½ (2,5 ml) und 1/1 (5 ml) wird dem Patienten zur Verfügung gestellt.
VERWEISE
1. 21 CFR 314.510 (Unterabschnitt H – beschleunigte Zulassung neuer Arzneimittel für lebensbedrohliche Krankheiten).
2. Friedman J, Polifka J. Teratogene Wirkungen von Arzneimitteln: eine Ressource für Kliniker (TERIS). Baltimore, Maryland: Johns Hopkins University Press, 2000: 149-195.
3. Loebstein R, Addis A, Ho E, et al. Schwangerschaftsergebnis nach Exposition gegenüber Fluorchinolonen während der Schwangerschaft: eine multizentrische prospektive kontrollierte Studie. Antimikrobielle Mittel Chemother. 1998;42(6):1336-1339.
Hergestellt für: Bayer HealthCare Pharmaceuticals Inc. Whippany, NJ 07981. Überarbeitet: Nov. 2021
NEBENWIRKUNGEN
Die folgenden schwerwiegenden und anderweitig wichtigen unerwünschten Arzneimittelwirkungen werden in anderen Abschnitten der Kennzeichnung ausführlicher erörtert:
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Erwachsene Patienten
Während klinischer Untersuchungen mit oralem und parenteralem CIPRO 750 mg erhielten 49.038 Patienten Behandlungen mit dem Medikament.
Die am häufigsten berichteten Nebenwirkungen aus klinischen Studien mit allen Formulierungen, allen Dosierungen, allen Arzneimitteltherapiedauern und für alle Indikationen der Ciprofloxacin-Therapie waren Übelkeit (2,5 %), Durchfall (1,6 %), anormale Leberfunktionstests (1,3 % ), Erbrechen (1 %) und Hautausschlag (1 %).
In randomisierten, doppelblinden, kontrollierten klinischen Studien, in denen CIPRO-Tabletten [500 mg zweimal täglich (BID)] mit Cefuroximaxetil (250 mg–500 mg BID) und Clarithromycin (500 mg BID) bei Patienten mit Atemwegsinfektionen verglichen wurden, zeigte CIPRO ein ZNS-Nebenwirkungsprofil vergleichbar mit den Kontrollarzneimitteln.
Pädiatrische Patienten
Die kurzzeitige (6 Wochen) und langfristige (1 Jahr) muskuloskelettale und neurologische Sicherheit von oralem/intravenösem Ciprofloxacin wurde mit einem Cephalosporin zur Behandlung von cUTI oder Pyelonephritis bei pädiatrischen Patienten im Alter von 1 bis 17 Jahren (Durchschnittsalter 6 ± 4 Jahre) verglichen ) in einer internationalen multizentrischen Studie. Die Behandlungsdauer betrug 10 bis 21 Tage (die durchschnittliche Behandlungsdauer betrug 11 Tage mit einem Bereich von 1 bis 88 Tagen). Insgesamt wurden 335 mit Cipro 250 mg Floxacin und 349 mit einem Vergleichspräparat behandelte Patienten eingeschlossen.
Ein unabhängiger Ausschuss für pädiatrische Sicherheit (IPSC) überprüfte alle Fälle von muskuloskelettalen Nebenwirkungen, einschließlich abnormer Gangart oder abnormer Gelenkuntersuchung (Ausgangswert oder behandlungsbedingt). Innerhalb von 6 Wochen nach Behandlungsbeginn betrug die Häufigkeit muskuloskelettaler Nebenwirkungen 9,3 % (31/335) in der mit Cipro 750 mg Floxacin behandelten Gruppe gegenüber 6 % (21/349) bei den mit Vergleichspräparaten behandelten Patienten. Alle muskuloskelettalen Nebenwirkungen, die innerhalb von 6 Wochen auftraten, klangen ab (klinisches Abklingen der Anzeichen und Symptome), normalerweise innerhalb von 30 Tagen nach Behandlungsende. Radiologische Untersuchungen wurden nicht routinemäßig durchgeführt, um das Abklingen der Nebenwirkungen zu bestätigen. Mit Cipro 500 mg Floxacin behandelte Patienten berichteten im Vergleich zu Kontrollpatienten mit größerer Wahrscheinlichkeit über mehr als eine Nebenwirkung und mehr als einmal. Die Rate muskuloskelettaler Nebenwirkungen war in der Ciprofloxacin-Gruppe in allen Altersuntergruppen durchweg höher als in der Kontrollgruppe. Am Ende von 1 Jahr betrug die Rate dieser Nebenwirkungen, die zu irgendeinem Zeitpunkt während dieses Zeitraums gemeldet wurden, 13,7 % (46/335) in der mit Cipro 250 mg Floxacin behandelten Gruppe gegenüber 9,5 % (33/349) bei den mit dem Vergleichspräparat behandelten Patienten ( Tabelle 9).
Die Inzidenzraten neurologischer Nebenwirkungen innerhalb von 6 Wochen nach Behandlungsbeginn betrugen 3 % (9/335) in der CIPRO-Gruppe gegenüber 2 % (7/349) in der Vergleichsgruppe und umfassten Schwindel, Nervosität, Schlaflosigkeit und Somnolenz.
In dieser Studie betrug die Gesamtinzidenzrate von Nebenwirkungen innerhalb von 6 Wochen nach Behandlungsbeginn 41 % (138/335) in der Cipro-250-mgfloxacin-Gruppe gegenüber 31 % (109/349) in der Vergleichsgruppe. Die häufigsten Nebenwirkungen waren gastrointestinaler Natur: 15 % (50/335) der Ciprofloxacin-Patienten im Vergleich zu 9 % (31/349) der Vergleichspatienten. Schwerwiegende Nebenwirkungen wurden bei 7,5 % (25/335) der mit Ciprofloxacin behandelten Patienten im Vergleich zu 5,7 % (20/349) der Kontrollpatienten beobachtet. Ein Absetzen des Arzneimittels aufgrund einer Nebenwirkung wurde bei 3 % (10/335) der mit Ciprofloxacin behandelten Patienten im Vergleich zu 1,4 % (5/349) der Vergleichspatienten beobachtet. Andere Nebenwirkungen, die bei mindestens 1 % der Ciprofloxacin-Patienten auftraten, waren Durchfall 4,8 %, Erbrechen 4,8 %, Bauchschmerzen 3,3 %, Dyspepsie 2,7 %, Übelkeit 2,7 %, Fieber 2,1 %, Asthma 1,8 % und Hautausschlag 1,8 %.
Kurzfristige Sicherheitsdaten für Cipro 1000 mg Floxacin wurden auch in einer randomisierten, doppelblinden klinischen Studie zur Behandlung von akuten Lungenexazerbationen bei Mukoviszidose-Patienten (im Alter von 5–17 Jahren) erhoben. Siebenundsechzig Patienten erhielten CIPRO IV 10 mg/kg/Dosis alle 8 Stunden für eine Woche, gefolgt von CIPRO 250 mg Tabletten 20 mg/kg/Dosis alle 12 Stunden, um die 10–21-tägige Behandlung abzuschließen, und 62 Patienten erhielten die Kombination von Ceftazidim intravenös 50 mg/kg/Dosis alle 8 Stunden und Tobramycin intravenös 3 mg/kg/Dosis alle 8 Stunden für insgesamt 10–21 Tage. Periodische muskuloskelettale Untersuchungen wurden von behandlungsblinden Untersuchern durchgeführt. Die Patienten wurden nach Abschluss der Behandlung durchschnittlich 23 Tage lang nachbeobachtet (Bereich 0–93 Tage). Muskel-Skelett-Nebenwirkungen wurden bei 22 % der Patienten in der Ciprofloxacin-Gruppe und bei 21 % in der Vergleichsgruppe berichtet. Ein verringerter Bewegungsumfang wurde bei 12 % der Probanden in der Ciprofloxacin-Gruppe und bei 16 % in der Vergleichsgruppe berichtet. Arthralgie wurde bei 10 % der Patienten in der Cipro-500-mgfloxacin-Gruppe und bei 11 % in der Vergleichsgruppe berichtet. Andere Nebenwirkungen waren in Art und Häufigkeit zwischen den Behandlungsarmen ähnlich. Die Wirksamkeit von CIPRO zur Behandlung akuter Lungenexazerbationen bei pädiatrischen Patienten mit zystischer Fibrose wurde nicht nachgewiesen.
Zusätzlich zu den Nebenwirkungen, die bei pädiatrischen Patienten in klinischen Studien berichtet wurden, sollte damit gerechnet werden, dass Nebenwirkungen, die bei Erwachsenen während klinischer Studien oder Erfahrungen nach Markteinführung berichtet wurden, auch bei pädiatrischen Patienten auftreten können.
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden aus der weltweiten Vermarktungserfahrung mit Fluorchinolonen, einschließlich CIPRO, berichtet. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen (Tabelle 10).
Unerwünschte Laborveränderungen
Änderungen der Laborparameter während der Behandlung mit CIPRO 250 mg sind unten aufgeführt:
Leber –Erhöhungen von ALT (SGPT), AST (SGOT), alkalischer Phosphatase, LDH, Serumbilirubin.
Hämatologisch –Eosinophilie, Leukopenie, verringerte Blutplättchenzahl, erhöhte Blutplättchenzahl, Panzytopenie.
Nieren –Erhöhungen von Serum-Kreatinin, BUN, Kristallurie, Cylindrurie und Hämaturie wurden berichtet.
Andere auftretende Veränderungen waren: Erhöhung der Serum-Gammaglutamyltransferase, Erhöhung der Serumamylase, Senkung des Blutzuckerspiegels, Erhöhung der Harnsäure, Abnahme des Hämoglobins, Anämie, Blutungsdiathese, Erhöhung der Blutmonozyten und Leukozytose.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Ciprofloxacin ist ein Inhibitor des durch das menschliche Cytochrom P450 1A2 (CYP1A2) vermittelten Metabolismus. Die gleichzeitige Verabreichung von CIPRO mit anderen Arzneimitteln, die hauptsächlich durch CYP1A2 metabolisiert werden, führt zu erhöhten Plasmakonzentrationen dieser Arzneimittel und könnte zu klinisch signifikanten unerwünschten Ereignissen des gleichzeitig verabreichten Arzneimittels führen.
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Schwerwiegende Nebenwirkungen, die die Behinderung beeinträchtigen und möglicherweise irreversibel sind, einschließlich Tendinitis und Sehnenriss, periphere Neuropathie und Auswirkungen auf das zentrale Nervensystem
Fluorchinolone, einschließlich CIPRO, wurden mit behindernden und möglicherweise irreversiblen schwerwiegenden Nebenwirkungen von verschiedenen Körpersystemen in Verbindung gebracht, die bei demselben Patienten zusammen auftreten können. Häufig beobachtete Nebenwirkungen sind Tendinitis, Sehnenruptur, Arthralgie, Myalgie, periphere Neuropathie und Auswirkungen auf das zentrale Nervensystem (Halluzinationen, Angstzustände, Depressionen, Schlaflosigkeit, starke Kopfschmerzen und Verwirrtheit). Diese Reaktionen können innerhalb von Stunden bis Wochen nach Beginn von CIPRO auftreten. Bei Patienten jeden Alters oder ohne vorbestehende Risikofaktoren sind diese Nebenwirkungen aufgetreten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Setzen Sie CIPRO 250 mg sofort bei den ersten Anzeichen oder Symptomen einer schwerwiegenden Nebenwirkung ab. Vermeiden Sie außerdem die Anwendung von Fluorchinolonen, einschließlich CIPRO 500 mg, bei Patienten, bei denen eine dieser schwerwiegenden Nebenwirkungen im Zusammenhang mit Fluorchinolonen aufgetreten ist.
Tendinitis und Sehnenriss
Fluorchinolone, einschließlich CIPRO, wurden mit einem erhöhten Risiko für Tendinitis und Sehnenrisse in allen Altersgruppen in Verbindung gebracht [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und NEBENWIRKUNGEN ]. Diese Nebenwirkung betrifft am häufigsten die Achillessehne und wurde auch bei der Rotatorenmanschette (der Schulter), der Hand, dem Bizeps, dem Daumen und anderen Sehnen berichtet. Tendinitis oder Sehnenruptur können innerhalb von Stunden oder Tagen nach Beginn von CIPRO 500 mg oder noch mehrere Monate nach Abschluss der Fluorchinolon-Therapie auftreten. Tendinitis und Sehnenruptur können bilateral auftreten.
Das Risiko, eine Fluorchinolon-assoziierte Tendinitis und einen Sehnenriss zu entwickeln, ist bei Patienten über 60 Jahren, bei Patienten, die Kortikosteroide einnehmen, und bei Patienten mit Nieren-, Herz- oder Lungentransplantation erhöht. Andere Faktoren, die das Risiko eines Sehnenrisses unabhängig voneinander erhöhen können, sind anstrengende körperliche Aktivität, Nierenversagen und frühere Sehnenerkrankungen wie rheumatoide Arthritis. Tendinitis und Sehnenruptur sind auch bei Patienten aufgetreten, die Fluorchinolone eingenommen haben und die oben genannten Risikofaktoren nicht aufweisen. Setzen Sie CIPRO 250 mg sofort ab, wenn der Patient Schmerzen, Schwellungen, Entzündungen oder Sehnenrisse verspürt. Vermeiden Sie Fluorchinolone, einschließlich CIPRO 250 mg, bei Patienten mit einer Vorgeschichte von Sehnenerkrankungen oder bei Patienten mit Tendinitis oder Sehnenriss [siehe NEBENWIRKUNGEN ].
Periphere Neuropathie
Fluorchinolone, einschließlich CIPRO, wurden mit einem erhöhten Risiko für periphere Neuropathie in Verbindung gebracht. Fälle von sensorischer oder sensomotorischer axonaler Polyneuropathie, die kleine und/oder große Axone betraf und zu Parästhesien, Hypästhesien, Dysästhesien und Schwäche führte, wurden bei Patienten berichtet, die Fluorchinolone, einschließlich CIPRO, erhielten. Die Symptome können kurz nach Beginn der CIPRO auftreten und bei einigen Patienten irreversibel sein [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und NEBENWIRKUNGEN ].
Setzen Sie CIPRO sofort ab, wenn beim Patienten Symptome einer peripheren Neuropathie auftreten, einschließlich Schmerzen, Brennen, Kribbeln, Taubheitsgefühl und/oder Schwäche oder andere Veränderungen der Empfindungen, einschließlich leichter Berührung, Schmerzen, Temperatur, Positionsgefühl und Vibrationsgefühl und/oder motorischer Stärke um die Entwicklung eines irreversiblen Zustands zu minimieren. Vermeiden Sie Fluorchinolone, einschließlich CIPRO 500 mg, bei Patienten, bei denen zuvor eine periphere Neuropathie aufgetreten ist [siehe NEBENWIRKUNGEN ].
Auswirkungen auf das zentrale Nervensystem
Psychiatrische Nebenwirkungen
Fluorchinolone, einschließlich CIPRO, wurden mit einem erhöhten Risiko für psychiatrische Nebenwirkungen in Verbindung gebracht, darunter: toxische Psychosen, psychotische Reaktionen, die zu Suizidgedanken/-gedanken fortschreiten, Halluzinationen oder Paranoia; Depression oder selbstverletzendes Verhalten wie versuchter oder vollendeter Suizid; Angst, Aufregung oder Nervosität; Verwirrtheit, Delirium, Orientierungslosigkeit oder Aufmerksamkeitsstörungen; Schlaflosigkeit oder Alpträume; Gedächtnisschwäche. Diese Reaktionen können nach der ersten Dosis auftreten. Weisen Sie Patienten, die CIPRO erhalten, an, unverzüglich ihren Arzt zu informieren, wenn diese Reaktionen auftreten, das Medikament abzusetzen und eine angemessene Behandlung einzuleiten.
Nebenwirkungen des zentralen Nervensystems
Fluorchinolone, einschließlich CIPRO 750 mg, wurden mit einem erhöhten Risiko für Anfälle (Krämpfe), erhöhten intrakraniellen Druck (Pscudotumor cerebri), Schwindel und Zittern in Verbindung gebracht. CIPRO ist wie andere Fluorchinolone dafür bekannt, Anfälle auszulösen oder die Krampfschwelle zu senken. Fälle von Status epilepticus wurden berichtet. Wie bei allen Fluorchinolonen ist CIPRO bei Epilepsiepatienten und Patienten mit bekannten oder vermuteten ZNS-Erkrankungen, die zu Krampfanfällen prädisponieren oder die Krampfschwelle senken können, mit Vorsicht anzuwenden (z Struktur oder Schlaganfall) oder bei Vorliegen anderer Risikofaktoren, die zu Krampfanfällen prädisponieren oder die Krampfschwelle senken können (z. B. bestimmte medikamentöse Therapie, Nierenfunktionsstörung). Wenn Krampfanfälle auftreten, brechen Sie CIPRO 500 mg ab und leiten Sie geeignete Maßnahmen ein [siehe NEBENWIRKUNGEN und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Exazerbation von Myasthenia gravis
Fluorchinolone, einschließlich CIPRO, wirken neuromuskulär blockierend und können die Muskelschwäche bei Patienten mit Myasthenia gravis verschlimmern. Nach der Markteinführung wurden schwerwiegende Nebenwirkungen, einschließlich Todesfälle und Notwendigkeit einer Beatmung, mit der Anwendung von Fluorchinolonen bei Patienten mit Myasthenia gravis in Verbindung gebracht. Vermeiden Sie CIPRO bei Patienten mit bekannter Vorgeschichte von Myasthenia gravis [siehe NEBENWIRKUNGEN ].
Andere schwerwiegende und manchmal tödliche Nebenwirkungen
Andere schwerwiegende und manchmal tödliche Nebenwirkungen, einige aufgrund von Überempfindlichkeit und einige aufgrund ungeklärter Ätiologie, wurden bei Patienten berichtet, die eine Therapie mit Chinolonen, einschließlich CIPRO, erhielten. Diese Ereignisse können schwerwiegend sein und treten im Allgemeinen nach Verabreichung mehrerer Dosen auf. Klinische Manifestationen können eine oder mehrere der folgenden umfassen:
Setzen Sie CIPRO 500 mg sofort beim ersten Auftreten von Hautausschlag, Gelbsucht oder anderen Anzeichen von Überempfindlichkeit ab und leiten Sie unterstützende Maßnahmen ein [siehe NEBENWIRKUNGEN ].
Überempfindlichkeitsreaktionen
Schwerwiegende und gelegentlich tödliche Überempfindlichkeitsreaktionen (anaphylaktische Reaktionen), einige nach der ersten Dosis, wurden bei Patienten berichtet, die eine Fluorchinolon-Therapie, einschließlich CIPRO, erhielten. Einige Reaktionen wurden von Kreislaufkollaps, Bewusstlosigkeit, Kribbeln, Pharynx- oder Gesichtsödem, Dyspnoe, Urtikaria und Juckreiz begleitet. Nur wenige Patienten hatten eine Vorgeschichte von Überempfindlichkeitsreaktionen. Schwerwiegende anaphylaktische Reaktionen erfordern eine sofortige Notfallbehandlung mit Epinephrin und anderen Reanimationsmaßnahmen, einschließlich Sauerstoff, intravenöse Flüssigkeiten, intravenöse Antihistaminika, Kortikosteroide, Pressoramine und Atemwegsmanagement, einschließlich Intubation, wie angezeigt [siehe NEBENWIRKUNGEN ].
Hepatotoxizität
Unter CIPRO wurden Fälle von schwerer Hepatotoxizität, einschließlich Lebernekrose, lebensbedrohlichem Leberversagen und tödlichen Ereignissen, berichtet. Eine akute Leberschädigung setzt schnell ein (Bereich 1–39 Tage) und ist oft mit Überempfindlichkeit verbunden. Das Verletzungsmuster kann hepatozellulär, cholestatisch oder gemischt sein. Die meisten Patienten mit tödlichem Ausgang waren älter als 55 Jahre. Im Falle von Anzeichen und Symptomen einer Hepatitis (wie Anorexie, Gelbsucht, dunkler Urin, Juckreiz oder druckempfindlicher Bauch) brechen Sie die Behandlung sofort ab.
Es kann zu einem vorübergehenden Anstieg der Transaminasen, der alkalischen Phosphatase oder zu einem cholestatischen Ikterus kommen, insbesondere bei Patienten mit vorangegangenem Leberschaden, die mit CIPRO behandelt werden [siehe NEBENWIRKUNGEN ].
Risiko eines Aortenaneurysmas und einer Dissektion
Epidemiologische Studien berichten über eine erhöhte Rate von Aortenaneurysmen und -dissektionen innerhalb von zwei Monaten nach der Anwendung von Fluorchinolonen, insbesondere bei älteren Patienten. Die Ursache für das erhöhte Risiko wurde nicht identifiziert. Bei Patienten mit bekanntem Aortenaneurysma oder Patienten mit erhöhtem Risiko für Aortenaneurysmen sollte CIPRO 750 mg nur dann verwendet werden, wenn keine alternativen antibakteriellen Behandlungen verfügbar sind.
Schwerwiegende Nebenwirkungen bei gleichzeitiger Gabe von Theophyllin
Bei Patienten, die gleichzeitig CIPRO 250 mg und Theophyllin erhielten, wurde über schwerwiegende und tödliche Reaktionen berichtet. Zu diesen Reaktionen gehörten Herzstillstand, Krampfanfälle, Status epilepticus und Atemversagen. Fälle von Übelkeit, Erbrechen, Zittern, Reizbarkeit oder Herzklopfen sind ebenfalls aufgetreten.
Obwohl ähnliche schwerwiegende Nebenwirkungen bei Patienten berichtet wurden, die Theophyllin allein erhielten, kann die Möglichkeit, dass diese Reaktionen durch CIPRO verstärkt werden, nicht ausgeschlossen werden. Wenn eine gleichzeitige Anwendung nicht vermieden werden kann, überwachen Sie die Serumspiegel von Theophyllin und passen Sie die Dosierung gegebenenfalls an [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Clostridioides difficile-assoziierter Durchfall
Clostridioides difficile (C. difficile)-assoziierte Diarrhoe (CDAD) wurde bei der Anwendung von fast allen antibakteriellen Mitteln, einschließlich CIPRO, berichtet und kann in ihrem Schweregrad von leichter Diarrhoe bis hin zu tödlicher Kolitis reichen. Die Behandlung mit antibakteriellen Mitteln verändert die normale Flora des Dickdarms, was zu einem übermäßigen Wachstum von C. difficile führt.
C. difficile produziert die Toxine A und B, die zur Entstehung von CDAD beitragen. Hypertoxin produzierende Isolate von C. difficile verursachen eine erhöhte Morbidität und Mortalität, da diese Infektionen gegenüber einer antimikrobiellen Therapie refraktär sein können und eine Kolektomie erfordern können. CDAD muss bei allen Patienten in Betracht gezogen werden, bei denen nach der Anwendung von Antibiotika Durchfall auftritt. Eine sorgfältige Anamnese ist erforderlich, da berichtet wurde, dass CDAD mehr als zwei Monate nach der Verabreichung von Antibiotika auftritt.
Wenn CDAD vermutet oder bestätigt wird, muss die laufende antibakterielle Anwendung, die nicht gegen C. difficile gerichtet ist, möglicherweise abgebrochen werden. Angemessenes Flüssigkeits- und Elektrolytmanagement, Proteinergänzung, antibakterielle Behandlung von C. difficile und chirurgische Untersuchung, wenn klinisch indiziert [siehe NEBENWIRKUNGEN ].
Verlängerung des QT-Intervalls
Einige Fluorchinolone, einschließlich CIPRO 750 mg, wurden mit einer Verlängerung des QT-Intervalls im Elektrokardiogramm und Fällen von Arrhythmie in Verbindung gebracht. Fälle von Torsade de Pointes wurden während der Überwachung nach Markteinführung bei Patienten berichtet, die Fluorchinolone, einschließlich CIPRO, erhielten.
Vermeiden Sie CIPRO 1000 mg bei Patienten mit bekannter Verlängerung des QT-Intervalls, Risikofaktoren für eine QT-Verlängerung oder Torsade de Pointes (z. B. angeborenes langes QT-Syndrom, unkorrigiertes Elektrolytungleichgewicht, wie Hypokaliämie oder Hypomagnesiämie und Herzerkrankungen, wie Herzinsuffizienz, Myokardiale). Infarkt oder Bradykardie) und Patienten, die Antiarrhythmika der Klasse IA (Chinidin, Procainamid) oder Antiarrhythmika der Klasse III (Amiodaron, Sotalol), trizyklische Antidepressiva, Makrolide und Antipsychotika erhalten. Ältere Patienten können auch anfälliger für arzneimittelbedingte Wirkungen auf das QT-Intervall sein [siehe NEBENWIRKUNGEN , Verwendung in bestimmten Bevölkerungsgruppen ].
Erkrankungen des Bewegungsapparates bei pädiatrischen Patienten und arthropathische Wirkungen bei Tieren
CIPRO 250 mg ist bei pädiatrischen Patienten (unter 18 Jahren) nur für cUTI, Prävention von Lungenmilzbrand (nach Exposition) und Pest indiziert [siehe INDIKATIONEN UND VERWENDUNG ]. Im Vergleich zu Kontrollen wurde eine erhöhte Inzidenz von Nebenwirkungen beobachtet, einschließlich Reaktionen im Zusammenhang mit Gelenken und/oder umgebendem Gewebe [siehe NEBENWIRKUNGEN ].
In vorklinischen Studien verursachte die orale Verabreichung von CIPRO bei unreifen Hunden Lahmheit. Die histopathologische Untersuchung der gewichtstragenden Gelenke dieser Hunde ergab dauerhafte Läsionen des Knorpels. Verwandte Arzneistoffe der Chinolon-Klasse erzeugen auch Erosionen des Knorpels von gewichtstragenden Gelenken und andere Anzeichen von Arthropathie bei unreifen Tieren verschiedener Spezies [siehe Verwendung in bestimmten Bevölkerungsgruppen und Nichtklinische Toxikologie ].
Lichtempfindlichkeit/Phototoxizität
Mittelschwere bis schwere Lichtempfindlichkeits-/Fototoxizitätsreaktionen, letztere können sich als übertriebene Sonnenbrandreaktionen (z. B. Brennen, Erythem, Exsudation, Bläschen, Blasenbildung, Ödeme) äußern, die lichtexponierte Bereiche betreffen (typischerweise das Gesicht, „V“-Bereich des Nacken, Streckseiten der Unterarme, Handrücken) können mit der Anwendung von Chinolonen einschließlich CIPRO nach Sonnen- oder UV-Lichteinwirkung in Verbindung gebracht werden. Vermeiden Sie daher eine übermäßige Exposition gegenüber diesen Lichtquellen. Setzen Sie CIPRO 250 mg ab, wenn Phototoxizität auftritt [siehe NEBENWIRKUNGEN ].
Entwicklung arzneimittelresistenter Bakterien
Die Verschreibung von CIPRO 250 mg Tabletten und CIPRO Suspension zum Einnehmen ohne nachgewiesene oder stark vermutete bakterielle Infektion oder eine prophylaktische Indikation wird dem Patienten wahrscheinlich keinen Nutzen bringen und das Risiko der Entwicklung arzneimittelresistenter Bakterien erhöhen.
Mögliche Risiken bei gleichzeitiger Anwendung von Arzneimitteln, die durch Cytochrom P450 1A2-Enzyme metabolisiert werden
CIPRO 750 mg ist ein Inhibitor des hepatischen CYP1A2-Enzymwegs. Die gleichzeitige Verabreichung von CIPRO und anderen Arzneimitteln, die hauptsächlich durch CYP1A2 metabolisiert werden (z. B. Theophyllin, Methylxanthine, Koffein, Tizanidin, Ropinirol, Clozapin, Olanzapin und Zolpidem), führt zu erhöhten Plasmakonzentrationen des gleichzeitig verabreichten Arzneimittels und könnte zu klinisch signifikanten Nebenwirkungen führen pharmakodynamische Nebenwirkungen des gleichzeitig verabreichten Arzneimittels [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN und KLINISCHE PHARMAKOLOGIE ].
Störung der rechtzeitigen Diagnose von Syphilis
CIPRO 1000 mg hat sich bei der Behandlung von Syphilis nicht als wirksam erwiesen. Antimikrobielle Wirkstoffe, die kurzzeitig in hohen Dosen zur Behandlung von Gonorrhö eingesetzt werden, können die Symptome einer beginnenden Syphilis maskieren oder verzögern. Führen Sie bei allen Patienten mit Gonorrhoe zum Zeitpunkt der Diagnose einen serologischen Test auf Syphilis durch. Führen Sie drei Monate nach der CIPRO-Behandlung einen serologischen Follow-up-Test für Syphilis durch.
Kristallurie
Ciprofloxacin-Kristalle wurden selten im Urin von Menschen beobachtet, häufiger jedoch im Urin von Labortieren, der normalerweise alkalisch ist [vgl Nichtklinische Toxikologie ]. Kristallurie im Zusammenhang mit CIPRO wurde beim Menschen nur selten berichtet, da menschlicher Urin normalerweise sauer ist. Vermeiden Sie eine Alkalinität des Urins bei Patienten, die CIPRO erhalten. Patienten gut hydrieren, um die Bildung von hochkonzentriertem Urin zu verhindern [vgl DOSIERUNG UND ANWENDUNG ].
Blutzuckerstörungen
Fluorchinolone, einschließlich CIPRO, wurden mit Störungen des Blutzuckerspiegels, einschließlich symptomatischer Hyperglykämie und Hypoglykämie, in Verbindung gebracht, üblicherweise bei Diabetikern, die gleichzeitig mit einem oralen Antidiabetika (z. B. Glyburid) oder mit Insulin behandelt wurden. Bei diesen Patienten wird eine sorgfältige Überwachung des Blutzuckers empfohlen. Schwere Fälle von Hypoglykämie, die zu Koma oder Tod führten, wurden berichtet. Wenn bei einem Patienten, der mit CIPRO behandelt wird, eine hypoglykämische Reaktion auftritt, setzen Sie CIPRO 750 mg ab und leiten Sie sofort eine geeignete Therapie ein [siehe NEBENWIRKUNGEN , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Informationen zur Patientenberatung
Weisen Sie den Patienten an, die von der FDA zugelassene Patientenkennzeichnung ( Leitfaden für Medikamente )
Schwerwiegende Nebenwirkungen
Weisen Sie die Patienten an, die Einnahme von CIPRO 250 mg abzubrechen, wenn sie eine Nebenwirkung bemerken, und ihren Arzt um Rat zu fragen, wie sie die vollständige Behandlung mit einem anderen antibakteriellen Medikament abschließen können.
Informieren Sie die Patienten über die folgenden schwerwiegenden Nebenwirkungen, die mit der Anwendung von CIPRO oder anderen Fluorchinolonen in Verbindung gebracht wurden:
Antibakterielle Resistenz
Informieren Sie die Patienten darüber, dass antibakterielle Arzneimittel, einschließlich CIPRO 250 mg Tabletten und CIPRO 1000 mg Suspension zum Einnehmen, nur zur Behandlung bakterieller Infektionen verwendet werden sollten. Sie behandeln keine Virusinfektionen (z. B. Erkältung). Wenn CIPRO 500 mg Tabletten und CIPRO 500 mg Suspension zum Einnehmen zur Behandlung einer bakteriellen Infektion verschrieben werden, sollten die Patienten darüber aufgeklärt werden, dass sie sich zwar zu Beginn der Therapie besser fühlen, das Medikament jedoch genau nach Anweisung eingenommen werden sollte. Das Auslassen von Dosen oder das Nichtbeenden des vollständigen Therapieverlaufs kann (1) die Wirksamkeit der sofortigen Behandlung verringern und (2) die Wahrscheinlichkeit erhöhen, dass Bakterien Resistenzen entwickeln und mit CIPRO 500 mg Tabletten und CIPRO 250 mg Suspension zum Einnehmen oder anderen antibakteriellen Mitteln nicht behandelbar sind Drogen in der Zukunft.
Verwaltungsanweisungen
Weisen Sie den Patienten an
Informieren Sie die Patienten darüber, dass CIPRO 250 mg mit oder ohne Nahrung eingenommen werden kann.
Weisen Sie die Patienten darauf hin, während der Einnahme von CIPRO reichlich Flüssigkeit zu trinken, um die Bildung von hochkonzentriertem Urin und Kristallbildung im Urin zu vermeiden.
Informieren Sie die Patienten darüber, dass Antazida, die Magnesium oder Aluminium sowie Sucralfat, Metallkationen wie Eisen und Multivitaminpräparate mit Zink oder Didanosin enthalten, mindestens zwei Stunden vor oder sechs Stunden nach der Verabreichung von CIPRO 1000 mg eingenommen werden sollten. CIPRO sollte nicht mit Milchprodukten (wie Milch oder Joghurt) oder mit Kalzium angereicherten Säften allein eingenommen werden, da die Resorption von Ciprofloxacin erheblich verringert sein kann; CIPRO 500 mg kann jedoch mit einer Mahlzeit eingenommen werden, die diese Produkte enthält.
Weisen Sie die Patienten darauf hin, dass eine vergessene Dosis zu einem beliebigen Zeitpunkt, jedoch nicht später als 6 Stunden vor der nächsten planmäßigen Dosis eingenommen werden sollte. Wenn bis zur nächsten Dosis weniger als 6 Stunden verbleiben, sollte die vergessene Dosis nicht eingenommen und die Behandlung wie verordnet mit der nächsten planmäßigen Dosis fortgesetzt werden. Doppelte Dosen sollten nicht eingenommen werden, um eine vergessene Dosis auszugleichen.
Weisen Sie die Patienten darauf hin, dass CIPRO 500 mg Tabletten (250 mg und 500 mg) eingekerbt sind und an der eingekerbten Linie in zwei Hälften geteilt werden können, um eine Stärke von 125 mg bzw. 250 mg zu erhalten.
Arzneimittelwechselwirkungen Orale Antidiabetika
Informieren Sie die Patienten darüber, dass bei gleichzeitiger Anwendung von Cipro 250 mg Floxacin und oralen Antidiabetika über Hypoglykämie berichtet wurde; Wenn unter CIPRO 750 mg ein niedriger Blutzucker auftritt, weisen Sie ihn an, seinen Arzt zu konsultieren und dass sein antibakterielles Medikament möglicherweise geändert werden muss.
Milzbrand- und Peststudien
Informieren Sie Patienten, denen CIPRO wegen dieser Erkrankungen verabreicht wurde, dass Wirksamkeitsstudien am Menschen aus Machbarkeitsgründen nicht durchgeführt werden konnten. Daher basierte die Zulassung für diese Erkrankungen auf an Tieren durchgeführten Wirksamkeitsstudien.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Acht In-vitro-Mutagenitätstests wurden mit Cipro 500 mg Floxacin durchgeführt, und die Testergebnisse sind unten aufgeführt:
So waren 2 der 8 Tests positiv, aber die Ergebnisse der folgenden 3 In-vivo-Testsysteme ergaben negative Ergebnisse:
Langzeitstudien zur Karzinogenität bei Ratten und Mäusen ergaben keine karzinogenen oder tumorerzeugenden Wirkungen von Cipro 500 mg Floxacin bei oralen Tagesdosen von bis zu 250 mg/kg bzw. 750 mg/kg bei Ratten bzw. Mäusen (ca die höchste empfohlene therapeutische Dosis basierend auf der Körperoberfläche).
Die Ergebnisse von Photo-Kokarzinogenitätstests zeigen, dass Cipro 1000 mg Floxacin die Zeit bis zum Auftreten von UV-induzierten Hauttumoren im Vergleich zur Vehikelkontrolle nicht verkürzt. Haarlose (Skh-1) Mäuse wurden bis zu 78 Wochen lang fünfmal alle zwei Wochen für 3,5 Stunden UVA-Licht ausgesetzt, während ihnen gleichzeitig Ciprofloxacin verabreicht wurde. Die Zeit bis zur Entwicklung der ersten Hauttumoren betrug 50 Wochen bei Mäusen, die gleichzeitig mit UVA und Cipro 1000 mgfloxacin behandelt wurden (Mausdosis ungefähr gleich der maximal empfohlenen Dosis beim Menschen, basierend auf der Körperoberfläche), im Gegensatz zu 34 Wochen, wenn Tiere mit beiden UVA behandelt wurden und Fahrzeug. Die Zeiten bis zur Entwicklung von Hauttumoren reichten von 16 Wochen bis 32 Wochen bei Mäusen, die gleichzeitig mit UVA und anderen Chinolonen behandelt wurden.5
In diesem Modell entwickelten mit Ciprofloxacin allein behandelte Mäuse keine Haut- oder systemischen Tumore. Es liegen keine Daten von ähnlichen Modellen mit pigmentierten Mäusen und/oder Vollhaarmäusen vor. Die klinische Bedeutung dieser Befunde für den Menschen ist nicht bekannt.
Fertilitätsstudien, die an männlichen und weiblichen Ratten mit oralen Dosen von 250 mg Floxacin von Cipro bis zu 100 mg/kg (etwa das 0,6-fache der höchsten empfohlenen oralen therapeutischen Dosis, basierend auf der Körperoberfläche) durchgeführt wurden, ergaben keine Hinweise auf eine Beeinträchtigung. Männliche Ratten erhielten 10 Wochen vor der Paarung orales Ciprofloxacin, und weibliche Ratten erhielten 3 Wochen vor der Paarung bis zum 7. Trächtigkeitstag eine Dosis.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Zusammenfassung der Risiken
Längere Erfahrungen mit Cipro 1000 mg Floxacin bei schwangeren Frauen über mehrere Jahrzehnte hinweg, basierend auf verfügbaren veröffentlichten Informationen aus Fallberichten, Fall-Kontroll-Studien und Beobachtungsstudien zu Cipro 1000 mg Floxacin, die während der Schwangerschaft verabreicht wurden, haben kein arzneimittelbedingtes Risiko für schwere Geburtsfehler, Fehlgeburten oder Nebenwirkungen ergeben mütterliche oder fetale Ergebnisse (vgl Daten ). Die orale Verabreichung von 500 mg Floxacin von Cipro während der Organogenese in Dosen von bis zu 100 mg/kg an trächtige Mäuse und Ratten und bis zu 30 mg/kg an trächtige Kaninchen verursachte keine fetalen Missbildungen (vgl Daten ). Diese Dosen betrugen das 0,3-, 0,6- bzw. 0,4-fache der maximal empfohlenen klinischen oralen Dosis bei Mäusen, Ratten bzw. Kaninchen, basierend auf der Körperoberfläche. Das geschätzte Hintergrundrisiko schwerer Geburtsfehler und Fehlgeburten für die angegebene Population ist unbekannt. Alle Schwangerschaften haben ein Hintergrundrisiko für Geburtsfehler, Verlust oder andere nachteilige Folgen. In der US-Allgemeinbevölkerung liegt das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten bei klinisch anerkannten Schwangerschaften bei 2 bis 4 % bzw. 15 bis 20 %.
Daten
Menschliche Daten
Während verfügbare Studien das Fehlen eines Risikos nicht definitiv belegen können, haben veröffentlichte Daten aus prospektiven Beobachtungsstudien über mehrere Jahrzehnte keinen Zusammenhang mit der Anwendung von Cipro 250 mg Floxacin während der Schwangerschaft und schweren Geburtsfehlern, Fehlgeburten oder ungünstigen mütterlichen oder fetalen Folgen festgestellt. Verfügbare Studien weisen methodische Einschränkungen auf, darunter eine geringe Stichprobengröße, und einige von ihnen sind nicht spezifisch für Ciprofloxacin. Eine kontrollierte prospektive Beobachtungsstudie folgte 200 Frauen, die während der Schwangerschaft Fluorchinolonen ausgesetzt waren (52,5 % gegenüber Cipro 250 mg Floxacin und 68 % im ersten Trimenon). In-utero-Exposition gegenüber Fluorchinolonen während der Embryogenese war nicht mit einem erhöhten Risiko für schwere Missbildungen verbunden. Die gemeldeten Raten schwerer angeborener Fehlbildungen betrugen 2,2 % für die Fluorchinolon-Gruppe und 2,6 % für die Kontrollgruppe (die Hintergrundinzidenz schwerer Fehlbildungen beträgt 1–5 %). Die Raten von Spontanaborten, Frühgeburten und niedrigem Geburtsgewicht unterschieden sich nicht zwischen den Gruppen, und es gab keine klinisch signifikanten muskuloskelettalen Dysfunktionen bis zum Alter von einem Jahr bei den mit Cipro 500 mgfloxacin behandelten Kindern.
Eine weitere prospektive Folgestudie berichtete über 549 Schwangerschaften mit Fluorchinolon-Exposition (93 % Exposition im ersten Trimester). Es gab 70 Cipro-500-mgfloxacin-Expositionen, alle innerhalb des ersten Trimesters. Die Missbildungsraten bei lebendgeborenen Babys, die Cipro 750 mg Floxacin und Fluorchinolonen insgesamt ausgesetzt waren, lagen beide innerhalb der Bereiche der Hintergrundinzidenz. Es wurden keine spezifischen Muster angeborener Anomalien gefunden. Die Studie zeigte keine eindeutigen Nebenwirkungen aufgrund einer Exposition gegenüber Ciprofloxacin in utero.
Bei Frauen, die während der Schwangerschaft Ciprofloxacin ausgesetzt waren, wurden keine Unterschiede in der Häufigkeit von Frühgeburten, spontanen Aborten oder dem Geburtsgewicht festgestellt. Diese kleinen epidemiologischen Studien nach Markteinführung, bei denen die meisten Erfahrungen aus einer kurzfristigen Exposition im ersten Trimenon stammen, reichen jedoch nicht aus, um das Risiko für weniger häufige Defekte zu bewerten oder zuverlässige und endgültige Schlussfolgerungen zur Sicherheit von Ciprofloxacin bei schwangeren Frauen und ihren sich entwickelnden Föten zuzulassen .
Tierdaten
Entwicklungstoxikologische Studien wurden mit Cipro 500 mg Floxacin an Ratten, Mäusen und Kaninchen durchgeführt. Bei Ratten und Mäusen waren orale Dosen von bis zu 100 mg/kg, die während der Organogenese (Gestationstage, GD, 6-17) verabreicht wurden, nicht mit negativen Auswirkungen auf die Entwicklung, einschließlich embryofetaler Toxizität oder Missbildungen, verbunden. Bei Ratten und Mäusen entspricht eine Dosis von 100 mg/kg etwa dem 0,6- bzw. 0,3-fachen der maximalen oralen Tagesdosis beim Menschen (1500 mg/Tag), bezogen auf die Körperoberfläche. In einer Reihe von entwicklungstoxikologischen Studien an Kaninchen erhielten Kaninchen 250 mg Floxacin Cipro oral oder intravenös für einen der folgenden 5-Tages-Zeiträume: GD 6 bis 10, GD 10 bis 14 oder GD 14 bis 18, um den Zeitraum der Organogenese abzudecken. Dies war ein Versuch, die gastrointestinale Intoleranz abzumildern, die bei Kaninchen beobachtet wurde, die antibakterielle Mittel erhielten, die sich durch reduzierte mütterliche Nahrungsaufnahme und Gewichtsverlust manifestierten und zu embryofetaler Resorption oder spontanem Abort führen können. Eine orale Cipro-Dosis von 750 mg Floxacin von 100 mg/kg (ungefähr das 1,3-fache der höchsten empfohlenen klinischen oralen Dosis basierend auf der Körperoberfläche) verursachte eine übermäßige maternale Toxizität, was die Bewertung der Föten verfälschte. Eine orale Dosis von 30 mg/kg (ungefähr das 0,4-fache der höchsten empfohlenen klinischen oralen Dosis) war mit einer Unterdrückung der mütterlichen und fetalen Körpergewichtszunahme verbunden, es wurden jedoch keine fetalen Missbildungen beobachtet. Die intravenöse Verabreichung von Dosen bis zu 20 mg/kg (etwa das 0,3-fache der höchsten empfohlenen klinischen oralen Dosis, basierend auf der Körperoberfläche) an trächtige Kaninchen war nicht maternaltoxisch und es wurden weder embryofetale Toxizität noch fetale Missbildungen beobachtet.
In peri- und postnatalen Studien erhielten Ratten Cipro 1000 mg Floxacin in Dosen von bis zu 200 mg/kg/Tag (oral) oder bis zu 30 mg/kg/Tag (subkutan) von GD 16 bis 22 Tage nach der Geburt. Die Dosis von 200 mg/kg entspricht ungefähr dem 1,3-fachen der maximal empfohlenen klinischen oralen Dosis, basierend auf der Körperoberfläche. Weder maternale Toxizität noch nachteilige Wirkungen auf das Wachstum und die Entwicklung der Jungtiere wurden beobachtet, einschließlich keinerlei Anzeichen von Arthropathie an den Hinterbeingelenken der Jungtiere. Es wurde gezeigt, dass Ciprofloxacin und andere Chinolone bei unreifen Tieren der meisten getesteten Arten Arthropathie verursachen, wenn sie direkt verabreicht werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und Nichtklinische Toxikologie ].
Stillzeit
Zusammenfassung der Risiken
In der veröffentlichten Literatur wird berichtet, dass Cipro 1000 mg Floxacin nach intravenöser und oraler Verabreichung in der Muttermilch vorhanden ist. Es liegen keine Informationen über die Auswirkungen von CIPRO auf die Milchproduktion oder den gestillten Säugling vor. Aufgrund des potenziellen Risikos schwerwiegender Nebenwirkungen bei gestillten Säuglingen, einschließlich Arthropathie, die in Studien an Jungtieren gezeigt wurden [siehe Verwendung in bestimmten Bevölkerungsgruppen (Klinische Erwägungen)], kann eine stillende Frau bei den meisten Indikationen das Abpumpen und Verwerfen von Muttermilch während der Behandlung mit CIPRO 500 mg und weitere zwei Tage (fünf Halbwertszeiten) nach der letzten Dosis in Betracht ziehen. Weisen Sie eine Frau alternativ darauf hin, dass das Stillen während der Behandlung mit CIPRO und für weitere zwei Tage (fünf Halbwertszeiten) nach der letzten Dosis nicht empfohlen wird.
Bei Inhalations-Milzbrand (nach Exposition) kann jedoch während eines Vorfalls, der zu einer Milzbrand-Exposition führte, die Risiko-Nutzen-Bewertung des Fortsetzens des Stillens, während die Mutter (und möglicherweise der Säugling) CIPRO erhalten, akzeptabel sein [siehe DOSIERUNG UND ANWENDUNG , Pädiatrische Verwendung , und Klinische Studien ]. Die Entwicklungs- und Gesundheitsvorteile des Stillens sollten zusammen mit der klinischen Notwendigkeit der Mutter für CIPRO und möglichen Nebenwirkungen auf das gestillte Kind durch CIPRO 1000 mg oder durch den zugrunde liegenden Zustand der Mutter berücksichtigt werden.
Klinische Überlegungen
Cipro 1000 mg Floxacin kann beim gestillten Säugling eine Veränderung der Darmflora verursachen. Raten Sie einer Frau, den gestillten Säugling auf weichen oder blutigen Stuhl und Candidiasis (Soor, Windeldermatitis) zu überwachen.
Pädiatrische Verwendung
Obwohl CIPRO 750 mg in klinischen Studien wirksam war, ist es kein Medikament der ersten Wahl in der pädiatrischen Population, da im Vergleich zu Kontrollen häufiger Nebenwirkungen auftreten. Chinolone, einschließlich CIPRO, verursachen Arthropathie (Arthralgie, Arthritis) bei Jungtieren [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN und Nichtklinische Toxikologie ].
Komplizierte Harnwegsinfektionen und Pyelonephritis
CIPRO 250 mg ist angezeigt zur Behandlung von cUTI und Pyelonephritis aufgrund von Escherichia coli bei pädiatrischen Patienten im Alter von 1 bis 17 Jahren. Obwohl CIPRO 500 mg in klinischen Studien wirksam war, ist es kein Medikament der ersten Wahl in der pädiatrischen Population aufgrund einer erhöhten Inzidenz von Nebenwirkungen im Vergleich zu den Kontrollen, einschließlich Ereignissen im Zusammenhang mit Gelenken und/oder umgebendem Gewebe [siehe NEBENWIRKUNGEN und Klinische Studien ].
Inhalativer Anthrax (Post-Exposition)
CIPRO 750 mg ist bei pädiatrischen Patienten von der Geburt bis zum Alter von 17 Jahren bei Lungenmilzbrand (nach Exposition) indiziert. Die Nutzen-Risiko-Bewertung weist darauf hin, dass die Verabreichung von Ciprofloxacin bei pädiatrischen Patienten angemessen ist [siehe DOSIERUNG UND ANWENDUNG und Klinische Studien ].
Pest
CIPRO 500 mg ist bei pädiatrischen Patienten von der Geburt bis zum Alter von 17 Jahren zur Behandlung von Pest, einschließlich Lungenpest und septikämischer Pest aufgrund von Yersinia pestis (Y. pestis) und zur Prophylaxe der Pest indiziert. Aus Machbarkeitsgründen konnten keine Wirksamkeitsstudien von CIPRO bei Menschen mit Lungenpest durchgeführt werden. Daher basierte die Zulassung dieser Indikation auf einer an Tieren durchgeführten Wirksamkeitsstudie. Die Nutzen-Risiko-Bewertung weist darauf hin, dass die Verabreichung von CIPRO bei pädiatrischen Patienten angemessen ist [siehe INDIKATIONEN UND VERWENDUNG , DOSIERUNG UND ANWENDUNG und Klinische Studien ].
Geriatrische Verwendung
Geriatrische Patienten haben ein erhöhtes Risiko für die Entwicklung schwerer Sehnenerkrankungen einschließlich Sehnenriss, wenn sie mit einem Fluorchinolon wie CIPRO behandelt werden. Dieses Risiko ist bei Patienten, die gleichzeitig eine Kortikosteroidtherapie erhalten, weiter erhöht. Tendinitis oder Sehnenruptur können die Achillessehne, Hand, Schulter oder andere Sehnenstellen betreffen und während oder nach Abschluss der Therapie auftreten; Fälle, die bis zu mehrere Monate nach der Behandlung mit Fluorchinolonen auftraten, wurden berichtet. Vorsicht ist geboten, wenn CIPRO 500 mg älteren Patienten verschrieben wird, insbesondere solchen, die Kortikosteroide einnehmen. Die Patienten sollten über diese mögliche Nebenwirkung informiert und angewiesen werden, CIPRO 500 mg abzusetzen und sich an ihren Arzt zu wenden, wenn Symptome einer Tendinitis oder eines Sehnenrisses auftreten [siehe Eingerahmte Warnung , WARNUNGEN UND VORSICHTSMASSNAHMEN , und NEBENWIRKUNGEN ].
Epidemiologische Studien berichten über eine erhöhte Rate von Aortenaneurysmen und -dissektionen innerhalb von zwei Monaten nach der Anwendung von Fluorchinolonen, insbesondere bei älteren Patienten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
In einer retrospektiven Analyse von 23 kontrollierten klinischen Mehrfachdosis-Studien zu CIPRO mit über 3500 mit Ciprofloxacin behandelten Patienten waren 25 % der Patienten älter als oder gleich 65 Jahre und 10 % waren älter als oder gleich 75 Jahre. Insgesamt wurden keine Unterschiede in der Sicherheit oder Wirksamkeit zwischen diesen Probanden und jüngeren Probanden beobachtet, und andere berichtete klinische Erfahrungen haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt, aber eine größere Empfindlichkeit einiger älterer Personen gegenüber einer medikamentösen Therapie kann nicht ausgeschlossen werden. Es ist bekannt, dass Ciprofloxacin im Wesentlichen über die Nieren ausgeschieden wird, und das Risiko von Nebenwirkungen kann bei Patienten mit eingeschränkter Nierenfunktion größer sein. Bei Patienten über 65 Jahren mit normaler Nierenfunktion ist keine Dosisänderung erforderlich. Da jedoch bei einigen älteren Personen aufgrund ihres fortgeschrittenen Alters eine eingeschränkte Nierenfunktion auftritt, sollte die Dosis bei älteren Patienten sorgfältig ausgewählt werden, und eine Überwachung der Nierenfunktion kann bei diesen Patienten sinnvoll sein [siehe DOSIERUNG UND ANWENDUNG und KLINISCHE PHARMAKOLOGIE ].
Im Allgemeinen können ältere Patienten anfälliger für arzneimittelbedingte Wirkungen auf das QT-Intervall sein. Daher ist Vorsicht geboten, wenn CIPRO 500 mg gleichzeitig mit Arzneimitteln angewendet wird, die zu einer Verlängerung des QT-Intervalls führen können (z. B. Antiarrhythmika der Klasse IA oder Klasse III) oder bei Patienten mit Risikofaktoren für Torsade de Pointes (z. B. bekannte QT-Verlängerung). , unkorrigierte Hypokaliämie) [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Nierenfunktionsstörung
Cipro 500 mg Floxacin wird hauptsächlich renal ausgeschieden; das Arzneimittel wird jedoch auch metabolisiert und teilweise durch das Gallensystem der Leber und durch den Darm ausgeschieden. Diese alternativen Eliminationswege scheinen die reduzierte renale Ausscheidung bei Patienten mit eingeschränkter Nierenfunktion zu kompensieren. Dennoch wird eine gewisse Modifikation der Dosierung empfohlen, insbesondere bei Patienten mit schwerer Nierenfunktionsstörung [siehe DOSIERUNG UND ANWENDUNG und KLINISCHE PHARMAKOLOGIE ].
Leberfunktionsstörung
In vorläufigen Studien bei Patienten mit stabiler chronischer Leberzirrhose wurden keine signifikanten Veränderungen der Pharmakokinetik von Ciprofloxacin beobachtet. Die Pharmakokinetik von Cipro 500 mg Floxacin bei Patienten mit akuter Leberinsuffizienz wurde nicht untersucht.
ÜBERDOSIS
Bei akuter Überdosierung wurde in einigen Fällen über reversible Nierentoxizität berichtet. Entleeren Sie den Magen durch Erbrechen oder Magenspülung. Beobachten Sie den Patienten sorgfältig und führen Sie eine unterstützende Behandlung durch, einschließlich Überwachung der Nierenfunktion, des Harn-pH-Werts und ggf. Ansäuern, um Kristallurie und die Verabreichung von Magnesium-, Aluminium- oder Calcium-haltigen Antazida zu verhindern, die die Resorption von Cipro 750 mg Floxacin verringern können. Eine ausreichende Hydratation muss aufrechterhalten werden. Nur eine geringe Menge Cipro 250 mg Floxacin (weniger als 10 %) wird nach einer Hämodialyse oder Peritonealdialyse aus dem Körper entfernt.
KONTRAINDIKATIONEN
Überempfindlichkeit
CIPRO 1000 mg ist kontraindiziert bei Personen mit bekannter Überempfindlichkeit gegenüber Cipro 750 mg Floxacin, einem Mitglied der Chinolon-Klasse von Antibiotika oder einem der Produktbestandteile [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Tizanidin
Die gleichzeitige Verabreichung mit Tizanidin ist kontraindiziert [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Ciprofloxacin ist ein Mitglied der Fluorchinolon-Klasse antibakterieller Mittel [siehe Mikrobiologie ].
Pharmakokinetik
Absorption
Die absolute Bioverfügbarkeit von Cipro 500 mg Floxacin beträgt bei Verabreichung als orale Tablette etwa 70 % ohne wesentlichen Verlust durch First-Pass-Metabolisierung. Die maximalen Serumkonzentrationen (Cmax) und die Fläche unter der Kurve (AUC) von Ciprofloxacin sind in der Tabelle für den Dosisbereich von 250 mg bis 1000 mg dargestellt (Tabelle 12).
Maximale Serumkonzentrationen werden 1 bis 2 Stunden nach oraler Einnahme erreicht. Die mittleren Konzentrationen 12 Stunden nach der Gabe von 250, 500 oder 750 mg betragen 0,1, 0,2 bzw. 0,4 µg/ml. Die Eliminationshalbwertszeit aus dem Serum beträgt bei Patienten mit normaler Nierenfunktion etwa 4 Stunden. Die Serumkonzentrationen steigen bei Dosen bis zu 1000 mg proportional an.
Es wurde gezeigt, dass eine alle 12 Stunden verabreichte orale Dosis von 500 mg eine AUC erzeugt, die der einer intravenösen Infusion von 400 mg CIPRO 1000 mg entspricht, die alle 12 Stunden über 60 Minuten verabreicht wird. Es wurde gezeigt, dass eine alle 12 Stunden verabreichte orale Dosis von 750 mg im Steady-State eine AUC erzeugt, die der einer intravenösen Infusion von 400 mg über 60 Minuten alle 8 Stunden entspricht. Eine orale Dosis von 750 mg führt zu einer ähnlichen Cmax wie bei einer intravenösen Dosis von 400 mg (Tabelle 13). Eine alle 12 Stunden verabreichte orale Dosis von 250 mg erzeugt eine AUC, die derjenigen einer alle 12 Stunden verabreichten Infusion von 200 mg CIPRO 1000 mg entspricht.
Essen
Wenn CIPRO Tablette gleichzeitig mit Nahrung verabreicht wird, kommt es zu einer Verzögerung bei der Resorption des Arzneimittels, was zu Spitzenkonzentrationen führt, die eher 2 Stunden nach der Einnahme als 1 Stunde auftreten, während bei der Einnahme von CIPRO 750 mg Suspension mit Nahrung keine Verzögerung beobachtet wird . Die Gesamtresorption von CIPRO 1000 mg Tablette oder CIPRO 500 mg Suspension wird jedoch nicht wesentlich beeinflusst. Die Pharmakokinetik von Cipro 750 mg Floxacin als Suspension wird auch nicht durch Nahrung beeinflusst. Vermeiden Sie die gleichzeitige Verabreichung von CIPRO mit Milchprodukten (wie Milch oder Joghurt) oder mit Kalzium angereicherten Säften allein, da eine verminderte Resorption möglich ist; CIPRO 1000 mg kann jedoch mit einer Mahlzeit eingenommen werden, die diese Produkte enthält
Bei oraler Verabreichung ist eine 500-mg-Dosis, gegeben als 10 ml der 5 %igen CIPRO-Suspension (mit 250 mg Ciprofloxacin/5 ml), bioäquivalent zu der 500-mg-Tablette. Ein Volumen von 10 ml der 5 % CIPRO 1000 mg Suspension (mit 250 mg Ciprofloxacin/5 ml) ist bioäquivalent zu einem 5 ml Volumen der 10 % CIPRO 750 mg Suspension (mit 500 mg Cipro 1000 mg Floxacin/5 ml).
Verteilung
Die Bindung von Ciprofloxacin an Serumproteine beträgt 20 % bis 40 %, was wahrscheinlich nicht hoch genug ist, um signifikante proteinbindende Wechselwirkungen mit anderen Arzneimitteln zu verursachen.
Nach oraler Verabreichung wird Cipro 250 mg Floxacin im ganzen Körper verteilt. Sowohl bei Männern als auch bei Frauen übersteigen die Gewebekonzentrationen häufig die Serumkonzentrationen, insbesondere im Genitalgewebe einschließlich der Prostata. Ciprofloxacin ist in aktiver Form in Speichel, Nasen- und Bronchialsekreten, Schleimhäuten der Nasennebenhöhlen, Sputum, Hautblasenflüssigkeit, Lymphe, Peritonealflüssigkeit, Galle und Prostatasekreten vorhanden. Cipro 500mgfloxacin wurde auch in Lunge, Haut, Fett, Muskeln, Knorpel und Knochen nachgewiesen. Das Medikament diffundiert in die Zerebrospinalflüssigkeit (CSF); die Liquorkonzentrationen betragen jedoch im Allgemeinen weniger als 10 % der maximalen Serumkonzentrationen. Im Kammerwasser und im Glaskörper des Auges wurden geringe Konzentrationen des Arzneimittels nachgewiesen.
Stoffwechsel
Im menschlichen Urin wurden vier Metaboliten identifiziert, die zusammen etwa 15 % einer oralen Dosis ausmachen. Die Metaboliten haben antimikrobielle Aktivität, sind aber weniger aktiv als unverändertes Cipro 500 mg Floxacin. Cipro 500 mgfloxacin ist ein Inhibitor des humanen Cytochrom P450 1A2 (CYP1A2)-vermittelten Metabolismus. Die gleichzeitige Verabreichung von Ciprofloxacin mit anderen Arzneimitteln, die hauptsächlich durch CYP1A2 metabolisiert werden, führt zu erhöhten Plasmakonzentrationen dieser Arzneimittel und könnte zu klinisch signifikanten unerwünschten Ereignissen des gleichzeitig angewendeten Arzneimittels führen [siehe KONTRAINDIKATIONEN , WARNUNGEN UND VORSICHTSMASSNAHMEN , und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Ausscheidung
Die Eliminationshalbwertszeit aus dem Serum beträgt bei Patienten mit normaler Nierenfunktion etwa 4 Stunden. Etwa 40 bis 50 % einer oral verabreichten Dosis werden unverändert im Urin ausgeschieden. Nach einer oralen Dosis von 250 mg übersteigen die Urinkonzentrationen von 500 mg Floxacin von Cipro normalerweise 200 Mikrogramm/ml während der ersten zwei Stunden und liegen 8 bis 12 Stunden nach der Einnahme bei etwa 30 Mikrogramm/ml. Die Urinausscheidung von Ciprofloxacin ist innerhalb von 24 Stunden nach der Einnahme praktisch vollständig. Die renale Clearance von Cipro 250 mg Floxacin, die ungefähr 300 ml/Minute beträgt, übersteigt die normale glomeruläre Filtrationsrate von 120 ml/Minute. Somit scheint die aktive tubuläre Sekretion eine bedeutende Rolle bei ihrer Elimination zu spielen. Die gleichzeitige Anwendung von Probenecid mit Ciprofloxacin führt zu einer etwa 50 %igen Verringerung der renalen Clearance von Ciprofloxacin und einer 50 %igen Erhöhung seiner Konzentration im systemischen Kreislauf.
Obwohl die Gallenkonzentrationen von 250 mg Floxacin von Cipro um ein Vielfaches höher sind als die Serumkonzentrationen nach oraler Gabe, wird nur eine kleine Menge der verabreichten Dosis als unveränderter Wirkstoff aus der Galle wiedergewonnen. Weitere 1 % bis 2 % der Dosis werden in Form von Metaboliten aus der Galle wiedergewonnen. Etwa 20 % bis 35 % einer oralen Dosis werden innerhalb von 5 Tagen nach der Einnahme aus den Fäzes wiedergefunden. Dies kann entweder aus der biliären Clearance oder der transintestinalen Elimination resultieren.
Spezifische Populationen
Alten
Pharmakokinetische Studien der oralen (Einzeldosis) und intravenösen (Einzel- und Mehrfachdosis) Form von Cipro 250 mgfloxacin weisen darauf hin, dass die Plasmakonzentrationen von Ciprofloxacin bei älteren Personen (älter als 65 Jahre) höher sind als bei jungen Erwachsenen. Obwohl die Cmax um 16 % bis 40 % erhöht ist, beträgt die Zunahme der mittleren AUC etwa 30 % und kann zumindest teilweise auf eine verringerte renale Clearance bei älteren Patienten zurückgeführt werden. Die Eliminationshalbwertszeit ist bei älteren Patienten nur geringfügig (~20 %) verlängert. Diese Unterschiede werden nicht als klinisch signifikant betrachtet [vgl Verwendung in bestimmten Bevölkerungsgruppen ].
Nierenfunktionsstörung
Bei Patienten mit eingeschränkter Nierenfunktion ist die Halbwertszeit von Ciprofloxacin leicht verlängert. Dosisanpassungen können erforderlich sein [siehe Verwendung in bestimmten Bevölkerungsgruppen und DOSIERUNG UND ANWENDUNG ].
Leberfunktionsstörung
In vorläufigen Studien bei Patienten mit stabiler chronischer Leberzirrhose wurden keine signifikanten Veränderungen der Pharmakokinetik von Ciprofloxacin beobachtet. Die Kinetik von Cipro 750 mg Floxacin bei Patienten mit akuter Leberinsuffizienz wurde nicht vollständig untersucht.
Pädiatrie
Tabelle 14 fasst pharmakokinetische Parameter bei pädiatrischen Patienten im Alter von unter 1 bis unter 12 Jahren zusammen, die eine intravenöse Behandlung erhalten.
Diese Werte liegen innerhalb des für Erwachsene bei therapeutischen Dosen berichteten Bereichs. Basierend auf einer populationspharmakokinetischen Analyse von pädiatrischen Patienten mit verschiedenen Infektionen beträgt die vorhergesagte mittlere Halbwertszeit bei Kindern etwa 4 Stunden bis 5 Stunden, und die Bioverfügbarkeit der Suspension zum Einnehmen beträgt etwa 60 %.
Arzneimittelwechselwirkungen
Antazida
Die gleichzeitige Verabreichung von Antazida, die Magnesiumhydroxid oder Aluminiumhydroxid enthalten, kann die Bioverfügbarkeit von Cipro 500 mg Floxacin um bis zu 90 % reduzieren [siehe DOSIERUNG UND ANWENDUNG und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Histamin-H2-Rezeptor-Antagonisten
Histamin-H2-Rezeptor-Antagonisten scheinen keine signifikante Wirkung auf die Bioverfügbarkeit von Cipro 250 mg Floxacin zu haben.
Metronidazol
Die Serumkonzentrationen von Ciprofloxacin und Metronidazol veränderten sich nicht, wenn diese beiden Arzneimittel gleichzeitig verabreicht wurden.
Tizanidin
In einer pharmakokinetischen Studie war die systemische Exposition von Tizanidin (4 mg Einzeldosis) signifikant erhöht (Cmax 7-fach, AUC 10-fach), wenn das Arzneimittel gleichzeitig mit CIPRO (500 mg zweimal täglich für 3 Tage) gegeben wurde. Die gleichzeitige Verabreichung von Tizanidin und CIPRO ist aufgrund der Potenzierung der blutdrucksenkenden und sedierenden Wirkung von Tizanidin kontraindiziert [siehe KONTRAINDIKATIONEN ].
Ropinirol
In einer Studie, die an 12 Patienten mit Parkinson-Krankheit durchgeführt wurde, denen 6 mg Ropinirol einmal täglich mit 500 mg CIPRO 250 mg zweimal täglich verabreicht wurde, stiegen die mittlere Cmax und die mittlere AUC von Ropinirol um 60 % bzw. 84 %. Während und kurz nach der gleichzeitigen Anwendung mit CIPRO wird eine Überwachung auf Ropinirol-bedingte Nebenwirkungen und eine angemessene Dosisanpassung von Ropinirol empfohlen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Clozapin
Nach gleichzeitiger Verabreichung von 250 mg CIPRO 500 mg mit 304 mg Clozapin über 7 Tage waren die Serumkonzentrationen von Clozapin und N-Desmethylclozapin um 29 % bzw. 31 % erhöht. Eine sorgfältige Überwachung von Clozapin-assoziierten Nebenwirkungen und eine angemessene Anpassung der Clozapin-Dosierung während und kurz nach der gleichzeitigen Anwendung mit CIPRO werden empfohlen.
Sildenafil
Nach gleichzeitiger Verabreichung einer oralen Einzeldosis von 50 mg Sildenafil mit 500 mg CIPRO 1000 mg an gesunde Probanden waren sowohl die mittlere Cmax als auch die mittlere AUC von Sildenafil etwa zweifach erhöht. Verwenden Sie Sildenafil bei gleichzeitiger Verabreichung mit CIPRO 500 mg mit Vorsicht, da bei gleichzeitiger Verabreichung von CIPRO eine zweifache Erhöhung der Sildenafil-Exposition zu erwarten ist.
Duloxetin
In klinischen Studien wurde gezeigt, dass die gleichzeitige Anwendung von Duloxetin mit starken Inhibitoren des CYP450 1A2-Isozyms wie Fluvoxamin zu einem 5-fachen Anstieg der mittleren AUC und einem 2,5-fachen Anstieg der mittleren Cmax von Duloxetin führen kann.
Lidocain
In einer an 9 gesunden Freiwilligen durchgeführten Studie führte die gleichzeitige Anwendung von 1,5 mg/kg Lidocain i.v. mit CIPRO 500 mg zweimal täglich zu einem Anstieg der Cmax und AUC von Lidocain um 12 % bzw. 26 %. Obwohl die Behandlung mit Lidocain bei dieser erhöhten Exposition gut vertragen wurde, kann es bei gleichzeitiger Anwendung zu einer möglichen Wechselwirkung mit CIPRO und einer Zunahme von Nebenwirkungen im Zusammenhang mit Lidocain kommen.
Metoclopramid
Metoclopramid beschleunigt die Resorption von oralem Cipro 750 mg Floxacin signifikant, was zu einer kürzeren Zeit bis zum Erreichen maximaler Plasmakonzentrationen führt. Es wurde keine signifikante Wirkung auf die Bioverfügbarkeit von Ciprofloxacin beobachtet.
Omeprazol
Wenn CIPRO 18 gesunden Probanden als Einzeldosis von 1000 mg gleichzeitig mit Omeprazol (40 mg einmal täglich über drei Tage) verabreicht wurde, reduzierten sich die mittlere AUC und Cmax von Ciprofloxacin um 20 % bzw. 23 %. Die klinische Bedeutung dieser Wechselwirkung wurde nicht bestimmt.
Mikrobiologie
Wirkmechanismus
Die bakterizide Wirkung von Cipro 750 mg Floxacin resultiert aus der Hemmung der Enzyme Topoisomerase II (DNA-Gyrase) und Topoisomerase IV (beides Typ-II-Topoisomerasen), die für die bakterielle DNA-Replikation, -Transkription, -Reparatur und -Rekombination erforderlich sind.
Widerstandsmechanismus
Der Wirkungsmechanismus von Fluorchinolonen, einschließlich Ciprofloxacin, unterscheidet sich von dem von Penicillinen, Cephalosporinen, Aminoglykosiden, Makroliden und Tetracyclinen; Daher können Mikroorganismen, die gegen diese Arzneimittelklassen resistent sind, gegenüber Ciprofloxacin empfindlich sein. Eine Resistenz gegenüber Fluorchinolonen tritt hauptsächlich entweder durch Mutationen in den DNA-Gyrasen, eine verringerte Permeabilität der äußeren Membran oder einen Arzneimittelausfluss auf. In-vitro-Resistenz gegen Ciprofloxacin entwickelt sich langsam durch mehrstufige Mutationen. Eine Resistenz gegenüber Ciprofloxacin aufgrund spontaner Mutationen tritt mit einer allgemeinen Häufigkeit von
Kreuzwiderstand
Es ist keine Kreuzresistenz zwischen Cipro 1000 mg Floxacin und anderen Klassen von Antibiotika bekannt.
Es wurde gezeigt, dass Ciprofloxacin gegen die meisten Isolate der folgenden Bakterien aktiv ist, sowohl in vitro als auch bei klinischen Infektionen [vgl INDIKATIONEN UND VERWENDUNG ].
Grampositive Bakterien
Bacillus anthracis Enterococcus faecalis Staphylococcus aureus (nur Methicillin-empfindliche Isolate) Staphylococcus epidermidis (nur Methicillin-empfindliche Isolate) Staphylococcus saprophyticus Streptococcus pneumoniae Streptococcus pyogenes
Gramnegative Bakterien
Campylobacter jejuni Citrobacter koseri Citrobacter freundii Enterobacter cloacae Escherichia coli Haemophilus influenza Haemophilus parainfluenzae Klebsiella pneumonia Moraxella catarrhalis Morganella morganii Neisseria gonorrhoeae Proteus mirabilis Proteus vulgaris Providencia rettgeri Providencia stuartii Pseudomonas aeruginosa Salmonella typhi Serratia marcescens Shigella boydii Shigella dysenteriae Shigella flexneri Shigella sonnei Yersinia pestis
Die folgenden In-vitro-Daten sind verfügbar, ihre klinische Bedeutung ist jedoch nicht bekannt. Mindestens 90 Prozent der folgenden Bakterien weisen eine minimale In-vitro-Hemmkonzentration (MHK) auf, die kleiner oder gleich der Empfindlichkeitsgrenze für 750 mg Floxacin von Cipro gegenüber Isolaten ähnlicher Gattungen oder Organismengruppen ist. Die Wirksamkeit von Cipro 500 mg Floxacin bei der Behandlung klinischer Infektionen, die durch diese Bakterien verursacht werden, wurde jedoch nicht in angemessenen und gut kontrollierten klinischen Studien nachgewiesen.
Grampositive Bakterien
Staphylococcus haemolyticus (nur Methicillin-empfindliche Isolate) Staphylococcus hominis (nur Methicillin-empfindliche Isolate)
Gramnegative Bakterien
Acinetobacter lwoffi Aeromonas hydrophila Edwardsiella tarda Enterobacter aerogenes Klebsiella oxytoca Legionella pneumophila Pasteurella multocida Salmonella enteritidis Vibrio cholera Vibrio parahaemolyticus Vibrio vulnificus Yersinia enterocolitica
Empfindlichkeitsprüfung
Spezifische Informationen zu den Interpretationskriterien von Empfindlichkeitstests und zugehörigen Testmethoden und Qualitätskontrollstandards, die von der FDA für dieses Medikament anerkannt sind, finden Sie unter: https://www.fda.gov/STIC.
Klinische Studien
Komplizierte Harnwegsinfektionen und Pyelonephritis – Wirksamkeit bei pädiatrischen Patienten
Intravenös und/oder oral verabreichtes CIPRO wurde mit einem Cephalosporin zur Behandlung von cUTI und Pyelonephritis bei pädiatrischen Patienten im Alter von 1 bis 17 Jahren (Durchschnittsalter 6 ± 4 Jahre) verglichen. Die Studie wurde in den USA, Kanada, Argentinien, Peru, Costa Rica, Mexiko, Südafrika und Deutschland durchgeführt. Die Behandlungsdauer betrug 10 bis 21 Tage (die durchschnittliche Behandlungsdauer betrug 11 Tage mit einem Bereich von 1 bis 88 Tagen). Das primäre Ziel der Studie war die Bewertung der muskuloskelettalen und neurologischen Sicherheit.
Die Patienten wurden 5 bis 9 Tage nach der Therapie auf klinischen Erfolg und bakteriologische Eradikation des/der Basiskeim(e) ohne neue Infektion oder Superinfektion untersucht (Test of Cure oder TOC). Die Per-Protocol-Population hatte einen oder mehrere verursachende Organismen mit protokollspezifizierter(n) Koloniezahl(en) zu Studienbeginn, keinen Protokollverstoß und keinen vorzeitigen Abbruch oder Verlust der Nachsorge (neben anderen Kriterien).
Der klinische Erfolg und die bakteriologischen Eradikationsraten in der Per-Protocol-Population waren ähnlich wie unten gezeigt zwischen CIPRO 250 mg und der Vergleichsgruppe.
Inhalativer Milzbrand bei Erwachsenen und Kindern
Die mittleren Serumkonzentrationen von Ciprofloxacin, die mit einer statistisch signifikanten Verbesserung der Überlebenszeit im Rhesusaffen-Modell für Lungenmilzbrand einhergehen, werden bei erwachsenen und pädiatrischen Patienten, die orale und intravenöse Therapien erhalten, erreicht oder überschritten. Die Pharmakokinetik von Cipro 500 mgfloxacin wurde in verschiedenen menschlichen Populationen untersucht. Die mittlere maximale Serumkonzentration, die im Steady-State bei Erwachsenen, die 500 mg oral alle 12 Stunden erhalten, erreicht wird, beträgt 2,97 µg/ml und 4,56 µg/ml nach 400 mg intravenös alle 12 Stunden. Die mittlere Serum-Talkonzentration im Steady-State für diese beiden Behandlungsschemata beträgt 0,2 µg/ml. In einer Studie mit 10 pädiatrischen Patienten im Alter zwischen 6 und 16 Jahren betrug die mittlere maximale Plasmakonzentration 8,3 µg/ml und die minimalen Konzentrationen lagen zwischen 0,09 µg/ml und 0,26 µg/ml nach zwei 30-minütigen intravenösen Infusionen von 10 mg/kg im Abstand von 12 Stunden verabreicht. Nach der zweiten intravenösen Infusion erreichen Patienten, die alle 12 Stunden auf 15 mg/kg oral umgestellt wurden, nach der oralen Initialdosis eine mittlere Spitzenkonzentration von 3,6 µg/ml. Langzeitsicherheitsdaten, einschließlich Auswirkungen auf den Knorpel, nach der Verabreichung von CIPRO an pädiatrische Patienten sind begrenzt. Die beim Menschen erzielten Serumkonzentrationen von 1000 mg Floxacin von Cipro dienen als Surrogat-Endpunkt, um den klinischen Nutzen mit ziemlicher Wahrscheinlichkeit vorherzusagen, und bilden die Grundlage für diese Indikation.1
Es wurde eine placebokontrollierte Tierstudie an Rhesusaffen durchgeführt, die einer inhalierten mittleren Dosis von 11 LD50 (~5,5 x 105 Sporen (Bereich 5–30 LD50) von B. anthracis ausgesetzt waren. Die minimale Hemmkonzentration (MHK) von Cipro 250 mgfloxacin für der in dieser Studie verwendete Milzbrandstamm betrug 0,08 µg/ml.Bei den untersuchten Tieren lagen die mittleren Serumkonzentrationen von Cipro 1000 mgfloxacin, die bei der erwarteten Tmax (1 Stunde nach der Einnahme) nach oraler Gabe bis zum Steady-State erreicht wurden, im Bereich von 0,98 µg/ml bis 1,69 Mittlere Steady-State-Talkonzentrationen 12 Stunden nach der Dosisgabe lagen im Bereich von 0,12 µg/ml bis 0,19 µg/ml.6 Mortalität aufgrund von Anthrax bei Tieren, die eine 30-tägige Behandlung mit oralem Cipro 750 mg Floxacin erhielten, beginnend 24 Stunden nach der Verabreichung - Die Exposition war signifikant geringer (1/9) im Vergleich zur Placebogruppe (9/10) [p = 0,001] Das eine mit CIPRO behandelte Tier, das an Anthrax starb, starb nach der 30-tägigen Verabreichung des Arzneimittels.7
Mehr als 9300 Personen wurde empfohlen, im Jahr 2001 eine mindestens 60-tägige antibakterielle Prophylaxe gegen eine mögliche inhalative Exposition gegenüber B. anthracis abzuschließen. Den meisten dieser Personen wurde CIPRO 250 mg für die gesamte oder einen Teil des Prophylaxeschemas empfohlen. Einige Personen erhielten auch eine Anthrax-Impfung oder wurden auf alternative antibakterielle Medikamente umgestellt. Niemand, der CIPRO 1000 mg oder andere Therapien als prophylaktische Behandlung erhielt, entwickelte anschließend Lungenmilzbrand. Die Anzahl der Personen, die CIPRO als Gesamtheit oder als Teil ihres Postexpositionsprophylaxe-Regimes erhielten, ist nicht bekannt.
Pest
Es wurde eine placebokontrollierte Tierstudie an afrikanischen grünen Meerkatzen durchgeführt, die einer inhalierten mittleren Dosis von 110 LD50 (Bereich 92 bis 127 LD50) von Yersinia pestis (Stamm CO92) ausgesetzt waren. Die minimale Hemmkonzentration (MIC) von Ciprofloxacin für den in dieser Studie verwendeten Y. pestis-Stamm betrug 0,015 µg/ml. Die mittleren maximalen Serumkonzentrationen von Ciprofloxacin, die am Ende einer einzelnen 60-minütigen Infusion erreicht wurden, waren 3,49 ± 0,55 µg/ml, 3,91 µg/ml ± 0,58 µg/ml und 4,03 µg/ml ± 1,22 µg/ml an Tag 2, Tag 6 bzw. Tag 10 der Behandlung bei Grünen Meerkatzen Alle Talkonzentrationen (Tag 2, Tag 6 und Tag 10) waren
Tiertoxikologie und/oder Pharmakologie
Es wurde gezeigt, dass Cipro 250 mg Floxacin und andere Chinolone bei unreifen Tieren der meisten getesteten Arten Arthropathie verursachen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Bei juvenilen Hunden und Ratten wurde eine Schädigung der gewichtstragenden Gelenke beobachtet. Bei jungen Beagles verursachte 100 mg/kg Ciprofloxacin, täglich über 4 Wochen verabreicht, degenerative Gelenkveränderungen des Kniegelenks. Bei 30 mg/kg war die Wirkung auf das Gelenk minimal. In einer anschließenden Studie an jungen Beagle-Hunden verursachten orale Dosen von 750 mg Floxacin Cipro von 30 mg/kg und 90 mg/kg Cipro 750 mg Floxacin (etwa das 1,3-Fache und das 3,5-Fache der pädiatrischen Dosis, basierend auf vergleichbaren Plasma-AUCs), die täglich über 2 Wochen verabreicht wurden, Gelenkschäden Veränderungen, die nach einer behandlungsfreien Zeit von 5 Monaten noch histopathologisch beobachtet wurden. Bei 10 mg/kg (etwa das 0,6-fache der pädiatrischen Dosis, basierend auf vergleichbaren Plasma-AUCs) wurden keine Auswirkungen auf die Gelenke beobachtet. Diese Dosis war auch nach einem zusätzlichen behandlungsfreien Zeitraum von 5 Monaten nicht mit Arthrotoxizität verbunden. In einer anderen Studie verringerte die Entlastung des Gelenks die Läsionen, verhinderte sie jedoch nicht vollständig.
Kristallurie, manchmal verbunden mit sekundärer Nephropathie, tritt bei Labortieren auf, denen Ciprofloxacin verabreicht wurde. Dies hängt vor allem mit der verminderten Löslichkeit von Ciprofloxacin unter alkalischen Bedingungen zusammen, die im Urin von Versuchstieren vorherrschen; beim Menschen ist Kristallurie selten, da menschlicher Urin typischerweise sauer ist. Bei Rhesusaffen wurde nach oralen Einzeldosen von nur 5 mg/kg Kristallurie ohne Nephropathie festgestellt. (etwa das 0,07-fache der höchsten empfohlenen therapeutischen Dosis, basierend auf der Körperoberfläche). Nach 6 Monaten intravenöser Gabe von 10 mg/kg/Tag wurden keine nephropathologischen Veränderungen festgestellt; Nephropathie wurde jedoch nach einer Dosierung von 20 mg/kg/Tag über die gleiche Dauer (etwa das 0,2-fache der höchsten empfohlenen therapeutischen Dosis, basierend auf der Körperoberfläche) beobachtet.
Bei Hunden erzeugt Ciprofloxacin bei 3 mg/kg und 10 mg/kg durch schnelle intravenöse Injektion (15 Sek.) ausgeprägte blutdrucksenkende Wirkungen. Es wird angenommen, dass diese Wirkungen mit der Histaminfreisetzung zusammenhängen, da sie teilweise durch Pyrilamin, ein Antihistaminikum, antagonisiert werden. Bei Rhesusaffen führt eine schnelle intravenöse Injektion ebenfalls zu Hypotonie, aber die Wirkung bei dieser Spezies ist inkonsistent und weniger ausgeprägt.
Bei Mäusen wurde berichtet, dass die gleichzeitige Verabreichung von nichtsteroidalen entzündungshemmenden Arzneimitteln wie Phenylbutazon und Indomethacin mit Chinolonen die ZNS-stimulierende Wirkung von Chinolonen verstärkt.
Bei einigen verwandten Arzneimitteln wurde bei mit Ciprofloxacin behandelten Tieren keine okuläre Toxizität beobachtet
VERWEISE
1. 21 CFR 314.510 (Unterabschnitt H – beschleunigte Zulassung neuer Arzneimittel für lebensbedrohliche Krankheiten).
5. Bericht, der auf der Sitzung des Beratungsausschusses der FDA für Antiinfektiva und dermatologische Arzneimittelprodukte am 31. März 1993 in Silver Spring, MD, vorgelegt wurde. Bericht erhältlich bei FDA, CDER, Advisors and Consultants Staff, HFD-21, 1901 Chapman Avenue, Room 200, Rockville, MD 20852, USA.
6. Kelly DJ, et al. Serumkonzentrationen von Penicillin, Doxycyclin und Ciprofloxacin während längerer Therapie bei Rhesusaffen. J Infect Dis 1992; 166:1184-7.
7. Friedlander AM, et al. Postexpositionsprophylaxe gegen experimentellen Lungenmilzbrand. J Infect Dis 1993; 167:1239-42.
8. Sitzung des Beratungsausschusses für Antiinfektiva, 3. April 2012 – Die Wirksamkeit von Ciprofloxacin zur Behandlung der Lungenpest.
INFORMATIONEN ZUM PATIENTEN
CIPRO® (Sip-row) (Ciprofloxacinhydrochlorid) Tabletten zum Einnehmen
CIPRO® (Sip-Reihe) (Cipro 1000mgfloxacin) zur Herstellung einer Suspension zum Einnehmen
Lesen Sie diesen Arzneimittelleitfaden, bevor Sie mit der Einnahme von CIPRO 500 mg beginnen und jedes Mal, wenn Sie eine Nachfüllung erhalten. Möglicherweise gibt es neue Informationen. Diese Informationen ersetzen nicht das Gespräch mit Ihrem Gesundheitsdienstleister über Ihren Gesundheitszustand oder Ihre Behandlung.
Was sind die wichtigsten Informationen, die ich über CIPRO 500 mg wissen sollte?
CIPRO, ein antibakterielles Fluorchinolon-Arzneimittel, kann schwerwiegende Nebenwirkungen verursachen. Einige dieser schwerwiegenden Nebenwirkungen können gleichzeitig auftreten und zum Tod führen.
Wenn bei Ihnen während der Einnahme von CIPRO eine der folgenden schwerwiegenden Nebenwirkungen auftritt, sollten Sie die Einnahme von CIPRO 750 mg sofort abbrechen und unverzüglich medizinische Hilfe in Anspruch nehmen.
1. Sehnenriss oder Sehnenschwellung (Tendinitis).
Die Sehnenprobleme können dauerhaft sein.
2. Gefühlsveränderungen und mögliche Nervenschäden (periphere Neuropathie). Bei Menschen, die Fluorchinolone, einschließlich CIPRO, einnehmen, können Nervenschäden in Armen, Händen, Beinen oder Füßen auftreten. Brechen Sie die Einnahme von CIPRO 750 mg sofort ab und sprechen Sie sofort mit Ihrem Arzt, wenn Sie eines der folgenden Symptome einer peripheren Neuropathie in Ihren Armen, Händen, Beinen oder Füßen bemerken:
CIPRO 500 mg muss möglicherweise abgesetzt werden, um dauerhafte Nervenschäden zu vermeiden.
3. Auswirkungen auf das zentrale Nervensystem (ZNS). Psychische Gesundheitsprobleme und Krampfanfälle wurden bei Patienten berichtet, die antibakterielle Fluorchinolon-Arzneimittel, einschließlich CIPRO, einnahmen. Informieren Sie Ihren Arzt, wenn Sie in der Vergangenheit Krampfanfälle hatten, bevor Sie mit der Einnahme von CIPRO beginnen. ZNS-Nebenwirkungen können bereits nach Einnahme der ersten Dosis von CIPRO auftreten. Brechen Sie die Einnahme von CIPRO sofort ab und sprechen Sie sofort mit Ihrem Arzt, wenn Sie eine dieser Nebenwirkungen oder andere Stimmungs- oder Verhaltensänderungen bemerken:
Diese Änderungen können dauerhaft sein.
4. Verschlechterung der Myasthenia gravis (ein Problem, das Muskelschwäche verursacht). Fluorchinolone wie CIPRO 500 mg können eine Verschlechterung der Symptome der Myasthenia gravis verursachen, einschließlich Muskelschwäche und Atemproblemen. Informieren Sie Ihren Arzt, wenn Sie an Myasthenia gravis gelitten haben, bevor Sie mit der Einnahme von CIPRO beginnen. Rufen Sie sofort Ihren Arzt an, wenn Sie Muskelschwäche oder Atemprobleme verschlechtern.
Was ist CIPRO 750 mg?
CIPRO ist ein antibakterielles Fluorchinolon-Arzneimittel, das bei Erwachsenen ab 18 Jahren zur Behandlung bestimmter Infektionen angewendet wird, die durch bestimmte Keime, sogenannte Bakterien, verursacht werden. Zu diesen bakteriellen Infektionen gehören:
Wer sollte CIPRO 1000 mg nicht einnehmen?
Nehmen Sie CIPRO 500 mg nicht ein, wenn Sie:
Was sollte ich meinem Arzt vor der Einnahme von CIPRO mitteilen?
Bevor Sie CIPRO einnehmen, informieren Sie Ihren Arzt über alle Ihre Erkrankungen, auch wenn Sie:
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger und rezeptfreier Arzneimittel, Vitamine und Kräuterergänzungen.
Fragen Sie Ihren Arzt nach einer Liste dieser Arzneimittel, wenn Sie sich nicht sicher sind.
Informieren Sie sich über die Medikamente, die Sie einnehmen. Führen Sie eine Liste davon, um sie Ihrem Arzt und Apotheker zu zeigen, wenn Sie ein neues Arzneimittel erhalten.
Wie sollte ich CIPRO 500 mg einnehmen?
Die Einnahme aller Ihrer CIPRO-Dosen trägt dazu bei, dass alle Bakterien abgetötet werden. Die Einnahme aller Ihrer CIPRO-Dosen trägt dazu bei, die Wahrscheinlichkeit zu verringern, dass die Bakterien gegen CIPRO resistent werden. Wenn Sie gegen CIPRO resistent werden, wirken CIPRO 1000 mg und andere antibakterielle Arzneimittel in Zukunft möglicherweise nicht mehr bei Ihnen.
Wenn Sie zu viel CIPRO 750 mg eingenommen haben, wenden Sie sich an Ihren Arzt oder suchen Sie sofort medizinische Hilfe auf.
CIPRO wird als Tablette mit Bruchrille (CIPRO 1000 mg Tabletten), Suspension zum Einnehmen (CIPRO 750 mg Suspension zum Einnehmen), Retardtablette (CIPRO XR) und Injektion zur intravenösen Infusion (CIPRO IV) geliefert. Lesen und befolgen Sie die nachstehenden Anweisungen für die Art von CIPRO 500 mg, die Ihr Arzt Ihnen verschrieben hat.
CIPRO-Tabletten:
CIPRO-Suspension zum Einnehmen:
Was sollte ich während der Einnahme von CIPRO vermeiden?
Welche Nebenwirkungen kann CIPRO haben?
CIPRO kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Hautausschlag kann bei Personen, die CIPRO 1000 mg einnehmen, auch nach nur 1 Dosis auftreten. Beenden Sie die Einnahme von CIPRO 500 mg beim ersten Anzeichen eines Hautausschlags und wenden Sie sich an Ihren Arzt. Hautausschlag kann ein Zeichen für eine schwerwiegendere Reaktion auf CIPRO sein.
Brechen Sie die Einnahme von CIPRO 750 mg ab und informieren Sie sofort Ihren Arzt, wenn Sie eine Gelbfärbung Ihrer Haut oder Ihrer weißen Augenpartie haben oder wenn Sie dunklen Urin haben. Dies können Anzeichen einer schwerwiegenden Reaktion auf CIPRO (ein Leberproblem) sein.
Zu den häufigsten Nebenwirkungen von CIPRO 750 mg gehören:
Informieren Sie Ihren Arzt über jede Nebenwirkung, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von CIPRO. Weitere Informationen erhalten Sie von Ihrem Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Wie ist CIPRO aufzubewahren?
CIPRO 500 mg Tabletten
CIPRO 750 mg Suspension zum Einnehmen
Bewahren Sie CIPRO 250 mg und alle Arzneimittel außerhalb der Reichweite von Kindern auf.
Allgemeine Informationen zur sicheren und wirksamen Anwendung von CIPRO.
Medikamente werden manchmal für andere als die in einem Medikationsleitfaden aufgeführten Zwecke verschrieben. Verwenden Sie CIPRO nicht für einen Zustand, für den es nicht verschrieben ist. Geben Sie CIPRO nicht an andere Personen weiter, selbst wenn sie die gleichen Symptome wie Sie haben. Es kann ihnen schaden.
Dieser Medikationsratgeber fasst die wichtigsten Informationen zu CIPRO zusammen. Wenn Sie weitere Informationen über CIPRO wünschen, wenden Sie sich an Ihren Arzt. Sie können Ihren Arzt oder Apotheker nach Informationen über CIPRO 250 mg fragen, die für Angehörige der Gesundheitsberufe bestimmt sind.
Welche Inhaltsstoffe enthält CIPRO 500 mg?
CIPRO 1000 mg Tabletten:
CIPRO-Suspension zum Einnehmen:
Dieser Medikationsleitfaden wurde von der US Food and Drug Administration genehmigt.