Keflex 250mg, 500mg Cephalexin Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Keflex 250 mg und wie wird es angewendet?
Keflex ist ein verschreibungspflichtiges Arzneimittel, das zur Behandlung der Symptome verschiedener bakterieller Infektionen angewendet wird, indem das Bakterienwachstum gestoppt wird. Keflex 500 mg kann allein oder mit anderen Medikamenten verwendet werden.
Keflex ist als Cephalosporin-Antibiotikum bekannt.
Welche Nebenwirkungen hat Keflex?
Keflex kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Die häufigsten Nebenwirkungen von Keflex 500 mg sind:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Keflex. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
KEFLEX® (Cephalexin) Capsules, USP ist ein halbsynthetisches Cephalosporin-Antibiotikum, das zur oralen Verabreichung bestimmt ist. Es ist 7-(D-α-Amino-α-phenylacetamido)-3-methyl-3-cephem-4-carbonsäuremonohydrat. Cephalexin hat die Summenformel C16H17N3O4S•H2O und das Molekulargewicht beträgt 365,41.
Cephalexin hat die folgende Strukturformel:
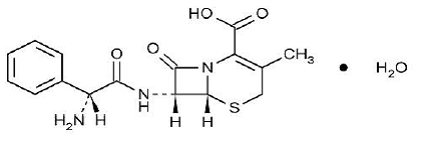
Jede Kapsel enthält Cephalexin-Monohydrat entsprechend 250 mg, 500 mg oder 750 mg Cephalexin. Die Kapseln enthalten auch Natriumcarboxymethylcellulose, D&C-Gelb Nr. 10, Dimethicon, FD&C-Blau Nr. 1, FD&C-Gelb Nr. 6, Gelatine, Magnesiumstearat, mikrokristalline Cellulose und Titandioxid.
INDIKATIONEN
Infektionen der Atemwege
KEFLEX ist angezeigt zur Behandlung von Infektionen der Atemwege, die durch empfindliche Isolate von Streptococcus pneumoniae und Streptococcus pyogenes verursacht werden.
Mittelohrentzündung
KEFLEX ist indiziert zur Behandlung von Mittelohrentzündungen, die durch empfindliche Isolate von Streptococcus pneumoniae, Haemophilus influenzae, Staphylococcus aureus, Streptococcus pyogenes und Moraxella catarrhalis verursacht werden.
Haut- und Hautstrukturinfektionen
KEFLEX 250 mg ist angezeigt zur Behandlung von Haut- und Hautstrukturinfektionen, die durch empfindliche Isolate der folgenden grampositiven Bakterien verursacht werden: Staphylococcus aureus und Streptococcus pyogenes.
Knocheninfektionen
KEFLEX 250 mg ist angezeigt zur Behandlung von Knocheninfektionen, die durch empfindliche Isolate von Staphylococcus aureus und Proteus mirabilis verursacht werden.
Urogenitaltrakt-Infektionen
KEFLEX ist angezeigt zur Behandlung von Infektionen des Urogenitaltrakts, einschließlich akuter Prostatitis, die durch empfindliche Isolate von Escherichia coli, Proteus mirabilis und Klebsiella pneumoniae verursacht werden.
Verwendungszweck
Um die Entwicklung arzneimittelresistenter Bakterien zu verringern und die Wirksamkeit von KEFLEX 250 mg und anderen antibakteriellen Arzneimitteln aufrechtzuerhalten, sollte KEFLEX 500 mg nur zur Behandlung von Infektionen verwendet werden, die nachweislich oder mit starkem Verdacht auf empfindliche Bakterien zurückzuführen sind. Wenn Kultur- und Empfindlichkeitsinformationen verfügbar sind, sollten diese Informationen bei der Auswahl oder Änderung der antibakteriellen Therapie berücksichtigt werden. In Ermangelung solcher Daten können lokale Epidemiologie und Anfälligkeitsmuster zur empirischen Auswahl der Therapie beitragen.
DOSIERUNG UND ANWENDUNG
Erwachsene und pädiatrische Patienten im Alter von mindestens 15 Jahren
Die übliche orale Dosis von KEFLEX 250 mg beträgt 250 mg alle 6 Stunden, es kann jedoch eine Dosis von 500 mg alle 12 Stunden verabreicht werden. Die Behandlung wird für 7 bis 14 Tage durchgeführt.
Bei schwereren Infektionen können größere Dosen von oralem KEFLEX erforderlich sein, bis zu 4 Gramm täglich in zwei bis vier gleich verteilten Dosen.
Pädiatrische Patienten (über 1 Jahr alt)
Die empfohlene tägliche Gesamtdosis von oralem KEFLEX 500 mg für pädiatrische Patienten beträgt 25 bis 50 mg/kg, verabreicht in gleichmäßig verteilten Dosen über 7 bis 14 Tage. Bei der Behandlung von Infektionen mit β-hämolytischen Streptokokken wird eine Behandlungsdauer von mindestens 10 Tagen empfohlen. Bei schweren Infektionen kann eine tägliche Gesamtdosis von 50 bis 100 mg/kg in gleichmäßig verteilten Dosen verabreicht werden.
Zur Behandlung der Mittelohrentzündung beträgt die empfohlene Tagesdosis 75 bis 100 mg/kg, verteilt auf gleiche Dosen.
Dosisanpassungen bei erwachsenen und pädiatrischen Patienten im Alter von mindestens 15 Jahren mit eingeschränkter Nierenfunktion
Wenden Sie die folgenden Dosierungsschemata für KEFLEX an Patienten mit eingeschränkter Nierenfunktion an [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und Verwendung in bestimmten Populationen ].
WIE GELIEFERT
Darreichungsformen und Stärken
250-mg-Kapseln: ein weißes bis hellgelbes Pulver, das in eine undurchsichtige weiße und undurchsichtige dunkelgrüne Kapsel gefüllt ist, die mit KEFLEX 250 mg in essbarer schwarzer Tinte auf dem weißen Unterteil bedruckt ist.
500 mg Kapseln: ein weißes bis hellgelbes Pulver, das in eine undurchsichtige hellgrüne und undurchsichtige dunkelgrüne Kapsel gefüllt ist, die mit KEFLEX 500 mg in essbarer schwarzer Tinte auf dem hellgrünen Unterteil bedruckt ist.
750-mg-Kapseln: ein weißes bis hellgelbes Pulver, das in eine längliche undurchsichtige dunkelgrüne und undurchsichtige dunkelgrüne Kapsel gefüllt ist, auf deren dunkelgrünem Unterteil KEFLEX 750 mg in essbarer weißer Tinte aufgedruckt ist.
Lagerung und Handhabung
KEFLEX (Cephalexin) Kapseln , USP, wird wie folgt geliefert:
250 mg Kapseln, Flaschen zu 100 – NDC 59630-112-10 500 mg Kapseln, Flaschen zu 100 – NDC 59630-113-10 750 mg Kapseln, Flaschen zu 50 – NDC 59630-115-05
KEFLEX sollte bei 25°C (77°F) gelagert werden; Exkursionen erlaubt bis 15° bis 30°C (59° bis 86°F) [siehe USP kontrollierte Raumtemperatur ].
In einen dichten, lichtbeständigen Behälter füllen.
Hergestellt für: Shionogi Inc. Florham Park, NJ 07932. Hergestellt von: Sandoz GmbH Kundl, Österreich. Überarbeitet: Okt. 2015.
NEBENWIRKUNGEN
Die folgenden schwerwiegenden Ereignisse werden im Abschnitt „Warnhinweise und Vorsichtsmaßnahmen“ ausführlicher beschrieben:
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider
In klinischen Studien war die häufigste Nebenwirkung Durchfall. Übelkeit und Erbrechen, Dyspepsie, Gastritis und Bauchschmerzen sind ebenfalls aufgetreten. Wie bei Penicillinen und anderen Cephalosporinen wurde über vorübergehende Hepatitis und cholestatische Gelbsucht berichtet.
Andere Reaktionen waren Überempfindlichkeitsreaktionen, genitaler und analer Pruritus, genitale Candidiasis, Vaginitis und vaginaler Ausfluss, Schwindel, Müdigkeit, Kopfschmerzen, Unruhe, Verwirrtheit, Halluzinationen, Arthralgie, Arthritis und Gelenkerkrankungen. Es wurde über reversible interstitielle Nephritis berichtet. Eosinophilie, Neutropenie, Thrombozytopenie, hämolytische Anämie und leichte Erhöhungen der Aspartat-Transaminase (AST) und Alanin-Transaminase (ALT) wurden berichtet.
Zusätzlich zu den oben aufgeführten Nebenwirkungen, die bei Patienten beobachtet wurden, die mit KEFLEX 500 mg behandelt wurden, wurden die folgenden Nebenwirkungen und andere veränderte Labortests für antibakterielle Arzneimittel der Cephalosporin-Klasse berichtet:
Andere Nebenwirkungen
Fieber, Colitis, aplastische Anämie, Blutungen, Nierenfunktionsstörungen und toxische Nephropathie.
Veränderte Labortests
Verlängerte Prothrombinzeit, erhöhter Blut-Harnstoff-Stickstoff (BUN), erhöhtes Kreatinin, erhöhte alkalische Phosphatase, erhöhtes Bilirubin, erhöhte Laktatdehydrogenase (LDH), Panzytopenie, Leukopenie und Agranulozytose.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Metformin
Die Verabreichung von KEFLEX 250 mg zusammen mit Metformin führt zu erhöhten Plasmakonzentrationen von Metformin und einer verringerten renalen Clearance von Metformin.
Eine sorgfältige Patientenüberwachung und Dosisanpassung von Metformin wird bei Patienten empfohlen, die gleichzeitig KEFLEX und Metformin einnehmen [siehe KLINISCHE PHARMAKOLOGIE ].
Probenecid
Die renale Ausscheidung von KEFLEX wird durch Probenecid gehemmt. Die gleichzeitige Anwendung von Probenecid mit KEFLEX 500 mg wird nicht empfohlen.
Wechselwirkung mit Labor- oder Diagnosetests
Beim Nachweis von Glukose im Urin mit Benedikt-Lösung oder Fehling-Lösung kann es zu einer falsch-positiven Reaktion kommen.
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Überempfindlichkeitsreaktionen
Bei der Anwendung von KEFLEX wurde über allergische Reaktionen in Form von Hautausschlag, Urtikaria, Angioödem, Anaphylaxie, Erythema multiforme, Stevens-Johnson-Syndrom oder toxischer epidermaler Nekrolyse berichtet. Bevor eine Therapie mit KEFLEX 500 mg eingeleitet wird, erkundigen Sie sich, ob der Patient in der Vorgeschichte Überempfindlichkeitsreaktionen auf Cephalexin, Cephalosporine, Penicilline oder andere Arzneimittel hatte. Bei bis zu 10 % der Patienten mit Penicillin-Allergie in der Anamnese kann eine Kreuzallergie zwischen Beta-Lactam-Antibiotika auftreten.
Wenn eine allergische Reaktion auf KEFLEX 500 mg auftritt, setzen Sie das Medikament ab und leiten Sie eine geeignete Behandlung ein.
Clostridium difficile-assoziierter Durchfall
Clostridium difficile-assoziierte Diarrhoe (CDAD) wurde bei der Anwendung von fast allen antibakteriellen Mitteln, einschließlich KEFLEX 500 mg, berichtet und kann in ihrer Schwere von leichter Diarrhoe bis hin zu tödlicher Colitis reichen. Die Behandlung mit antibakteriellen Mitteln verändert die normale Flora des Dickdarms, was zu einem übermäßigen Wachstum von C. difficile führt.
C. difficile produziert die Toxine A und B, die zur Entstehung von CDAD beitragen. Hypertoxin-produzierende Stämme von C. difficile verursachen eine erhöhte Morbidität und Mortalität, da diese Infektionen gegenüber einer antimikrobiellen Therapie refraktär sein können und eine Kolektomie erfordern können. CDAD muss bei allen Patienten in Betracht gezogen werden, bei denen nach der Anwendung von Antibiotika Durchfall auftritt. Eine sorgfältige Anamnese ist erforderlich, da berichtet wurde, dass CDAD mehr als zwei Monate nach der Verabreichung von Antibiotika auftritt.
Wenn CDAD vermutet oder bestätigt wird, muss die laufende Anwendung von Antibiotika, die nicht gegen C. difficile gerichtet sind, möglicherweise eingestellt werden. Je nach klinischer Indikation sollte ein angemessenes Flüssigkeits- und Elektrolytmanagement, eine Proteinergänzung, eine antibiotische Behandlung von C. difficile und eine chirurgische Untersuchung eingeleitet werden.
Direkte Serokonversion im Coombs-Test
Positive direkte Coombs-Tests wurden während der Behandlung mit Cephalosporin-Antibiotika einschließlich Cephalexin berichtet. Akute intravaskuläre Hämolyse, die durch eine Cephalexin-Therapie induziert wurde, wurde berichtet. Wenn sich während oder nach der Cephalexin-Therapie eine Anämie entwickelt, führen Sie eine diagnostische Abklärung für eine arzneimittelinduzierte hämolytische Anämie durch, setzen Sie Cephalexin ab und leiten Sie eine geeignete Therapie ein.
Anfallspotential
Mehrere Cephalosporine wurden mit der Auslösung von Krampfanfällen in Verbindung gebracht, insbesondere bei Patienten mit eingeschränkter Nierenfunktion, wenn die Dosis nicht reduziert wurde. Wenn Krampfanfälle auftreten, KEFLEX absetzen. Bei klinischer Indikation kann eine antikonvulsive Therapie gegeben werden.
Verlängerte Prothrombinzeit
Cephalosporine können mit einer verlängerten Prothrombinzeit einhergehen. Zu den Risikogruppen gehören Patienten mit eingeschränkter Nieren- oder Leberfunktion oder schlechtem Ernährungszustand sowie Patienten, die eine langwierige antibakterielle Therapie erhalten, und Patienten, die eine Antikoagulanzientherapie erhalten. Überwachen Sie die Prothrombinzeit bei Risikopatienten und behandeln Sie sie wie angezeigt.
Entwicklung arzneimittelresistenter Bakterien
Die Verschreibung von KEFLEX ohne nachgewiesene oder dringend vermutete bakterielle Infektion bringt dem Patienten wahrscheinlich keinen Nutzen und erhöht das Risiko der Entwicklung arzneimittelresistenter Bakterien.
Eine längere Anwendung von KEFLEX kann zu einem übermäßigen Wachstum von nicht empfindlichen Organismen führen. Eine sorgfältige Beobachtung des Patienten ist unerlässlich. Wenn während der Therapie eine Superinfektion auftritt, sollten geeignete Maßnahmen ergriffen werden.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Es wurden keine Lebenszeitstudien an Tieren durchgeführt, um das karzinogene Potenzial von Cephalexin zu bewerten. Tests zur Bestimmung des mutagenen Potentials von Cephalexin wurden nicht durchgeführt. Bei männlichen und weiblichen Ratten wurden die Fertilität und Fortpflanzungsfähigkeit durch orale Cephalexin-Dosen bis zum 1,5-Fachen der höchsten empfohlenen Humandosis, basierend auf der Körperoberfläche, nicht beeinträchtigt.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Schwangerschaftskategorie B
Es liegen keine adäquaten und gut kontrollierten Studien bei Schwangeren vor. Da Reproduktionsstudien an Tieren die menschliche Reaktion nicht immer vorhersagen, sollte dieses Medikament während der Schwangerschaft nur angewendet werden, wenn dies eindeutig erforderlich ist.
Reproduktionsstudien wurden an Mäusen und Ratten mit oralen Dosen von Cephalexin-Monohydrat in Höhe des 0,6- und 1,5-Fachen der maximalen Tagesdosis für den Menschen (66 mg/kg/Tag) basierend auf der Körperoberfläche durchgeführt und ergaben keine Hinweise auf eine Beeinträchtigung der Fertilität oder eine Schädigung von Cephalexin-Monohydrat der Fötus.
Stillende Mutter
Cephalexin wird in die Muttermilch ausgeschieden. Vorsicht ist geboten, wenn KEFLEX einer stillenden Frau verabreicht wird.
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von KEFLEX 500 mg bei pädiatrischen Patienten wurde in klinischen Studien für die im Abschnitt „Dosierung und Verabreichung“ beschriebenen Dosierungen nachgewiesen [siehe DOSIERUNG UND ANWENDUNG ].
Geriatrische Verwendung
Von den 701 Probanden in 3 veröffentlichten klinischen Studien zu Cephalexin waren 433 (62 %) 65 Jahre und älter. Insgesamt wurden keine Unterschiede in der Sicherheit oder Wirksamkeit zwischen diesen Probanden und jüngeren Probanden beobachtet, und andere berichtete klinische Erfahrungen haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt.
Dieses Medikament wird im Wesentlichen über die Nieren ausgeschieden, und das Risiko toxischer Reaktionen auf dieses Medikament kann bei Patienten mit eingeschränkter Nierenfunktion größer sein. Da ältere Patienten eher eine eingeschränkte Nierenfunktion haben, sollte bei der Dosisauswahl sorgfältig vorgegangen werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Nierenfunktionsstörung
KEFLEX sollte bei eingeschränkter Nierenfunktion (Kreatinin-Clearance DOSIERUNG UND ANWENDUNG ].
VERWEISE
1. Clinical and Laboratory Standards Institute (CLSI). Methoden zur Verdünnung Antimikrobielle Empfindlichkeitstests für Bakterien, die aerob wachsen; Genehmigter Standard - Zehnte Ausgabe. CLSI-Dokument M07-A10, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2015.
2. Institut für klinische und Laborstandards (CLSI). Leistungsstandards für Antibiotika-Empfindlichkeitstests; Fünfundzwanzigste Informationsbeilage. CLSI-Dokument M100-S25, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2015.
3. Clinical and Laboratory Standards Institute (CLSI). Leistungsstandards für antimikrobielle Disk-Empfindlichkeitstests; Genehmigter Standard - Zwölfte Ausgabe. CLSI-Dokument M02-A12, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2015.
ÜBERDOSIS
Zu den Symptomen einer oralen Überdosierung können Übelkeit, Erbrechen, epigastrische Beschwerden, Durchfall und Hämaturie gehören. Im Falle einer Überdosierung allgemeine unterstützende Maßnahmen einleiten.
Forcierte Diurese, Peritonealdialyse, Hämodialyse oder Aktivkohle-Hämoperfusion haben sich nicht als vorteilhaft für eine Überdosierung von Cephalexin erwiesen.
KONTRAINDIKATIONEN
KEFLEX ist kontraindiziert bei Patienten mit bekannter Überempfindlichkeit gegen Cephalexin oder andere Antibiotika der Klasse der Cephalosporine.
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Cephalexin ist ein Cephalosporin-Antibiotikum [siehe Mikrobiologie ].
Pharmakokinetik
Absorption
Cephalexin ist säurestabil und kann unabhängig von den Mahlzeiten verabreicht werden. Nach Dosen von 250 mg, 500 mg und 1 g wurden nach 1 Stunde durchschnittliche maximale Serumspiegel von etwa 9, 18 bzw. 32 µg/ml erreicht. Serumspiegel waren 6 Stunden nach der Verabreichung nachweisbar (bei einem Nachweisspiegel von 0,2 µg/ml).
Verteilung
Cephalexin ist zu etwa 10 % bis 15 % an Plasmaproteine gebunden.
Ausscheidung
Cephalexin wird durch glomeruläre Filtration und tubuläre Sekretion mit dem Urin ausgeschieden. Studien zeigten, dass über 90 % des Arzneimittels innerhalb von 8 Stunden unverändert im Urin ausgeschieden wurden. Während dieses Zeitraums betrugen die Spitzenkonzentrationen im Urin nach den Dosen von 250 mg, 500 mg und 1 g etwa 1000, 2200 bzw. 5000 µg/ml.
Wechselwirkungen mit anderen Medikamenten
Bei gesunden Probanden, die Einzeldosen von 500 mg Cephalexin und Metformin erhielten, erhöhten sich die mittlere Cmax und AUC von Metformin im Plasma um durchschnittlich 34 % bzw. 24 %, und die mittlere renale Clearance von Metformin verringerte sich um 14 %. Es liegen keine Informationen über die Wechselwirkung von Cephalexin und Metformin nach mehrfacher Gabe beider Arzneimittel vor.
Mikrobiologie
Wirkmechanismus
Cephalexin ist ein bakterizides Mittel, das durch Hemmung der bakteriellen Zellwandsynthese wirkt.
Widerstand
Methicillin-resistente Staphylokokken und die meisten Enterokokken-Isolate sind gegen Cephalexin resistent. Cephalexin ist gegen die meisten Isolate von Enterobacter spp., Morganella morganii und Proteus vulgaris nicht aktiv. Cephalexin hat keine Aktivität gegen Pseudomonas spp. oder Acinetobacter calcoaceticus. Penicillin-resistenter Streptococcus pneumoniae ist normalerweise kreuzresistent gegen Beta-Lactam-Antibiotika.
Antimikrobielle Aktivität
Es wurde gezeigt, dass Cephalexin sowohl in vitro als auch bei klinischen Infektionen gegen die meisten Isolate der folgenden Bakterien aktiv ist [vgl INDIKATIONEN UND VERWENDUNG ].
Grampositive Bakterien
Staphylococcus aureus (nur Methicillin-empfindliche Isolate) Streptococcus pneumoniae (Penicillin-empfindliche Isolate) Streptococcus pyogenes
Gramnegative Bakterien
Escherichia coli Haemophilus influenzae Klebsiella pneumoniae Moraxella catarrhalis Proteus mirabilis
Methoden für Empfindlichkeitstests
Sofern verfügbar, sollte das klinisch-mikrobiologische Labor die Ergebnisse von In-vitro-Empfindlichkeitstests für antimikrobielle Arzneimittel, die in niedergelassenen Krankenhäusern verwendet werden, dem Arzt als regelmäßige Berichte zur Verfügung stellen, die das Empfindlichkeitsprofil von nosokomialen und ambulant erworbenen Krankheitserregern beschreiben. Diese Berichte sollen dem Arzt bei der Auswahl eines antibakteriellen Arzneimittels für die Behandlung helfen.
Nur in Fällen einer unkomplizierten Harnwegsinfektion kann die Empfindlichkeit von E. coli, K. pneumoniae und P. mirabilis gegenüber Cephalexin durch Testen auf Cefazolin2 abgeleitet werden.
Verdünnungstechniken
Quantitative Methoden werden verwendet, um antimikrobielle minimale Hemmkonzentrationen (MICs) zu bestimmen. Diese MICs liefern Schätzungen der Empfindlichkeit von Bakterien gegenüber antimikrobiellen Verbindungen. Die MICs sollten mit standardisierten Testmethoden (Brühe oder Agar) bestimmt werden1,2.
Diffusionstechniken
Quantitative Methoden, die die Messung von Zonendurchmessern erfordern, liefern auch reproduzierbare Schätzungen der Empfindlichkeit von Bakterien gegenüber antimikrobiellen Verbindungen. Die Zonengröße liefert eine Schätzung der Empfindlichkeit von Bakterien gegenüber antimikrobiellen Verbindungen. Die Zonengröße sollte mit einem standardisierten Testverfahren bestimmt werden2,3.
Ein Bericht über empfindlich (S) weist darauf hin, dass das antimikrobielle Medikament wahrscheinlich das Wachstum des Pathogens hemmt, wenn das antimikrobielle Medikament die Konzentration erreicht, die normalerweise an der Infektionsstelle erreichbar ist. Ein Bericht von Intermediat (I) weist darauf hin, dass das Ergebnis als zweideutig betrachtet werden sollte und der Test wiederholt werden sollte, wenn der Mikroorganismus nicht vollständig empfindlich gegenüber alternativen klinisch geeigneten Arzneimitteln ist. Diese Kategorie impliziert eine mögliche klinische Anwendbarkeit an Körperstellen, an denen das Arzneimittel physiologisch konzentriert ist, oder in Situationen, in denen eine hohe Dosierung des Arzneimittels verwendet werden kann. Diese Kategorie bietet auch eine Pufferzone, die verhindert, dass kleine unkontrollierte technische Faktoren größere Diskrepanzen bei der Interpretation verursachen. Ein Bericht über resistent (R) weist darauf hin, dass das antimikrobielle Medikament das Wachstum des Pathogens wahrscheinlich nicht hemmt, wenn das antimikrobielle Medikament die Konzentrationen erreicht, die normalerweise an der Infektionsstelle erreichbar sind; andere Therapie gewählt werden.
Qualitätskontrolle
Standardisierte Empfindlichkeitstestverfahren erfordern die Verwendung von Laborkontrollen, um die Genauigkeit und Präzision der im Assay verwendeten Materialien und Reagenzien sowie die Techniken der Person, die den Test durchführt, zu überwachen und sicherzustellen1,2,3.