Levaquin 250mg, 500mg, 750mg Levofloxacin Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Levaquin 750 mg und wie wird es angewendet?
Levaquin ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome verschiedener bakterieller Infektionen. Levaquin kann allein oder mit anderen Medikamenten verwendet werden.
Levaquin 500 mg gehört zu einer Klasse von Medikamenten namens Fluorchinolone.
Es ist nicht bekannt, ob Levaquin bei einer Behandlungsdauer von mehr als 14 Tagen bei Kindern sicher und wirksam ist.
Welche Nebenwirkungen kann Levaquin 500 mg haben?
Levaquin 750 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Levaquin 250 mg gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Levaquin. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
WARNUNG
SCHWERWIEGENDE NEBENWIRKUNGEN EINSCHLIESSLICH SEHNENENTZÜNDUNG, SEHNENRUPTION, PERIPHERE NEUROPATHIE, AUSWIRKUNGEN AUF DAS ZENTRALE NERVENSYSTEM UND EXAKRBATION VON MYASTHENIA GRAVIS
Setzen Sie LEVAQUIN® sofort ab und vermeiden Sie die Anwendung von Fluorchinolonen, einschließlich LEVAQUIN®, bei Patienten, bei denen eine dieser schwerwiegenden Nebenwirkungen auftritt [siehe WARNHINWEISE UND VORSICHTSMASSNAHMEN].
BEZEICHNUNG
LEVAQUIN® Tabletten sind synthetische antibakterielle Wirkstoffe zur oralen Verabreichung. Chemisch gesehen ist Levofloxacin, ein chirales fluoriertes Carboxychinolon, das reine (-)-(S)-Enantiomer des racemischen Wirkstoffs Ofloxacin. Der chemische Name ist (-)-(S)-9-Fluor-2,3-dihydro-3-methyl-10-(4-methyl-1-piperazinyl)-7-oxo-7H-pyrido[1,2, 3-de]-1,4-Benzoxazin-6-Carbonsäure-Hemihydrat.
Abbildung 1: Die chemische Struktur von Levofloxacin
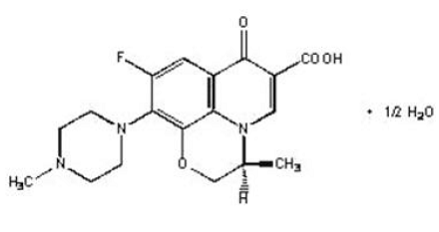
Die empirische Formel lautet C18H20FN3O4 · ½ H2O und das Molekulargewicht beträgt 370,38. Levofloxacin ist ein hellgelblich-weißer bis gelb-weißer Kristall oder ein kristallines Pulver. Das Molekül liegt bei den pH-Bedingungen im Dünndarm als Zwitterion vor.
Die Daten zeigen, dass die Löslichkeit von Levofloxacin von pH 0,6 bis 5,8 im Wesentlichen konstant ist (ungefähr 100 mg/ml). Levofloxacin wird in diesem pH-Bereich gemäß USP-Nomenklatur als löslich bis frei löslich angesehen. Oberhalb von pH 5,8 steigt die Löslichkeit schnell auf ihr Maximum bei pH 6,7 (272 mg/ml) an und gilt in diesem Bereich als frei löslich. Oberhalb von pH 6,7 nimmt die Löslichkeit ab und erreicht bei einem pH-Wert von etwa 6,9 einen Minimalwert (ca. 50 mg/mL).
Levofloxacin hat das Potenzial, mit vielen Metallionen stabile Koordinationsverbindungen zu bilden. Dieses in-vitro-Chelationspotential hat die folgende Bildungsreihenfolge: Al+3>Cu+2>Zn+2>Mg+2>Ca+2.
LEVAQUIN® Tabletten sind als Filmtabletten erhältlich und enthalten folgende Hilfsstoffe:
INDIKATIONEN
Nosokomiale Pneumonie
LEVAQUIN® ist indiziert bei erwachsenen Patienten zur Behandlung von nosokomialer Pneumonie aufgrund von Methicillin-empfindlichen Staphylococcus aureus, Pseudomonas aeruginosa, Serratia marcescens, Escherichia coli, Klebsiella pneumoniae, Haemophilus influenzae oder Streptococcus pneumoniae. Eine Begleittherapie sollte nach klinischer Indikation erfolgen. Wenn Pseudomonas aeruginosa ein dokumentierter oder mutmaßlicher Erreger ist, wird eine Kombinationstherapie mit einem Anti-Pseudomonas-β-Lactam empfohlen [siehe Klinische Studien ].
Ambulant erworbene Pneumonie
7- bis 14-tägiges Behandlungsschema
LEVAQUIN® ist indiziert bei erwachsenen Patienten zur Behandlung von ambulant erworbener Pneumonie aufgrund von Methicillin-empfindlichem Staphylococcus aureus, Streptococcus pneumoniae (einschließlich multiresistentem Streptococcus pneumoniae [MDRSP]), Haemophilus influenzae, Haemophilus parainfluenzae, Klebsiella pneumoniae, Moraxella catarrhalis B. Chlamydophila pneumoniae, Legionella pneumophila oder Mycoplasma pneumoniae [vgl DOSIERUNG UND ANWENDUNG und Klinische Studien ].
MDRSP-Isolate sind Isolate, die gegen zwei oder mehr der folgenden Antibiotika resistent sind: Penicillin (MHK ≥ 2 µg/ml), Cephalosporine der 2. Generation, z. B. Cefuroxim, Makrolide, Tetracycline und Trimethoprim/Sulfamethoxazol.
Ambulant erworbene Pneumonie
5-tägiges Behandlungsschema
LEVAQUIN® ist indiziert bei erwachsenen Patienten zur Behandlung von ambulant erworbener Pneumonie aufgrund von Streptococcus pneumoniae (ausgenommen multiresistente Isolate [MDRSP]), Haemophilus influenzae, Haemophilus parainfluenzae, Mycoplasma pneumoniae oder Chlamydophila pneumoniae [siehe DOSIERUNG UND ANWENDUNG und Klinische Studien ].
Komplizierte Haut- und Hautstrukturinfektionen
LEVAQUIN® ist indiziert bei erwachsenen Patienten zur Behandlung komplizierter Haut- und Hautstrukturinfektionen aufgrund von Methicillin-empfindlichen Staphylococcus aureus, Enterococcus faecalis, Streptococcus pyogenes oder Proteus mirabilis [siehe Klinische Studien ].
Unkomplizierte Haut- und Hautstrukturinfektionen
LEVAQUIN® ist angezeigt bei erwachsenen Patienten zur Behandlung von unkomplizierten Haut- und Hautstrukturinfektionen (leicht bis mittelschwer) einschließlich Abszessen, Zellulitis, Furunkeln, Impetigo, Pyodermie, Wundinfektionen aufgrund von Methicillin-empfindlichen Staphylococcus aureus oder Streptococcus pyogenes.
Chronische bakterielle Prostatitis
LEVAQUIN® ist indiziert bei erwachsenen Patienten zur Behandlung von chronischer bakterieller Prostatitis aufgrund von Escherichia coli, Enterococcus faecalis oder Methicillin-empfindlichem Staphylococcus epidermidis [siehe Klinische Studien ].
Inhalativer Anthrax (Post-Exposition)
LEVAQUIN® ist indiziert für Inhalationsmilzbrand (nach Exposition), um das Auftreten oder Fortschreiten der Erkrankung nach Exposition gegenüber aerosolisiertem Bacillus anthracis bei Erwachsenen und pädiatrischen Patienten ab 6 Monaten zu reduzieren [siehe DOSIERUNG UND ANWENDUNG ]. Die Wirksamkeit von LEVAQUIN® basiert auf den beim Menschen erreichten Plasmakonzentrationen, einem Surrogat-Endpunkt, der mit ziemlicher Wahrscheinlichkeit den klinischen Nutzen vorhersagt.
LEVAQUIN® wurde am Menschen nicht zur Postexpositionsprävention von Inhalationsmilzbrand getestet. Die Sicherheit von LEVAQUIN® bei Erwachsenen für eine Behandlungsdauer von mehr als 28 Tagen oder bei pädiatrischen Patienten für eine Behandlungsdauer von mehr als 14 Tagen wurde nicht untersucht. Eine Langzeittherapie mit LEVAQUIN® sollte nur angewendet werden, wenn der Nutzen das Risiko überwiegt [siehe Klinische Studien ].
Pest
LEVAQUIN® ist indiziert zur Behandlung von Pest, einschließlich Lungenpest und septikämischer Pest, aufgrund von Yersinia pestis (Y. pestis) und zur Prophylaxe der Pest bei Erwachsenen und pädiatrischen Patienten ab einem Alter von 6 Monaten [siehe DOSIERUNG UND ANWENDUNG ].
Wirksamkeitsstudien von LEVAQUIN® konnten aus ethischen und Machbarkeitsgründen nicht an Menschen mit Pest durchgeführt werden. Daher basierte die Zulassung dieser Indikation auf einer an Tieren durchgeführten Wirksamkeitsstudie [siehe Klinische Studien ].
Komplizierte Harnwegsinfektionen
5-tägiges Behandlungsschema
LEVAQUIN® ist indiziert bei erwachsenen Patienten zur Behandlung von komplizierten Harnwegsinfektionen durch Escherichia coli, Klebsiella pneumoniae oder Proteus mirabilis [vgl Klinische Studien ].
Komplizierte Harnwegsinfektionen
10-tägiges Behandlungsschema
LEVAQUIN® ist indiziert bei erwachsenen Patienten zur Behandlung komplizierter Harnwegsinfektionen (leicht bis mittelschwer) durch Enterococcus faecalis, Enterobacter cloacae, Escherichia coli, Klebsiella pneumoniae, Proteus mirabilis oder Pseudomonas aeruginosa [siehe Klinische Studien ].
Akute Pyelonephritis
5- oder 10-tägiges Behandlungsschema
LEVAQUIN® ist indiziert bei erwachsenen Patienten zur Behandlung einer durch Escherichia coli verursachten akuten Pyelonephritis, einschließlich Fällen mit gleichzeitiger Bakteriämie [siehe Klinische Studien ].
Unkomplizierte Harnwegsinfektionen
LEVAQUIN® ist indiziert bei erwachsenen Patienten zur Behandlung von unkomplizierten Harnwegsinfektionen (leicht bis mittelschwer) durch Escherichia coli, Klebsiella pneumoniae oder Staphylococcus saprophyticus.
Da Fluorchinolone, einschließlich LEVAQUIN®, mit schwerwiegenden Nebenwirkungen in Verbindung gebracht wurden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und bei einigen Patienten eine unkomplizierte Harnwegsinfektion selbstlimitierend ist, sollte LEVAQUIN® der Behandlung von unkomplizierten Harnwegsinfektionen bei Patienten vorbehalten bleiben, für die keine alternativen Behandlungsoptionen zur Verfügung stehen.
Akute bakterielle Exazerbation einer chronischen Bronchitis
LEVAQUIN® ist indiziert bei erwachsenen Patienten zur Behandlung der akuten bakteriellen Exazerbation einer chronischen Bronchitis (ABECB) durch Methicillin-empfindliche Staphylococcus aureus, Streptococcus pneumoniae, Haemophilus influenzae, Haemophilus parainfluenzae oder Moraxella catarrhalis.
Da Fluorchinolone, einschließlich LEVAQUIN®, mit schwerwiegenden Nebenwirkungen in Verbindung gebracht wurden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ] und bei manchen Patienten ABECB selbstlimitierend ist, sollte LEVAQUIN® für die Behandlung von ABECB bei Patienten reserviert werden, die keine alternativen Behandlungsoptionen haben.
Akute bakterielle Sinusitis
5-tägige und 10–14-tägige Behandlungsschemata
LEVAQUIN® ist indiziert bei erwachsenen Patienten zur Behandlung von akuter bakterieller Sinusitis (ABS) aufgrund von Streptococcus pneumoniae, Haemophilus influenzae oder Moraxella catarrhalis [siehe Klinische Studien ].
Da Fluorchinolone, einschließlich LEVAQUIN®, mit schwerwiegenden Nebenwirkungen in Verbindung gebracht wurden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und bei manchen Patienten ABS selbstlimitierend ist, sollte LEVAQUIN® für die Behandlung von ABS bei Patienten reserviert werden, für die keine alternativen Behandlungsoptionen zur Verfügung stehen.
Verwendungszweck
Um die Entwicklung arzneimittelresistenter Bakterien zu verringern und die Wirksamkeit von LEVAQUIN® und anderen antibakteriellen Arzneimitteln aufrechtzuerhalten, sollte LEVAQUIN® nur zur Behandlung oder Vorbeugung von Infektionen angewendet werden, die nachweislich oder mit starkem Verdacht auf empfindliche Bakterien zurückzuführen sind. Wenn Kultur- und Empfindlichkeitsinformationen verfügbar sind, sollten diese bei der Auswahl oder Änderung der antibakteriellen Therapie berücksichtigt werden. In Ermangelung solcher Daten können lokale Epidemiologie und Anfälligkeitsmuster zur empirischen Auswahl der Therapie beitragen.
Kultur- und Empfindlichkeitstests
Vor der Behandlung sollten geeignete Kultur- und Empfindlichkeitstests durchgeführt werden, um die die Infektion verursachenden Organismen zu isolieren und zu identifizieren und ihre Empfindlichkeit gegenüber Levofloxacin zu bestimmen [siehe Mikrobiologie ]. Eine Therapie mit LEVAQUIN® kann begonnen werden, bevor die Ergebnisse dieser Tests bekannt sind; Sobald die Ergebnisse verfügbar sind, sollte eine geeignete Therapie ausgewählt werden.
Wie bei anderen Arzneimitteln dieser Klasse können einige Isolate von Pseudomonas aeruginosa während der Behandlung mit LEVAQUIN® ziemlich schnell Resistenzen entwickeln. Während der Therapie regelmäßig durchgeführte Kultur- und Empfindlichkeitstests geben Aufschluss über die anhaltende Empfindlichkeit der Erreger gegenüber dem antimikrobiellen Mittel und auch über das mögliche Auftreten einer bakteriellen Resistenz.
DOSIERUNG UND ANWENDUNG
Dosierung von LEVAQUIN®-Tabletten bei erwachsenen Patienten mit einer Kreatinin-Clearance ≥ 50 ml/Minute
Die übliche Dosis von LEVAQUIN® Tabletten beträgt 250 mg, 500 mg oder 750 mg und wird alle 24 Stunden oral verabreicht, je nach Infektion und wie in Tabelle 1 beschrieben.
Diese Empfehlungen gelten für Patienten mit einer Kreatinin-Clearance ≥ 50 ml/Minute. Bei Patienten mit einer Kreatinin-Clearance von weniger als 50 ml/min sind Anpassungen des Dosierungsschemas erforderlich [siehe Dosisanpassung bei Erwachsenen mit eingeschränkter Nierenfunktion ].
Dosierung von LEVAQUIN®-Tabletten bei pädiatrischen Patienten mit Inhalationsmilzbrand oder Pest
Die Dosierung von LEVAQUIN® Tabletten für Lungenmilzbrand (nach Exposition) und Pest bei pädiatrischen Patienten mit einem Gewicht von 30 kg oder mehr ist unten in Tabelle 2 beschrieben. LEVAQUIN® Tabletten können aufgrund der Einschränkungen nicht an Patienten verabreicht werden, die weniger als 30 kg wiegen der verfügbaren Kraft. Für pädiatrische Patienten, die weniger als 30 kg wiegen, können alternative Formulierungen von Levofloxacin in Betracht gezogen werden.
Dosisanpassung bei Erwachsenen mit eingeschränkter Nierenfunktion
Verabreichen Sie LEVAQUIN® bei Patienten mit eingeschränkter Nierenfunktion mit Vorsicht. Vor und während der Therapie sollten eine sorgfältige klinische Beobachtung und geeignete Laboruntersuchungen durchgeführt werden, da die Elimination von Levofloxacin bei diesen Patienten reduziert sein kann.
Bei Patienten mit eingeschränkter Nierenfunktion (Kreatinin-Clearance unter 50 ml/min) ist eine Anpassung des Dosierungsschemas erforderlich, um eine Akkumulation von Levofloxacin aufgrund einer verminderten Clearance zu vermeiden [siehe Verwendung in bestimmten Bevölkerungsgruppen ]. Bei Patienten mit einer Kreatinin-Clearance größer oder gleich 50 ml/Minute ist keine Anpassung erforderlich.
Tabelle 3 zeigt, wie die Dosis basierend auf der Kreatinin-Clearance angepasst wird.
Arzneimittelwechselwirkung mit Chelatbildnern
Antazida, Sucralfat, Metallkationen, Multivitamine
LEVAQUIN® Tabletten sollten mindestens zwei Stunden vor oder zwei Stunden nach Antazida eingenommen werden, die Magnesium, Aluminium sowie Sucralfat, Metallkationen wie Eisen und Multivitaminpräparate mit Zink oder Didanosin-Kau-/Puffertabletten oder das pädiatrische Pulver zur Herstellung einer Lösung zum Einnehmen enthalten [sehen WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN und INFORMATIONEN ZUM PATIENTEN ].
Verwaltungsanweisungen
LEVAQUIN® Tabletten können unabhängig von Nahrung verabreicht werden.
Flüssigkeitszufuhr für Patienten, die LEVAQUIN®-Tabletten erhalten
Eine ausreichende Hydratation von Patienten, die LEVAQUIN® erhalten, sollte aufrechterhalten werden, um die Bildung von hochkonzentriertem Urin zu verhindern. Bei Chinolonen wurde über Kristallurie und Cylindrurie berichtet [vgl NEBENWIRKUNGEN und INFORMATIONEN ZUM PATIENTEN ].
WIE GELIEFERT
Darreichungsformen und Stärken
TABLETTEN, filmbeschichtet, kapselförmig
Lagerung und Handhabung
LEVAQUIN® Tabletten werden als kapselförmige Dragees mit 250, 500 und 750 mg geliefert.
LEVAQUIN® Tabletten werden in Flaschen in den folgenden Konfigurationen verpackt:
LEVAQUIN® Tabletten sollten bei 15° bis 30°C (59° bis 86°F) in gut verschlossenen Behältern gelagert werden.
Hergestellt von: Active Ingredient Made in Japan. Überarbeitet: Juli 2018
NEBENWIRKUNGEN
Schwerwiegende und anderweitig wichtige Nebenwirkungen
Die folgenden schwerwiegenden und anderweitig wichtigen unerwünschten Arzneimittelwirkungen werden in anderen Abschnitten der Kennzeichnung ausführlicher erörtert:
Bei Chinolonen, einschließlich LEVAQUIN®, wurde über Kristallurie und Cylindrurie berichtet. Daher sollte eine ausreichende Flüssigkeitszufuhr bei Patienten, die LEVAQUIN® erhalten, aufrechterhalten werden, um die Bildung eines hochkonzentrierten Urins zu verhindern [siehe DOSIERUNG UND ANWENDUNG ].
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Die unten beschriebenen Daten spiegeln die Exposition gegenüber LEVAQUIN® bei 7537 Patienten in 29 gepoolten klinischen Studien der Phase 3 wider. Die untersuchte Population hatte ein Durchschnittsalter von 50 Jahren (ungefähr 74 % der Bevölkerung waren INDIKATIONEN ]. Die Patienten erhielten LEVAQUIN®-Dosen von 750 mg einmal täglich, 250 mg einmal täglich oder 500 mg ein- oder zweimal täglich.
Die Behandlungsdauer betrug in der Regel 3–14 Tage, und die durchschnittliche Anzahl der Therapietage betrug 10 Tage.
Die Gesamtinzidenz, Art und Verteilung von Nebenwirkungen war bei Patienten, die LEVAQUIN®-Dosen von 750 mg einmal täglich, 250 mg einmal täglich und 500 mg ein- oder zweimal täglich erhielten, ähnlich.
Das Absetzen von LEVAQUIN® aufgrund von Nebenwirkungen erfolgte bei insgesamt 4,3 % der Patienten, bei 3,8 % der Patienten, die mit den 250-mg- und 500-mg-Dosen behandelt wurden, und bei 5,4 % der Patienten, die mit der 750-mg-Dosis behandelt wurden. Die häufigsten Nebenwirkungen, die zum Absetzen der 250-mg- und 500-mg-Dosen führten, waren gastrointestinal (1,4 %), hauptsächlich Übelkeit (0,6 %); Erbrechen (0,4 %); Schwindel (0,3 %); und Kopfschmerzen (0,2 %). Die häufigsten Nebenwirkungen, die zum Absetzen der 750-mg-Dosis führten, waren gastrointestinal (1,2 %), hauptsächlich Übelkeit (0,6 %), Erbrechen (0,5 %); Schwindel (0,3 %); und Kopfschmerzen (0,3 %).
Nebenwirkungen, die bei ≥ 1 % der mit LEVAQUIN® behandelten Patienten auftraten, und weniger häufige Nebenwirkungen, die bei 0,1 bis
In klinischen Studien mit Mehrfachdosistherapie wurden bei Patienten, die sich einer Behandlung mit Chinolonen, einschließlich LEVAQUIN®, unterzogen, ophthalmologische Anomalien, einschließlich Katarakte und mehrfache punktförmige linsenförmige Trübungen, festgestellt. Die Beziehung der Medikamente zu diesen Ereignissen ist derzeit nicht nachgewiesen.
Postmarketing-Erfahrung
Tabelle 6 listet Nebenwirkungen auf, die während der Anwendung von LEVAQUIN® nach der Zulassung festgestellt wurden. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Chelatbildner
Antazida, Sucralfat, Metallkationen, Multivitamine
Während die Chelatbildung durch zweiwertige Kationen weniger ausgeprägt ist als bei anderen Fluorchinolonen, kann die gleichzeitige Verabreichung von LEVAQUIN® Tabletten mit Antazida, die Magnesium oder Aluminium sowie Sucralfat, Metallkationen wie Eisen und Multivitaminpräparate mit Zink enthalten, die gastrointestinale Resorption beeinträchtigen von Levofloxacin, was zu erheblich niedrigeren systemischen Spiegeln als erwünscht führt. Tabletten mit Antazida, die Magnesium, Aluminium sowie Sucralfat, Metallkationen wie Eisen und Multivitaminpräparate mit Zink oder Didanosin enthalten, können die gastrointestinale Resorption von Levofloxacin erheblich beeinträchtigen, was zu erheblich niedrigeren systemischen Spiegeln als erwünscht führt. Diese Mittel sollten mindestens zwei Stunden vor oder zwei Stunden nach der oralen LEVAQUIN®-Gabe eingenommen werden.
Warfarin
In einer klinischen Studie mit gesunden Freiwilligen wurde keine signifikante Wirkung von LEVAQUIN® auf die maximalen Plasmakonzentrationen, die AUC und andere Dispositionsparameter für R- und S-Warfarin festgestellt. Ebenso wurde keine offensichtliche Wirkung von Warfarin auf die Resorption und Disposition von Levofloxacin beobachtet. Es gab jedoch Berichte nach der Markteinführung bei Patienten, dass LEVAQUIN® die Wirkung von Warfarin verstärkt. Erhöhungen der Prothrombinzeit bei gleichzeitiger Anwendung von Warfarin und LEVAQUIN® wurden mit Blutungsepisoden in Verbindung gebracht. Prothrombinzeit, International Normalized Ratio (INR) oder andere geeignete Antikoagulationstests sollten engmaschig überwacht werden, wenn LEVAQUIN® gleichzeitig mit Warfarin verabreicht wird. Die Patienten sollten auch auf Anzeichen von Blutungen überwacht werden [siehe NEBENWIRKUNGEN und INFORMATIONEN ZUM PATIENTEN ].
Antidiabetika
Bei Patienten, die gleichzeitig mit Fluorchinolonen und einem Antidiabetikum behandelt wurden, wurde über Störungen des Blutzuckerspiegels, einschließlich Hyperglykämie und Hypoglykämie, berichtet. Daher wird eine sorgfältige Überwachung des Blutzuckerspiegels empfohlen, wenn diese Arzneimittel gleichzeitig verabreicht werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN , NEBENWIRKUNGEN , und INFORMATIONEN ZUM PATIENTEN ].
Nicht-steroidale entzündungshemmende Medikamente
Die gleichzeitige Verabreichung eines nicht-steroidalen entzündungshemmenden Arzneimittels mit einem Fluorchinolon, einschließlich LEVAQUIN®, kann das Risiko einer ZNS-Stimulation und Krampfanfällen erhöhen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Theophyllin
In einer klinischen Studie mit gesunden Probanden wurde keine signifikante Wirkung von LEVAQUIN® auf die Plasmakonzentrationen, AUC und andere Dispositionsparameter für Theophyllin festgestellt. Ebenso wurde keine offensichtliche Wirkung von Theophyllin auf die Resorption und Disposition von Levofloxacin beobachtet. Die gleichzeitige Verabreichung von anderen Fluorchinolonen mit Theophyllin hat jedoch zu einer verlängerten Eliminationshalbwertszeit, erhöhten Theophyllinspiegeln im Serum und einem anschließenden Anstieg des Risikos von Theophyllin-bedingten Nebenwirkungen in der Patientenpopulation geführt. Daher sollten die Theophyllinspiegel engmaschig überwacht und entsprechende Dosisanpassungen vorgenommen werden, wenn LEVAQUIN® gleichzeitig verabreicht wird. Nebenwirkungen, einschließlich Krampfanfälle, können mit oder ohne Erhöhung der Theophyllinspiegel im Serum auftreten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Cyclosporin
In einer klinischen Studie mit gesunden Freiwilligen wurde keine signifikante Wirkung von LEVAQUIN® auf die maximalen Plasmakonzentrationen, die AUC und andere Dispositionsparameter für Cyclosporin festgestellt. Bei der Patientenpopulation wurden jedoch erhöhte Serumspiegel von Cyclosporin bei gleichzeitiger Verabreichung mit einigen anderen Fluorchinolonen berichtet. Cmax und ke von Levofloxacin waren etwas niedriger, während Tmax und t1/2 in Gegenwart von Ciclosporin etwas länger waren als in anderen Studien ohne Begleitmedikation. Die Unterschiede werden jedoch nicht als klinisch signifikant angesehen. Daher ist bei gleichzeitiger Gabe von LEVAQUIN® oder Ciclosporin keine Dosisanpassung erforderlich.
Digoxin
In einer klinischen Studie mit gesunden Probanden wurde keine signifikante Wirkung von LEVAQUIN® auf die maximalen Plasmakonzentrationen, die AUC und andere Dispositionsparameter für Digoxin festgestellt. Die Resorptions- und Dispositionskinetik von Levofloxacin war in Gegenwart oder Abwesenheit von Digoxin ähnlich. Daher ist bei gleichzeitiger Verabreichung keine Dosisanpassung für LEVAQUIN® oder Digoxin erforderlich.
Probenecid und Cimetidin
In einer klinischen Studie mit gesunden Freiwilligen wurde keine signifikante Wirkung von Probenecid oder Cimetidin auf die Cmax von Levofloxacin beobachtet. Die AUC und t1/2 von Levofloxacin waren höher, während CL/F und CLR während der gleichzeitigen Behandlung von LEVAQUIN® mit Probenecid oder Cimetidin im Vergleich zu LEVAQUIN® allein niedriger waren. Diese Änderungen rechtfertigen jedoch keine Dosisanpassung für LEVAQUIN®, wenn Probenecid oder Cimetidin gleichzeitig verabreicht werden.
Wechselwirkungen mit Labor- oder Diagnosetests
Einige Fluorchinolone, einschließlich LEVAQUIN®, können unter Verwendung von im Handel erhältlichen Immunoassay-Kits zu falsch-positiven Urinscreening-Ergebnissen für Opiate führen. Eine Bestätigung positiver Opiat-Screenings durch spezifischere Methoden kann erforderlich sein.
WARNUNGEN
Eingeschlossen als Teil der "VORSICHTSMASSNAHMEN" Abschnitt
VORSICHTSMASSNAHMEN
Schwerwiegende Nebenwirkungen, die die Behinderung beeinträchtigen und möglicherweise irreversibel sind, einschließlich Tendinitis und Sehnenriss, periphere Neuropathie und Auswirkungen auf das zentrale Nervensystem
Fluorchinolone, einschließlich LEVAQUIN®, wurden mit beeinträchtigenden und potenziell irreversiblen schwerwiegenden Nebenwirkungen von verschiedenen Körpersystemen in Verbindung gebracht, die bei demselben Patienten zusammen auftreten können. Häufig beobachtete Nebenwirkungen sind Tendinitis, Sehnenruptur, Arthralgie, Myalgie, periphere Neuropathie und Auswirkungen auf das zentrale Nervensystem (Halluzinationen, Angstzustände, Depressionen, Schlaflosigkeit, starke Kopfschmerzen und Verwirrtheit). Diese Reaktionen können innerhalb von Stunden bis Wochen nach Beginn der Behandlung mit LEVAQUIN® auftreten. Bei Patienten jeden Alters oder ohne vorbestehende Risikofaktoren sind diese Nebenwirkungen aufgetreten [siehe Tendinitis und Sehnenruptur, periphere Neuropathie, Auswirkungen auf das zentrale Nervensystem ].
Setzen Sie LEVAQUIN® sofort bei den ersten Anzeichen oder Symptomen einer schwerwiegenden Nebenwirkung ab. Vermeiden Sie außerdem die Anwendung von Fluorchinolonen, einschließlich LEVAQUIN®, bei Patienten, bei denen eine dieser schwerwiegenden Nebenwirkungen im Zusammenhang mit Fluorchinolonen aufgetreten ist.
Tendinitis und Sehnenriss
Fluorchinolone, einschließlich LEVAQUIN®, wurden mit einem erhöhten Risiko für Tendinitis und Sehnenrisse in allen Altersgruppen in Verbindung gebracht [siehe Schwerwiegende Nebenwirkungen, die die Behinderung beeinträchtigen und möglicherweise irreversibel sind, einschließlich Tendinitis und Sehnenriss, periphere Neuropathie und Auswirkungen auf das zentrale Nervensystem und NEBENWIRKUNGEN ]. Diese Nebenwirkung betrifft am häufigsten die Achillessehne und wurde auch bei der Rotatorenmanschette (Schulter), der Hand, dem Bizeps, dem Daumen und anderen Sehnenstellen berichtet. Eine Tendinitis oder Sehnenruptur kann innerhalb von Stunden oder Tagen nach Beginn der Behandlung mit LEVAQUIN® oder sogar mehrere Monate nach Abschluss der Fluorchinolon-Therapie auftreten. Tendinitis und Sehnenruptur können bilateral auftreten.
Das Risiko, eine Fluorchinolon-assoziierte Tendinitis und einen Sehnenriss zu entwickeln, ist bei Patienten über 60 Jahren, bei Patienten, die Kortikosteroide einnehmen, und bei Patienten mit Nieren-, Herz- oder Lungentransplantation erhöht. Andere Faktoren, die das Risiko eines Sehnenrisses unabhängig voneinander erhöhen können, sind anstrengende körperliche Aktivität, Nierenversagen und frühere Sehnenerkrankungen wie rheumatoide Arthritis. Bei Patienten, die Fluorchinolone einnahmen und die oben genannten Risikofaktoren nicht aufwiesen, wurde über Tendinitis und Sehnenrisse berichtet. Setzen Sie LEVAQUIN® sofort ab, wenn der Patient Schmerzen, Schwellungen, Entzündungen oder Sehnenrisse verspürt. Den Patienten sollte geraten werden, sich beim ersten Anzeichen einer Tendinitis oder eines Sehnenrisses auszuruhen und sich bezüglich eines Wechsels zu einem antimikrobiellen Arzneimittel, das kein Chinolon ist, an ihren Arzt zu wenden. Vermeiden Sie LEVAQUIN® bei Patienten mit einer Vorgeschichte von Sehnenerkrankungen oder Sehnenrissen [siehe NEBENWIRKUNGEN und INFORMATIONEN ZUM PATIENTEN ].
Periphere Neuropathie
Fluorchinolone, einschließlich LEVAQUIN®, wurden mit einem erhöhten Risiko für periphere Neuropathie in Verbindung gebracht. Fälle von sensorischer oder sensomotorischer axonaler Polyneuropathie, die kleine und/oder große Axone betraf und zu Parästhesien, Hypästhesien, Dysästhesien und Schwäche führte, wurden bei Patienten berichtet, die Fluorchinolone, einschließlich LEVAQUIN®, erhielten. Die Symptome können kurz nach Beginn der Behandlung mit LEVAQUIN® auftreten und bei einigen Patienten irreversibel sein [siehe Schwerwiegende Nebenwirkungen, die die Behinderung beeinträchtigen und möglicherweise irreversibel sind, einschließlich Tendinitis und Sehnenriss, periphere Neuropathie und Auswirkungen auf das zentrale Nervensystem und NEBENWIRKUNGEN ].
Setzen Sie LEVAQUIN® sofort ab, wenn der Patient Symptome einer Neuropathie verspürt, einschließlich Schmerzen, Brennen, Kribbeln, Taubheitsgefühl und/oder Schwäche oder andere Veränderungen der Empfindung, einschließlich leichter Berührung, Schmerzen, Temperatur, Positionsgefühl und Vibrationsgefühl. Vermeiden Sie Fluorchinolone, einschließlich LEVAQUIN®, bei Patienten, bei denen zuvor eine periphere Neuropathie aufgetreten ist [siehe NEBENWIRKUNGEN und INFORMATIONEN ZUM PATIENTEN ].
Auswirkungen auf das zentrale Nervensystem
Fluorchinolone, einschließlich LEVAQUIN®, wurden mit einem erhöhten Risiko für Auswirkungen auf das Zentralnervensystem (ZNS), einschließlich Krämpfe, toxische Psychosen, erhöhten Hirndruck (einschließlich Pseudotumor cerebri), in Verbindung gebracht. Fluorchinolone können auch eine Stimulation des Zentralnervensystems verursachen, was zu Zittern, Unruhe, Angst, Benommenheit, Verwirrtheit, Halluzinationen, Paranoia, Depression, Albträumen und Schlaflosigkeit führen kann. Suizidgedanken und versuchter oder vollendeter Suizid können ebenfalls auftreten, insbesondere bei Patienten mit Depressionen in der Krankengeschichte oder einem zugrunde liegenden Risikofaktor für Depressionen. Diese Reaktionen können nach der ersten Dosis auftreten. Wenn diese Reaktionen bei Patienten auftreten, die LEVAQUIN® erhalten, LEVAQUIN® absetzen und geeignete Maßnahmen einleiten. Wie andere Fluorchinolone sollte LEVAQUIN® bei Patienten mit bekannter oder vermuteter Erkrankung des Zentralnervensystems (ZNS), die sie für Krampfanfälle prädisponieren oder die Krampfschwelle senken kann (z. B. schwere zerebrale Arteriosklerose, Epilepsie), oder bei Patienten mit Vorsicht angewendet werden andere Risikofaktoren, die sie für Krampfanfälle prädisponieren oder die Krampfschwelle senken können (z. B. bestimmte medikamentöse Therapie, Nierenfunktionsstörung). [sehen NEBENWIRKUNGEN , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN , und INFORMATIONEN ZUM PATIENTEN ].
Exazerbation von Myasthenia gravis
Fluorchinolone, einschließlich LEVAQUIN®, wirken neuromuskulär blockierend und können Muskelschwäche bei Patienten mit Myasthenia gravis verschlimmern. Nach der Markteinführung wurden schwerwiegende Nebenwirkungen, einschließlich Todesfälle und Notwendigkeit einer Beatmung, mit der Anwendung von Fluorchinolonen bei Patienten mit Myasthenia gravis in Verbindung gebracht. Vermeiden Sie LEVAQUIN® bei Patienten mit einer bekannten Vorgeschichte von Myasthenia gravis [siehe NEBENWIRKUNGEN und INFORMATIONEN ZUM PATIENTEN ].
Andere schwerwiegende und manchmal tödliche Nebenwirkungen
Andere schwerwiegende und manchmal tödliche Nebenwirkungen, einige aufgrund von Überempfindlichkeit und einige aufgrund unklarer Ätiologie, wurden selten bei Patienten berichtet, die eine Therapie mit Fluorchinolonen, einschließlich LEVAQUIN®, erhielten. Diese Ereignisse können schwerwiegend sein und treten im Allgemeinen nach Verabreichung mehrerer Dosen auf. Klinische Manifestationen können eine oder mehrere der folgenden umfassen:
Setzen Sie LEVAQUIN® sofort beim ersten Auftreten von Hautausschlag, Gelbsucht oder anderen Anzeichen von Überempfindlichkeit ab und leiten Sie unterstützende Maßnahmen ein [siehe NEBENWIRKUNGEN und INFORMATIONEN ZUM PATIENTEN ].
Überempfindlichkeitsreaktionen
Schwerwiegende und gelegentlich tödliche Überempfindlichkeitsreaktionen und/oder anaphylaktische Reaktionen wurden bei Patienten berichtet, die eine Therapie mit Fluorchinolonen, einschließlich LEVAQUIN®, erhielten. Diese Reaktionen treten häufig nach der ersten Dosis auf. Einige Reaktionen wurden von kardiovaskulärem Kollaps, Hypotonie/Schock, Krampfanfällen, Bewusstlosigkeit, Kribbeln, Angioödem (einschließlich Zungen-, Kehlkopf-, Rachen- oder Gesichtsödem/-schwellung), Atemwegsobstruktion (einschließlich Bronchospasmus, Kurzatmigkeit und akuter Atemwegserkrankung) begleitet Distress), Dyspnoe, Urtikaria, Juckreiz und andere schwerwiegende Hautreaktionen. LEVAQUIN® sollte beim ersten Auftreten eines Hautausschlags oder anderen Anzeichen einer Überempfindlichkeit sofort abgesetzt werden. Schwerwiegende akute Überempfindlichkeitsreaktionen können eine Behandlung mit Epinephrin und andere Wiederbelebungsmaßnahmen erfordern, einschließlich Sauerstoff, intravenöse Flüssigkeiten, Antihistaminika, Kortikosteroide, Pressoramine und Atemwegsmanagement, wie klinisch indiziert [siehe NEBENWIRKUNGEN und INFORMATIONEN ZUM PATIENTEN ].
Hepatotoxizität
Nach der Markteinführung sind Berichte über schwere Hepatotoxizität (einschließlich akuter Hepatitis und tödlicher Ereignisse) für mit LEVAQUIN® behandelte Patienten eingegangen. In klinischen Studien mit über 7.000 Patienten wurden keine Hinweise auf eine schwerwiegende arzneimittelbedingte Hepatotoxizität festgestellt. Eine schwere Hepatotoxizität trat im Allgemeinen innerhalb von 14 Tagen nach Beginn der Therapie auf und die meisten Fälle traten innerhalb von 6 Tagen auf. Die meisten Fälle von schwerer Hepatotoxizität waren nicht mit Überempfindlichkeit verbunden [siehe Andere schwerwiegende und manchmal tödliche Nebenwirkungen ].
Die Mehrzahl der Berichte über tödliche Hepatotoxizität trat bei Patienten auf, die 65 Jahre oder älter waren, und die meisten waren nicht mit Überempfindlichkeit verbunden. LEVAQUIN® sollte sofort abgesetzt werden, wenn der Patient Anzeichen und Symptome einer Hepatitis entwickelt [siehe NEBENWIRKUNGEN und INFORMATIONEN ZUM PATIENTEN ].
Clostridium difficile-assoziierter Durchfall
Clostridium difficile-assoziierte Diarrhoe (CDAD) wurde bei der Anwendung von fast allen antibakteriellen Mitteln, einschließlich LEVAQUIN®, berichtet und kann in ihrer Schwere von leichter Diarrhoe bis hin zu tödlicher Colitis reichen. Die Behandlung mit antibakteriellen Mitteln verändert die normale Flora des Dickdarms, was zu einem übermäßigen Wachstum von C. difficile führt.
C. difficile produziert die Toxine A und B, die zur Entstehung von CDAD beitragen. Hypertoxin produzierende Stämme von C. difficile verursachen eine erhöhte Morbidität und Mortalität, da diese Infektionen gegenüber einer antimikrobiellen Therapie refraktär sein können und eine Kolektomie erfordern können. CDAD muss bei allen Patienten in Betracht gezogen werden, bei denen nach der Anwendung von Antibiotika Durchfall auftritt. Eine sorgfältige Anamnese ist erforderlich, da berichtet wurde, dass CDAD mehr als zwei Monate nach der Verabreichung von Antibiotika auftritt.
Wenn CDAD vermutet oder bestätigt wird, muss die laufende Anwendung von Antibiotika, die nicht gegen C. difficile gerichtet sind, möglicherweise eingestellt werden. Wenn klinisch indiziert, sollte ein angemessenes Flüssigkeits- und Elektrolytmanagement, eine Proteinergänzung, eine Antibiotikabehandlung von C. difficile und eine chirurgische Untersuchung eingeleitet werden [siehe NEBENWIRKUNGEN und INFORMATIONEN ZUM PATIENTEN ].
Verlängerung des QT-Intervalls
Einige Fluorchinolone, einschließlich LEVAQUIN®, wurden mit einer Verlängerung des QT-Intervalls im Elektrokardiogramm und seltenen Fällen von Arrhythmie in Verbindung gebracht. Seltene Fälle von Torsade de Pointes wurden während der Überwachung nach Markteinführung bei Patienten, die Fluorchinolone, einschließlich LEVAQUIN®, erhielten, spontan berichtet. LEVAQUIN® sollte bei Patienten mit bekannter Verlängerung des QT-Intervalls, Patienten mit unkorrigierter Hypokaliämie und Patienten, die Antiarrhythmika der Klasse IA (Chinidin, Procainamid) oder Klasse III (Amiodaron, Sotalol) erhalten, vermieden werden. Ältere Patienten können anfälliger für arzneimittelbedingte Wirkungen auf das QT-Intervall sein [vgl NEBENWIRKUNGEN , Verwendung in bestimmten Bevölkerungsgruppen , und INFORMATIONEN ZUM PATIENTEN ].
Erkrankungen des Bewegungsapparates bei pädiatrischen Patienten und arthropathische Wirkungen bei Tieren
LEVAQUIN® ist bei pädiatrischen Patienten (6 Monate und älter) nur zur Vorbeugung von Lungenmilzbrand (nach Exposition) und gegen Pest indiziert [siehe INDIKATIONEN ]. Bei pädiatrischen Patienten, die LEVAQUIN® erhielten, wurde eine erhöhte Inzidenz von Muskel-Skelett-Erkrankungen (Arthralgie, Arthritis, Tendinopathie und Ganganomalien) im Vergleich zu Kontrollpersonen beobachtet [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Bei unreifen Ratten und Hunden führte die orale und intravenöse Verabreichung von Levofloxacin zu einer erhöhten Osteochondrose. Die histopathologische Untersuchung der gewichtstragenden Gelenke von unreifen Hunden, denen Levofloxacin verabreicht wurde, ergab anhaltende Läsionen des Knorpels. Auch andere Fluorchinolone erzeugen ähnliche Erosionen in den gewichtstragenden Gelenken und andere Anzeichen von Arthropathie bei unreifen Tieren verschiedener Arten [vgl Tierpharmakologie ].
Blutzuckerstörungen
Wie bei anderen Fluorchinolonen wurde bei LEVAQUIN® über Störungen des Blutzuckerspiegels, einschließlich symptomatischer Hyper- und Hypoglykämie, berichtet, normalerweise bei Diabetikern, die gleichzeitig mit einem oralen Antidiabetika (z. B. Glyburid) oder mit Insulin behandelt wurden. Bei diesen Patienten wird eine sorgfältige Überwachung des Blutzuckers empfohlen. Wenn bei einem Patienten, der mit LEVAQUIN® behandelt wird, eine hypoglykämische Reaktion auftritt, sollte LEVAQUIN® abgesetzt und sofort eine geeignete Therapie eingeleitet werden [siehe NEBENWIRKUNGEN , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN und INFORMATIONEN ZUM PATIENTEN ].
Lichtempfindlichkeit/Phototoxizität
Mittelschwere bis schwere Lichtempfindlichkeits-/Phototoxizitätsreaktionen, letztere können sich als übertriebene Sonnenbrandreaktionen (z. B. Brennen, Erythem, Exsudation, Bläschen, Blasenbildung, Ödeme) äußern, die lichtexponierte Bereiche (typischerweise das Gesicht, „V“-Bereich des Halses) betreffen , Streckseiten der Unterarme, Handrücken), können mit der Anwendung von Fluorchinolonen nach Sonnen- oder UV-Lichteinwirkung in Verbindung gebracht werden. Daher sollte eine übermäßige Exposition gegenüber diesen Lichtquellen vermieden werden. Die medikamentöse Therapie sollte abgebrochen werden, wenn eine Photosensitivität/Phototoxizität auftritt [siehe NEBENWIRKUNGEN und INFORMATIONEN ZUM PATIENTEN ].
Entwicklung arzneimittelresistenter Bakterien
Die Verschreibung von LEVAQUIN® in Ermangelung einer nachgewiesenen oder dringend vermuteten bakteriellen Infektion oder einer prophylaktischen Indikation bringt dem Patienten wahrscheinlich keinen Nutzen und erhöht das Risiko der Entwicklung arzneimittelresistenter Bakterien [siehe INFORMATIONEN ZUM PATIENTEN ].
Informationen zur Patientenberatung
Weisen Sie den Patienten an, die von der FDA zugelassene Patientenkennzeichnung ( Leitfaden für Medikamente ).
Schwerwiegende Nebenwirkungen
Empfehlen Sie den Patienten, die Einnahme von LEVAQUIN® abzubrechen, wenn bei ihnen eine Nebenwirkung auftritt, und wenden Sie sich an Ihren Arzt, um sich beraten zu lassen, wie die vollständige Behandlung mit einem anderen antibakteriellen Arzneimittel abgeschlossen werden kann.
Informieren Sie die Patienten über die folgenden schwerwiegenden Nebenwirkungen, die mit der Anwendung von LEVAQUIN® oder anderen Fluorchinolonen in Verbindung gebracht wurden:
Antibakterielle Resistenz
Antibakterielle Arzneimittel einschließlich LEVAQUIN® sollten nur zur Behandlung bakterieller Infektionen eingesetzt werden. Sie behandeln keine Virusinfektionen (z. B. Erkältung). Wenn LEVAQUIN® zur Behandlung einer bakteriellen Infektion verschrieben wird, sollten die Patienten darüber aufgeklärt werden, dass sie sich zwar zu Beginn der Therapie besser fühlen, das Medikament jedoch genau nach Anweisung eingenommen werden sollte. Das Auslassen von Dosen oder das Nichtabschließen des vollständigen Therapiezyklus kann (1) die Wirksamkeit der sofortigen Behandlung verringern und (2) die Wahrscheinlichkeit erhöhen, dass Bakterien Resistenzen entwickeln und in Zukunft nicht mehr mit LEVAQUIN® oder anderen antibakteriellen Arzneimitteln behandelbar sind.
Verabreichung mit Nahrung, Flüssigkeiten und begleitenden Medikamenten
Die Patienten sollten darüber informiert werden, dass LEVAQUIN® Tabletten mit oder ohne Nahrung eingenommen werden können. Die Tabletten sollten jeden Tag zur gleichen Zeit eingenommen werden.
Patienten sollten während der Einnahme von LEVAQUIN® reichlich Flüssigkeit zu sich nehmen, um die Bildung eines hochkonzentrierten Urins und Kristallbildung im Urin zu vermeiden.
Antazida, die Magnesium oder Aluminium sowie Sucralfat, Metallkationen wie Eisen und Multivitaminpräparate mit Zink oder Didanosin enthalten, sollten mindestens zwei Stunden vor oder zwei Stunden nach der oralen LEVAQUIN®-Gabe eingenommen werden.
Arzneimittelwechselwirkungen mit Insulin, oralen hypoglykämischen Mitteln und Warfarin
Patienten sollten darüber informiert werden, dass sie LEVAQUIN® absetzen und einen Arzt konsultieren sollten, wenn sie Diabetiker sind und mit Insulin oder einem oralen hypoglykämischen Mittel behandelt werden und eine hypoglykämische Reaktion auftritt.
Die Patienten sollten darüber informiert werden, dass die gleichzeitige Verabreichung von Warfarin und LEVAQUIN® mit einem Anstieg der International Normalized Ratio (INR) oder der Prothrombinzeit und klinischen Blutungsepisoden in Verbindung gebracht wurde. Patienten sollten ihren Arzt benachrichtigen, wenn sie Warfarin einnehmen, auf Anzeichen von Blutungen überwacht werden und auch ihre Antikoagulationstests während der gleichzeitigen Einnahme von Warfarin engmaschig überwachen lassen.
Pest- und Anthrax-Studien
Patienten, die LEVAQUIN® für diese Erkrankungen erhalten, sollten darüber informiert werden, dass Wirksamkeitsstudien am Menschen aus ethischen und Machbarkeitsgründen nicht durchgeführt werden konnten. Daher basierte die Zulassung für diese Erkrankungen auf an Tieren durchgeführten Wirksamkeitsstudien.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
In einem lebenslangen Bioassay an Ratten zeigte Levofloxacin nach täglicher Verabreichung über das Futter über 2 Jahre kein karzinogenes Potenzial; die höchste Dosis (100 mg/kg/Tag) war das 1,4-fache der höchsten empfohlenen Humandosis (750 mg), basierend auf der relativen Körperoberfläche. Levofloxacin verkürzte die Zeit bis zur Tumorentwicklung von UV-induzierten Hauttumoren bei unbehaarten Albinomäusen (Skh-1) bei keiner Levofloxacin-Dosis und war daher unter den Bedingungen dieser Studie nicht photokarzinogen. Die dermalen Levofloxacin-Konzentrationen bei haarlosen Mäusen lagen im Bereich von 25 bis 42 mcg/g bei der höchsten Levofloxacin-Dosis (300 mg/kg/Tag), die in der Photokarzinogenitätsstudie verwendet wurde. Im Vergleich dazu betrugen die dermalen Levofloxacin-Konzentrationen bei menschlichen Probanden, die 750 mg LEVAQUIN® erhielten, durchschnittlich etwa 11,8 mcg/g bei Cmax.
Levofloxacin war in den folgenden Assays nicht mutagen: Ames-Bakterienmutationsassay (S. typhimurium und E. coli), CHO/HGPRT-Vorwärtsmutationsassay, Maus-Mikrokerntest, Maus-Dominant-Letal-Test, außerplanmäßiger Ratten-DNA-Synthese-Assay und Maus-Schwesterchromatid Austauschtest. Es war im In-vitro-Test auf Chromosomenaberration (CHL-Zelllinie) und Schwesterchromatid-Austausch (CHL/IU-Zelllinie) positiv.
Levofloxacin verursachte keine Beeinträchtigung der Fertilität oder Fortpflanzungsfähigkeit bei Ratten in oralen Dosen von bis zu 360 mg/kg/Tag, was dem 4,2-fachen der höchsten empfohlenen Humandosis, basierend auf der relativen Körperoberfläche, und intravenösen Dosen von bis zu 100 mg/kg/Tag entspricht. Tag, entsprechend dem 1,2-fachen der höchsten empfohlenen Dosis für den Menschen, basierend auf der relativen Körperoberfläche.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Schwangerschaftskategorie C
Levofloxacin war bei Ratten in Dosen von bis zu 810 mg/kg/Tag nicht teratogen, was dem 9,4-fachen der höchsten empfohlenen oralen Dosis beim Menschen, basierend auf der relativen Körperoberfläche, entspricht. Die orale Dosis von 810 mg/kg/Tag bei Ratten verursachte ein verringertes fötales Körpergewicht und eine erhöhte fötale Sterblichkeit. Keine Teratogenität wurde beobachtet, wenn Kaninchen eine orale Dosis von bis zu 50 mg/kg/Tag erhielten, was dem 1,1-fachen der höchsten empfohlenen oralen Dosis beim Menschen, basierend auf der relativen Körperoberfläche, entspricht.
Es gibt jedoch keine adäquaten und gut kontrollierten Studien bei Schwangeren. LEVAQUIN® sollte während der Schwangerschaft nur angewendet werden, wenn der potenzielle Nutzen das potenzielle Risiko für den Fötus rechtfertigt.
Stillende Mutter
Basierend auf Daten zu anderen Fluorchinolonen und sehr begrenzten Daten zu LEVAQUIN® kann davon ausgegangen werden, dass Levofloxacin in die Muttermilch übergeht. Aufgrund der Möglichkeit schwerwiegender Nebenwirkungen von LEVAQUIN® bei gestillten Säuglingen sollte eine Entscheidung getroffen werden, ob das Stillen oder das Medikament abgesetzt werden soll, wobei die Bedeutung des Medikaments für die Mutter zu berücksichtigen ist.
Pädiatrische Verwendung
Chinolone, einschließlich Levofloxacin, verursachen Arthropathie und Osteochondrose bei Jungtieren verschiedener Arten. [sehen WARNUNGEN UND VORSICHTSMASSNAHMEN und Tierpharmakologie ].
Inhalativer Anthrax (Post-Exposition)
Levofloxacin ist bei pädiatrischen Patienten im Alter von 6 Monaten und älter bei Lungenmilzbrand (Postexposition) indiziert. Die Nutzen-Risiko-Bewertung weist darauf hin, dass die Verabreichung von Levofloxacin bei pädiatrischen Patienten angemessen ist. Die Sicherheit von Levofloxacin bei pädiatrischen Patienten, die länger als 14 Tage behandelt wurden, wurde nicht untersucht [siehe INDIKATIONEN , DOSIERUNG UND ANWENDUNG und Klinische Studien ].
Pest
Levofloxacin ist indiziert bei pädiatrischen Patienten ab 6 Monaten zur Behandlung der Pest, einschließlich pneumonischer und septischer Pest aufgrund von Yersinia pestis (Y. pestis), und zur Prophylaxe der Pest. Wirksamkeitsstudien zu LEVAQUIN® konnten aus ethischen und Machbarkeitsgründen nicht an Menschen mit Lungenpest durchgeführt werden. Daher basierte die Zulassung dieser Indikation auf einer an Tieren durchgeführten Wirksamkeitsstudie. Die Nutzen-Risiko-Bewertung weist darauf hin, dass die Verabreichung von Levofloxacin bei pädiatrischen Patienten angemessen ist [siehe INDIKATIONEN , DOSIERUNG UND ANWENDUNG und Klinische Studien ].
Sicherheit und Wirksamkeit von LEVAQUIN® bei pädiatrischen Patienten im Alter von unter sechs Monaten wurden nicht nachgewiesen.
Pharmakokinetik nach intravenöser Verabreichung
Die Pharmakokinetik von Levofloxacin nach einer intravenösen Einzeldosis wurde bei pädiatrischen Patienten im Alter von sechs Monaten bis 16 Jahren untersucht. Pädiatrische Patienten schieden Levofloxacin schneller aus als erwachsene Patienten, was zu einer geringeren Plasmaexposition als Erwachsene bei einer gegebenen mg/kg-Dosis führt [siehe KLINISCHE PHARMAKOLOGIE und Klinische Studien ].
Dosierung bei pädiatrischen Patienten mit Inhalationsmilzbrand oder Pest
Für die empfohlene Dosierung von LEVAQUIN®-Tabletten bei pädiatrischen Patienten mit Lungenmilzbrand oder Pest siehe DOSIERUNG UND ANWENDUNG . LEVAQUIN® Tabletten können aufgrund der Beschränkungen der verfügbaren Stärken nicht an pädiatrische Patienten verabreicht werden, die weniger als 30 kg wiegen. Für pädiatrische Patienten, die weniger als 30 kg wiegen, können alternative Formulierungen von Levofloxacin in Betracht gezogen werden.
Nebenwirkungen
In klinischen Studien wurden 1534 pädiatrische Patienten (im Alter von 6 Monaten bis 16 Jahren) mit oralem und intravenösem LEVAQUIN® behandelt. Pädiatrische Patienten im Alter von 6 Monaten bis 5 Jahren erhielten LEVAQUIN® 10 mg/kg zweimal täglich und pädiatrische Patienten über 5 Jahren erhielten 10 mg/kg einmal täglich (maximal 500 mg pro Tag) für etwa 10 Tage. LEVAQUIN® Tabletten können aufgrund der Einschränkungen der verfügbaren Stärken nur pädiatrischen Patienten mit Lungenmilzbrand (nach Exposition) oder Pest verabreicht werden, die 30 kg oder mehr wiegen [siehe DOSIERUNG UND ANWENDUNG ].
Eine Untergruppe pädiatrischer Patienten in den klinischen Studien (1340 mit LEVAQUIN® behandelte und 893 ohne Fluorchinolon behandelte) wurde in eine prospektive Langzeitüberwachungsstudie aufgenommen, um die Inzidenz von protokolldefinierten Erkrankungen des Bewegungsapparates (Arthralgie, Arthritis, Tendinopathie, Ganganomalien) zu bewerten ) während 60 Tagen und 1 Jahr nach der ersten Dosis des Studienmedikaments. Mit LEVAQUIN® behandelte pädiatrische Patienten hatten eine signifikant höhere Inzidenz von Muskel-Skelett-Erkrankungen im Vergleich zu den nicht mit Fluorchinolon behandelten Kindern, wie in Tabelle 7 dargestellt. LEVAQUIN® Tabletten können nur pädiatrischen Patienten mit Lungenmilzbrand (nach Exposition) oder Pest verabreicht werden die aufgrund der Einschränkungen der verfügbaren Stärken 30 kg oder mehr wiegen [siehe DOSIERUNG UND ANWENDUNG ].
Arthralgie war die am häufigsten auftretende Muskel-Skelett-Erkrankung in beiden Behandlungsgruppen. Die meisten Muskel-Skelett-Erkrankungen in beiden Gruppen betrafen mehrere gewichtstragende Gelenke. Die Störungen waren bei 8/46 (17 %) der Kinder moderat und bei 35/46 (76 %) der mit LEVAQUIN® behandelten pädiatrischen Patienten leicht, und die meisten wurden mit Analgetika behandelt. Die mediane Zeit bis zum Abklingen betrug 7 Tage bei mit LEVAQUIN® behandelten pädiatrischen Patienten und 9 bei nicht mit Fluorchinolon behandelten Kindern (ca. 80 % heilten in beiden Gruppen innerhalb von 2 Monaten ab). Kein pädiatrischer Patient hatte eine schwere oder schwerwiegende Erkrankung und alle Muskel-Skelett-Erkrankungen verschwanden ohne Folgeerscheinungen.
Erbrechen und Durchfall waren die am häufigsten berichteten Nebenwirkungen, die bei mit LEVAQUIN® behandelten und nicht mit Fluorchinolon behandelten pädiatrischen Patienten mit ähnlicher Häufigkeit auftraten.
Zusätzlich zu den Nebenwirkungen, die bei pädiatrischen Patienten in klinischen Studien berichtet wurden, wurden Nebenwirkungen, die bei Erwachsenen während klinischer Studien oder Erfahrungen nach Markteinführung berichtet wurden [siehe NEBENWIRKUNGEN ] kann auch bei pädiatrischen Patienten auftreten.
Geriatrische Verwendung
Geriatrische Patienten haben ein erhöhtes Risiko für die Entwicklung schwerer Sehnenerkrankungen einschließlich Sehnenriss, wenn sie mit einem Fluorchinolon wie LEVAQUIN® behandelt werden. Dieses Risiko ist bei Patienten, die gleichzeitig eine Kortikosteroidtherapie erhalten, weiter erhöht. Tendinitis oder Sehnenruptur können die Achillessehne, Hand, Schulter oder andere Sehnenstellen betreffen und während oder nach Abschluss der Therapie auftreten; Fälle, die bis zu mehrere Monate nach der Behandlung mit Fluorchinolonen auftraten, wurden berichtet. Vorsicht ist geboten, wenn LEVAQUIN® älteren Patienten verschrieben wird, insbesondere solchen, die Kortikosteroide einnehmen. Die Patienten sollten über diese mögliche Nebenwirkung informiert und angewiesen werden, LEVAQUIN® abzusetzen und sich an ihren Arzt zu wenden, wenn Symptome einer Tendinitis oder eines Sehnenrisses auftreten [siehe KASTENWARNUNG ; WARNUNGEN UND VORSICHTSMASSNAHMEN ; und NEBENWIRKUNGEN ].
In klinischen Studien der Phase 3 waren 1.945 mit LEVAQUIN® behandelte Patienten (26 %) ≥ 65 Jahre alt. Davon waren 1.081 Patienten (14 %) zwischen 65 und 74 Jahre alt und 864 Patienten (12 %) waren 75 Jahre oder älter. Insgesamt wurden keine Unterschiede in der Sicherheit oder Wirksamkeit zwischen diesen Probanden und jüngeren Probanden beobachtet, aber eine größere Empfindlichkeit einiger älterer Personen kann nicht ausgeschlossen werden.
Schwere und manchmal tödliche Fälle von Hepatotoxizität wurden nach der Markteinführung im Zusammenhang mit LEVAQUIN® gemeldet. Die Mehrzahl der Berichte über tödliche Hepatotoxizität trat bei Patienten auf, die 65 Jahre oder älter waren, und die meisten waren nicht mit Überempfindlichkeit verbunden. LEVAQUIN® sollte sofort abgesetzt werden, wenn der Patient Anzeichen und Symptome einer Hepatitis entwickelt [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Ältere Patienten können anfälliger für arzneimittelbedingte Wirkungen auf das QT-Intervall sein. Daher ist Vorsicht geboten, wenn LEVAQUIN® gleichzeitig mit Arzneimitteln angewendet wird, die zu einer Verlängerung des QT-Intervalls führen können (z. B. Antiarrhythmika der Klasse IA oder Klasse III) oder bei Patienten mit Risikofaktoren für Torsade de Pointes (z. B. bekannte QT-Verlängerung, unkorrigiert). Hypokaliämie) [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Die pharmakokinetischen Eigenschaften von Levofloxacin bei jüngeren Erwachsenen und älteren Erwachsenen unterscheiden sich nicht signifikant, wenn die Kreatinin-Clearance berücksichtigt wird. Da jedoch bekannt ist, dass das Medikament im Wesentlichen über die Nieren ausgeschieden wird, kann das Risiko toxischer Reaktionen auf dieses Medikament bei Patienten mit eingeschränkter Nierenfunktion größer sein. Da ältere Patienten eher eine eingeschränkte Nierenfunktion haben, sollte die Dosis sorgfältig ausgewählt werden und es kann sinnvoll sein, die Nierenfunktion zu überwachen [siehe KLINISCHE PHARMAKOLOGIE ].
Nierenfunktionsstörung
Bei Patienten mit eingeschränkter Nierenfunktion (Kreatinin-Clearance DOSIERUNG UND ANWENDUNG ].
Leberfunktionsstörung
Pharmakokinetische Studien bei Patienten mit eingeschränkter Leberfunktion wurden nicht durchgeführt. Aufgrund des begrenzten Metabolismus von Levofloxacin ist nicht zu erwarten, dass die Pharmakokinetik von Levofloxacin durch eine eingeschränkte Leberfunktion beeinflusst wird.
ÜBERDOSIS
Im Falle einer akuten Überdosierung sollte der Magen entleert werden. Der Patient sollte beobachtet und für eine angemessene Flüssigkeitszufuhr gesorgt werden. Levofloxacin wird durch Hämodialyse oder Peritonealdialyse nicht effizient entfernt.
LEVAQUIN® weist ein geringes Potenzial für akute Toxizität auf. Mäuse, Ratten, Hunde und Affen zeigten nach Verabreichung einer hohen Einzeldosis LEVAQUIN® die folgenden klinischen Symptome: Ataxie, Ptosis, verringerte Bewegungsaktivität, Dyspnoe, Erschöpfung, Zittern und Krämpfe. Dosen von mehr als 1500 mg/kg oral und 250 mg/kg intravenös führten zu einer signifikanten Sterblichkeit bei Nagetieren.
KONTRAINDIKATIONEN
LEVAQUIN® ist kontraindiziert bei Personen mit bekannter Überempfindlichkeit gegenüber Levofloxacin oder anderen Chinolon-Antibiotika [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Levofloxacin ist ein Mitglied der Fluorchinolon-Klasse antibakterieller Wirkstoffe [ siehe Mikrobiologie ].
Pharmakokinetik
Die mittleren ± Standardabweichung der pharmakokinetischen Parameter von Levofloxacin, bestimmt unter Einzel- und Steady-State-Bedingungen nach Verabreichung der oralen Tabletten, sind in Tabelle 8 zusammengefasst.
Die Pharmakokinetik von Levofloxacin ist nach einmaliger und mehrfacher oraler oder intravenöser Gabe linear und vorhersagbar. Steady-State-Bedingungen werden innerhalb von 48 Stunden nach einem Dosierungsschema von 500 mg oder 750 mg einmal täglich erreicht. Die mittleren ± SD Spitzen- und Talplasmakonzentrationen, die nach mehreren einmal täglichen oralen Dosierungsschemata erreicht wurden, betrugen ungefähr 5,7 ± 1,4 und 0,5 ± 0,2 µg/ml nach den 500-mg-Dosen und 8,6 ± 1,9 und 1,1 ± 0,4 µg/ml nach den 750 mg mg-Dosen bzw. Die mittleren Spitzen- und Talspiegel im Plasma ± Standardabweichung, die nach mehreren einmal täglichen IV-Schemata erreicht wurden, betrugen ungefähr 6,4 ± 0,8 und 0,6 ± 0,2 µg/ml nach den 500-mg-Dosen und 12,1 ± 4,1 und 1,3 ± 0,71 µg/ml nach den 750-mg-Dosen Dosen bzw.
Absorption
Levofloxacin wird nach oraler Verabreichung schnell und im Wesentlichen vollständig resorbiert. Maximale Plasmakonzentrationen werden in der Regel ein bis zwei Stunden nach oraler Einnahme erreicht. Die absolute Bioverfügbarkeit von Levofloxacin aus einer 500-mg-Tablette und einer 750-mg-Tablette LEVAQUIN® beträgt beide etwa 99 %, was die vollständige orale Resorption von Levofloxacin zeigt. Nach einer intravenösen Einzeldosis von LEVAQUIN® an gesunde Probanden betrug die erreichte mittlere ± SD-Spitzenplasmakonzentration 6,2 ± 1,0 µg/ml nach einer über 60 Minuten infundierten 500-mg-Dosis und 11,5 ± 4,0 µg/ml nach einer über 60-minütigen Infusion einer 750-mg-Dosis 90 Minuten. Die orale Verabreichung einer Dosis von 500 mg LEVAQUIN® mit Nahrung verlängert die Zeit bis zum Erreichen der Spitzenkonzentration um etwa 1 Stunde und verringert die Spitzenkonzentration um etwa 14 % nach der Tablette und um etwa 25 % nach der Verabreichung der Lösung zum Einnehmen. Daher können LEVAQUIN® Tabletten unabhängig von der Nahrung verabreicht werden.
Das Plasmakonzentrationsprofil von Levofloxacin nach intravenöser Verabreichung ist ähnlich und hinsichtlich des Ausmaßes der Exposition (AUC) vergleichbar mit dem, das für LEVAQUIN®-Tabletten beobachtet wird, wenn gleiche Dosen (mg/mg) verabreicht werden. Daher können die oralen und intravenösen Verabreichungswege als austauschbar betrachtet werden.
Verteilung
Das mittlere Verteilungsvolumen von Levofloxacin liegt im Allgemeinen zwischen 74 und 112 l nach Einzel- und Mehrfachdosen von 500 mg oder 750 mg, was auf eine weite Verteilung im Körpergewebe hinweist. Levofloxacin erreicht seine Spitzenwerte im Hautgewebe und in der Blasenflüssigkeit gesunder Probanden etwa 3 Stunden nach der Einnahme. Das Verhältnis von Hautgewebebiopsie zu Plasma-AUC beträgt etwa 2 und das Verhältnis von Blasenflüssigkeit zu Plasma-AUC etwa 1 nach mehrfacher oraler Verabreichung von 750 mg bzw. 500 mg LEVAQUIN® einmal täglich an gesunde Probanden. Levofloxacin dringt auch gut in das Lungengewebe ein. Die Konzentrationen im Lungengewebe waren im Allgemeinen 2- bis 5-mal höher als die Plasmakonzentrationen und lagen im Bereich von etwa 2,4 bis 11,3 Mikrogramm/g über einen Zeitraum von 24 Stunden nach einer oralen Einzeldosis von 500 mg.
In vitro ist Levofloxacin über einen klinisch relevanten Bereich (1 bis 10 µg/ml) von Serum-/Plasma-Levofloxacin-Konzentrationen bei allen untersuchten Spezies zu ungefähr 24 bis 38 % an Serumproteine gebunden, wie durch die Gleichgewichtsdialysemethode bestimmt. Levofloxacin wird beim Menschen hauptsächlich an Serumalbumin gebunden. Die Bindung von Levofloxacin an Serumproteine ist unabhängig von der Wirkstoffkonzentration.
Beseitigung
Stoffwechsel
Levofloxacin ist in Plasma und Urin stereochemisch stabil und wird metabolisch nicht in sein Enantiomer D-Ofloxacin umgewandelt. Levofloxacin unterliegt beim Menschen einem begrenzten Metabolismus und wird hauptsächlich als unveränderter Wirkstoff im Urin ausgeschieden. Nach oraler Verabreichung wurden etwa 87 % einer verabreichten Dosis innerhalb von 48 Stunden als unveränderter Wirkstoff im Urin wiedergefunden, während weniger als 4 % der Dosis innerhalb von 72 Stunden im Stuhl wiedergefunden wurden. Weniger als 5 % einer verabreichten Dosis wurden im Urin als Desmethyl- und N-Oxid-Metabolite wiedergefunden, die einzigen Metaboliten, die beim Menschen identifiziert wurden. Diese Metaboliten haben eine geringe relevante pharmakologische Aktivität.
Ausscheidung
Levofloxacin wird größtenteils unverändert im Urin ausgeschieden. Die mittlere terminale Eliminationshalbwertszeit von Levofloxacin aus dem Plasma beträgt etwa 6 bis 8 Stunden nach oraler oder intravenöser Einzel- oder Mehrfachgabe von Levofloxacin. Die mittlere scheinbare Gesamtkörperclearance und die renale Clearance liegen im Bereich von etwa 144 bis 226 ml/min bzw. 96 bis 142 ml/min. Eine renale Clearance, die die glomeruläre Filtrationsrate übersteigt, deutet darauf hin, dass eine tubuläre Sekretion von Levofloxacin zusätzlich zu seiner glomerulären Filtration erfolgt. Die gleichzeitige Verabreichung von entweder Cimetidin oder Probenecid führt zu einer Verringerung der renalen Clearance von Levofloxacin um etwa 24 % bzw. 35 %, was darauf hindeutet, dass die Sekretion von Levofloxacin in den proximalen Tubulus der Niere erfolgt. In keiner der frisch gesammelten Urinproben von Personen, die LEVAQUIN® erhielten, wurden keine Levofloxacin-Kristalle gefunden.
Spezifische Populationen
Geriatrische Patienten
Es gibt keine signifikanten Unterschiede in der Pharmakokinetik von Levofloxacin zwischen jungen und älteren Probanden, wenn die Probanden' Unterschiede in der Kreatinin-Clearance werden berücksichtigt. Nach einer oralen Dosis von 500 mg LEVAQUIN® bei gesunden älteren Probanden (66–80 Jahre) betrug die mittlere terminale Eliminationshalbwertszeit von Levofloxacin aus dem Plasma etwa 7,6 Stunden im Vergleich zu etwa 6 Stunden bei jüngeren Erwachsenen. Der Unterschied war auf die Variation des Nierenfunktionsstatus der Probanden zurückzuführen und wurde nicht als klinisch signifikant angesehen. Die Medikamentenabsorption scheint vom Alter unbeeinflusst zu sein. Eine Dosisanpassung von LEVAQUIN® allein aufgrund des Alters ist nicht erforderlich [vgl Verwendung in bestimmten Bevölkerungsgruppen ].
Pädiatrische Patienten
Die Pharmakokinetik von Levofloxacin nach einer intravenösen Einzeldosis von 7 mg/kg wurde bei pädiatrischen Patienten im Alter von 6 Monaten bis 16 Jahren untersucht. Pädiatrische Patienten schieden Levofloxacin schneller aus als erwachsene Patienten, was bei einer gegebenen mg/kg-Dosis zu niedrigeren Plasmaspiegeln führte als Erwachsene. Nachfolgende pharmakokinetische Analysen prognostizierten, dass ein Dosierungsschema von 8 mg/kg alle 12 Stunden (das 250 mg pro Dosis nicht überschreiten sollte) bei pädiatrischen Patienten im Alter von 6 Monaten bis 17 Jahren vergleichbare Steady-State-Plasmaspiegel (AUC0-24 und Cmax) erreichen würde diejenigen, die bei erwachsenen Patienten beobachtet wurden, denen 500 mg Levofloxacin einmal alle 24 Stunden verabreicht wurden. LEVAQUIN® Tabletten können aufgrund der Einschränkungen der verfügbaren Stärken nur pädiatrischen Patienten mit Lungenmilzbrand (nach Exposition) oder Pest verabreicht werden, die 30 kg oder mehr wiegen [siehe DOSIERUNG UND ANWENDUNG ].
Männliche und weibliche Probanden
Es gibt keine signifikanten Unterschiede in der Pharmakokinetik von Levofloxacin zwischen männlichen und weiblichen Probanden, wenn die Probanden' Unterschiede in der Kreatinin-Clearance werden berücksichtigt. Nach einer oralen Dosis von 500 mg LEVAQUIN® an gesunde männliche Probanden betrug die mittlere terminale Eliminationshalbwertszeit von Levofloxacin aus dem Plasma etwa 7,5 Stunden im Vergleich zu etwa 6,1 Stunden bei weiblichen Probanden. Dieser Unterschied war auf die Unterschiede im Nierenfunktionsstatus der männlichen und weiblichen Probanden zurückzuführen und wurde nicht als klinisch signifikant angesehen. Die Arzneimittelabsorption scheint vom Geschlecht der Probanden unbeeinflusst zu sein. Eine Dosisanpassung allein aufgrund des Geschlechts ist nicht erforderlich.
Rassen- oder ethnische Gruppen
Die Auswirkung der ethnischen Zugehörigkeit auf die Pharmakokinetik von Levofloxacin wurde durch eine Kovariatenanalyse untersucht, die an den Daten von 72 Probanden durchgeführt wurde: 48 weiße und 24 nicht weiße. Die scheinbare Gesamtkörperclearance und das scheinbare Verteilungsvolumen wurden durch die Rasse der Probanden nicht beeinflusst.
Patienten mit eingeschränkter Nierenfunktion
Bei erwachsenen Patienten mit eingeschränkter Nierenfunktion (Kreatinin-Clearance DOSIERUNG UND ANWENDUNG und Verwendung in bestimmten Bevölkerungsgruppen ].
Patienten mit eingeschränkter Leberfunktion
Pharmakokinetische Studien bei Patienten mit eingeschränkter Leberfunktion wurden nicht durchgeführt. Aufgrund des begrenzten Metabolismus von Levofloxacin ist nicht zu erwarten, dass die Pharmakokinetik von Levofloxacin durch eine Leberfunktionsstörung beeinflusst wird [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Patienten mit bakterieller Infektion
Die Pharmakokinetik von Levofloxacin bei Patienten mit schweren ambulant erworbenen bakteriellen Infektionen ist mit der bei gesunden Probanden beobachteten vergleichbar.
Arzneimittelwechselwirkungsstudien
Das Potenzial für pharmakokinetische Arzneimittelwechselwirkungen zwischen LEVAQUIN® und Antazida, Warfarin, Theophyllin, Cyclosporin, Digoxin, Probenecid und Cimetidin wurde bewertet [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Mikrobiologie
Wirkmechanismus
Levofloxacin ist das L-Isomer des Racemats Ofloxacin, einem Chinolon-Antibiotikum. Die antibakterielle Aktivität von Ofloxacin beruht hauptsächlich auf dem L-Isomer. Der Wirkungsmechanismus von Levofloxacin und anderen Fluorchinolon-Antimikrobiotika umfasst die Hemmung der bakteriellen Topoisomerase IV und der DNA-Gyrase (beide Topoisomerasen vom Typ II), Enzyme, die für die DNA-Replikation, -Transkription, -Reparatur und -Rekombination erforderlich sind.
Widerstand
Fluorchinolon-Resistenz kann durch Mutationen in definierten Regionen der DNA-Gyrase oder Topoisomerase IV entstehen, die als Quinolon-Resistenz-bestimmende Regionen (QRDRs) bezeichnet werden, oder durch veränderten Efflux.
Fluorchinolone, einschließlich Levofloxacin, unterscheiden sich in chemischer Struktur und Wirkungsweise von Aminoglykosiden, Makroliden und β-Lactam-Antibiotika, einschließlich Penicillinen. Fluorchinolone können daher gegen Bakterien wirksam sein, die gegen diese antimikrobiellen Mittel resistent sind.
Eine Resistenz gegen Levofloxacin aufgrund einer spontanen Mutation in vitro tritt selten auf (Bereich: 10-9 bis 10-10). Kreuzresistenz wurde zwischen Levofloxacin und einigen anderen Fluorchinolonen beobachtet, einige Mikroorganismen, die gegen andere Fluorchinolone resistent sind, können gegenüber Levofloxacin empfindlich sein.
Antimikrobielle Aktivität
Levofloxacin wirkt in vitro gegen gramnegative und grampositive Bakterien.
Es wurde gezeigt, dass Levofloxacin gegen die meisten Isolate der folgenden Bakterien sowohl in vitro als auch bei klinischen Infektionen aktiv ist, wie in siehe beschrieben INDIKATIONEN :
Aerobe Bakterien
Gram-positive Bakterien
Enterococcus faecalisStaphylococcus aureus (Methicillin-empfindliche Isolate)Staphylococcus epidermidis (Methicillin-empfindliche Isolate)Staphylococcus saprophyticusStreptococcus pneumoniae (einschließlich multiresistenter Isolate [MDRSP]1)Streptococcus pyogenes
Gramnegative Bakterien
Enterobacter cloacaeEscherichia coliHaemophilus influenzaeHaemophilus parainfluenzaeKlebsiella pneumoniaeLegionella pneumophilaMoraxella catarrhalisProteus mirabilisPseudomonas aeruginosaSerratia marcescens
Andere Mikroorganismen
Chlamydophila pneumoniaeMycoplasma pneumoniae
Die folgenden In-vitro-Daten sind verfügbar, aber ihre klinische Bedeutung ist unbekannt: Levofloxacin weist in vitro minimale Hemmkonzentrationen (MHK-Werte) von 2 µg/ml oder weniger gegen die meisten (≥90 %) Isolate der folgenden Mikroorganismen auf; Die Sicherheit und Wirksamkeit von LEVAQUIN® bei der Behandlung klinischer Infektionen durch diese Bakterien wurden jedoch nicht in angemessenen und gut kontrollierten klinischen Studien nachgewiesen.
MDRSP-Isolate (multiresistenter Streptococcus pneumoniae) sind Isolate, die gegen zwei oder mehr der folgenden Antibiotika resistent sind: Penicillin (MHK ≥ 2 µg/ml), Cephalosporine der 2. Generation, z. B. Cefuroxim; Makrolide, Tetracycline und Trimethoprim/Sulfamethoxazol.
Aerobe Bakterien
Gram-positive Bakterien
Staphylococcus haemolyticusβ-hämolytischer Streptococcus (Gruppe C/F)β-hämolytischer Streptococcus (Gruppe G)Streptococcus agalactiaeStreptococcus milleriStreptokokken der Viridans-GruppeBacillus anthracis
Gramnegative Bakterien
Acinetobacter baumanniiAcinetobacter lwoffiiBordetella pertussisCitrobacter koseriCitrobacter freundiiEnterobacter aerogenesEnterobacter sakazakiiKlebsiella oxytocaMorganella morganiiPantoea agglomeransProteus vulgarisProvidencia rettgeriProvidencia stuartiiPseudomonas fluorescensYersinia pestis
Anaerobe Bakterien
Gram-positive Bakterien
Clostridium perfringens
Empfindlichkeitstests
Spezifische Informationen zu den Interpretationskriterien von Empfindlichkeitstests und den zugehörigen Testmethoden und Qualitätskontrollstandards, die von der FDA für dieses Medikament anerkannt sind, finden Sie unter: https://www.fda.gov/STIC.
Tiertoxikologie und/oder Pharmakologie
Es wurde gezeigt, dass Levofloxacin und andere Chinolone bei unreifen Tieren der meisten getesteten Arten Arthropathie verursachen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Bei unreifen Hunden (4–5 Monate alt) führten orale Dosen von 10 mg/kg/Tag für 7 Tage und intravenöse Dosen von 4 mg/kg/Tag für 14 Tage von Levofloxacin zu arthropathischen Läsionen. Die Verabreichung von oralen Dosen von 300 mg/kg/Tag über 7 Tage und intravenöse Dosen von 60 mg/kg/Tag über 4 Wochen führte bei juvenilen Ratten zu Arthropathie. Drei Monate alte Beagle-Hunde, denen Levofloxacin in einer Dosierung von 40 mg/kg/Tag oral verabreicht wurde, zeigten eine klinisch schwere Arthrotoxizität, die zu einem Behandlungsabbruch an Tag 8 einer 14-tägigen Dosierungsroutine führte. Leichte muskuloskelettale klinische Wirkungen ohne grobe pathologische oder histopathologische Wirkungen resultierten aus der niedrigsten Dosis von 2,5 mg/kg/Tag (etwa das 0,2-fache der pädiatrischen Dosis, basierend auf AUC-Vergleichen). Synovitis und Läsionen des Gelenkknorpels wurden bei Dosierungen von 10 und 40 mg/kg beobachtet (etwa das 0,7-fache bzw. 2,4-fache der pädiatrischen Dosis, basierend auf AUC-Vergleichen). Die makroskopische Pathologie und Histopathologie des Gelenkknorpels blieb bis zum Ende der 18-wöchigen Erholungsphase bei den Hunden ab den Dosisniveaus von 10 und 40 mg/kg/Tag bestehen.
Beim Testen in einem Bioassay zum Anschwellen des Mausohrs zeigte Levofloxacin eine ähnliche Phototoxizität wie Ofloxacin, aber eine geringere Phototoxizität als andere Chinolone.
Während bei einigen intravenösen Rattenstudien Kristallurie beobachtet wurde, werden Harnkristalle nicht in der Blase gebildet, da sie nur nach dem Wasserlassen vorhanden sind und nicht mit Nephrotoxizität in Verbindung gebracht werden.
Bei Mäusen wird die ZNS-stimulierende Wirkung von Chinolonen durch die gleichzeitige Verabreichung von nichtsteroidalen entzündungshemmenden Arzneimitteln verstärkt.
Bei Hunden führte Levofloxacin, verabreicht in einer Dosis von 6 mg/kg oder höher, durch schnelle intravenöse Injektion zu blutdrucksenkenden Wirkungen. Es wurde angenommen, dass diese Effekte mit der Histaminfreisetzung zusammenhängen.
In-vitro- und In-vivo-Studien an Tieren weisen darauf hin, dass Levofloxacin im therapeutischen Plasmakonzentrationsbereich beim Menschen weder ein Enzyminduktor noch ein Inhibitor ist; Daher sind keine Wechselwirkungen mit anderen Arzneimitteln oder Wirkstoffen im Zusammenhang mit Arzneimittel-metabolisierenden Enzymen zu erwarten.
Klinische Studien
Nosokomiale Pneumonie
Erwachsene Patienten mit klinisch und radiologisch dokumentierter nosokomialer Pneumonie wurden in eine multizentrische, randomisierte, offene Studie aufgenommen, in der intravenöses LEVAQUIN® (750 mg einmal täglich) gefolgt von oralem LEVAQUIN® (750 mg einmal täglich) über insgesamt 7–15 Tage verglichen wurde auf intravenöses Imipenem/Cilastatin (500–1000 mg alle 6–8 Stunden täglich), gefolgt von oralem Ciprofloxacin (750 mg alle 12 Stunden täglich) für insgesamt 7–15 Tage. Mit LEVAQUIN® behandelte Patienten erhielten durchschnittlich 7 Tage intravenöse Therapie (Bereich: 1–16 Tage); Die mit dem Vergleichspräparat behandelten Patienten erhielten durchschnittlich 8 Tage intravenöse Therapie (Bereich: 1–19 Tage).
Insgesamt wurde in der klinisch und mikrobiologisch auswertbaren Population bei Studieneintritt bei 56 von 93 (60,2 %) Patienten im LEVAQUIN®-Arm und bei 53 von 94 (56,4 %) Patienten im Vergleichsarm eine Zusatztherapie empirisch eingeleitet. Die durchschnittliche Dauer der Begleittherapie betrug 7 Tage im LEVAQUIN®-Arm und 7 Tage im Vergleichsarm. Bei klinisch und mikrobiologisch auswertbaren Patienten mit dokumentierter Pseudomonas-aeruginosa-Infektion erhielten 15 von 17 (88,2 %) Ceftazidim (N = 11) oder Piperacillin/Tazobactam (N = 4) im LEVAQUIN®-Arm und 16 von 17 (94,1 %) erhielten eine Aminoglykosid im Vergleichsarm. Insgesamt wurde bei klinisch und mikrobiologisch auswertbaren Patienten Vancomycin zum Behandlungsschema von 37 von 93 (39,8 %) Patienten im LEVAQUIN®-Arm und 28 von 94 (29,8 %) Patienten im Vergleichsarm mit Verdacht auf Methicillin-resistente S. aureus-Infektion.
Klinische Erfolgsraten bei klinisch und mikrobiologisch auswertbaren Patienten bei der Visite nach der Therapie (primärer Studienendpunkt, bewertet an Tag 3–15 nach Abschluss der Therapie) betrugen 58,1 % für LEVAQUIN® und 60,6 % für das Vergleichspräparat. Das 95 %-KI für die Differenz der Ansprechraten (LEVAQUIN® minus Vergleichspräparat) betrug [-17,2, 12,0]. Die mikrobiologischen Eradikationsraten beim Besuch nach der Therapie betrugen 66,7 % für LEVAQUIN® und 60,6 % für das Vergleichspräparat. Das 95 %-KI für die Differenz der Eradikationsraten (LEVAQUIN® minus Vergleichssubstanz) betrug [-8,3, 20,3]. Klinischer Erfolg und mikrobiologische Eradikationsraten nach Pathogen sind in Tabelle 9 aufgeführt.
Ambulant erworbene Pneumonie
7- bis 14-tägiges Behandlungsschema
Erwachsene stationäre und ambulante Patienten mit der Diagnose einer ambulant erworbenen bakteriellen Pneumonie wurden in 2 zulassungsrelevanten klinischen Studien untersucht. In der ersten Studie wurden 590 Patienten in eine prospektive, multizentrische, unverblindete, randomisierte Studie aufgenommen, in der LEVAQUIN® 500 mg einmal täglich oral oder intravenös über 7 bis 14 Tage mit Ceftriaxon 1 bis 2 g intravenös einmal oder in gleichen Dosen zweimal täglich verglichen wurde gefolgt von Cefuroximaxetil 500 mg p.o. zweimal täglich für insgesamt 7 bis 14 Tage. Patienten, die der Behandlung mit dem Kontrollregime zugewiesen wurden, durften Erythromycin (oder Doxycyclin bei Unverträglichkeit von Erythromycin) erhalten, wenn eine Infektion durch atypische Erreger vermutet oder nachgewiesen wurde. Klinische und mikrobiologische Untersuchungen wurden während der Behandlung, 5 bis 7 Tage nach der Therapie und 3 bis 4 Wochen nach der Therapie durchgeführt. Der klinische Erfolg (Heilung plus Verbesserung) mit LEVAQUIN® 5 bis 7 Tage nach der Therapie, die primäre Wirksamkeitsvariable in dieser Studie, war der Kontrollgruppe (83 %) überlegen (95 %). Das 95 %-KI für die Differenz der Ansprechraten (LEVAQUIN® minus Vergleichspräparat) betrug [-6, 19]. In die zweite Studie wurden 264 Patienten in eine prospektive, multizentrische, nicht vergleichende Studie mit 500 mg LEVAQUIN® aufgenommen, die einmal täglich über 7 bis 14 Tage oral oder intravenös verabreicht wurde. Der klinische Erfolg für klinisch auswertbare Patienten betrug 93 %. Für beide Studien betrug die klinische Erfolgsrate bei Patienten mit atypischer Lungenentzündung aufgrund von Chlamydophila pneumoniae, Mycoplasma pneumoniae und Legionella pneumophila 96 %, 96 % bzw. 70 %. Die mikrobiologischen Eradikationsraten beider Studien sind in Tabelle 10 dargestellt.
Ambulant erworbene Pneumonie durch multiresistenten Streptococcus pneumoniae
LEVAQUIN® war wirksam bei der Behandlung von ambulant erworbener Lungenentzündung, die durch multiresistenten Streptococcus pneumoniae (MDRSP) verursacht wurde. MDRSP-Isolate sind Isolate, die gegen zwei oder mehr der folgenden Antibiotika resistent sind: Penicillin (MHK ≥ 2 µg/ml), Cephalosporine der 2. Generation (z. B. Cefuroxim, Makrolide, Tetracycline und Trimethoprim/Sulfamethoxazol). Von 40 mikrobiologisch auswertbaren Patienten mit MDRSP-Isolaten erzielten 38 Patienten (95,0 %) nach der Therapie einen klinischen und bakteriologischen Erfolg. Die klinischen und bakteriellen Erfolgsraten sind in Tabelle 11 dargestellt.
Nicht alle Isolate waren gegen alle getesteten antimikrobiellen Klassen resistent. Erfolgs- und Eradikationsraten sind in Tabelle 12 zusammengefasst.
Ambulant erworbene Pneumonie
5-tägiges Behandlungsschema
Um die Sicherheit und Wirksamkeit der höheren Dosis und kürzeren Behandlungsdauer von LEVAQUIN® zu bewerten, wurden 528 ambulante und stationäre Erwachsene mit klinisch und radiologisch festgestellter leichter bis schwerer ambulant erworbener Pneumonie in einer doppelblinden, randomisierten, prospektiven, multizentrischen Studie zum Vergleich von LEVAQUIN untersucht ® 750 mg, IV oder oral, jeden Tag für fünf Tage oder LEVAQUIN® 500 mg IV oder oral, jeden Tag für 10 Tage.
Die klinischen Erfolgsraten (Heilung plus Verbesserung) in der klinisch auswertbaren Population betrugen 90,9 % in der LEVAQUIN® 750 mg-Gruppe und 91,1 % in der LEVAQUIN® 500 mg-Gruppe. Das 95 %-KI für die Differenz der Ansprechraten (LEVAQUIN® 750 minus LEVAQUIN® 500) betrug [-5,9, 5,4]. In der klinisch auswertbaren Population (31–38 Tage nach Aufnahme) wurde bei 7 von 151 Patienten in der LEVAQUIN® 750 mg-Gruppe und bei 2 von 147 Patienten in der LEVAQUIN® 500 mg-Gruppe eine Pneumonie beobachtet. Angesichts der geringen beobachteten Zahlen kann die Signifikanz dieses Befunds statistisch nicht bestimmt werden. Die mikrobiologische Wirksamkeit des 5-Tages-Regimes wurde für die in Tabelle 13 aufgeführten Infektionen dokumentiert.
Akute bakterielle Sinusitis
5-tägige und 10–14-tägige Behandlungsschemata
LEVAQUIN® ist für die Behandlung von akuter bakterieller Sinusitis (ABS) mit entweder 750 mg oral × 5 Tage oder 500 mg oral einmal täglich × 10–14 Tage zugelassen. Um die Sicherheit und Wirksamkeit einer hochdosierten Kurzbehandlung mit LEVAQUIN® zu bewerten, wurden 780 ambulante Erwachsene mit klinisch und radiologisch festgestellter akuter bakterieller Sinusitis in einer doppelblinden, randomisierten, prospektiven, multizentrischen Studie untersucht, in der LEVAQUIN® 750 mg einmal täglich zum Einnehmen verglichen wurde für fünf Tage auf LEVAQUIN® 500 mg einmal täglich für 10 Tage.
Klinische Erfolgsraten (definiert als vollständiges oder teilweises Verschwinden der Anzeichen und Symptome von ABS vor der Behandlung in einem solchen Ausmaß, dass keine weitere Antibiotikabehandlung als notwendig erachtet wurde) in der mikrobiologisch auswertbaren Population betrugen 91,4 % (139/152) bei LEVAQUIN® 750-mg-Gruppe und 88,6 % (132/149) in der LEVAQUIN® 500-mg-Gruppe beim Test-of-Cure (TOC)-Besuch (95 % KI [-4,2; 10,0] für LEVAQUIN® 750 mg minus LEVAQUIN® 500 mg) .
Die Raten des klinischen Erfolgs nach Erregern in der mikrobiologisch auswertbaren Population, deren Proben bei Eintritt in die Studie durch Antrumpunktion entnommen wurden, zeigten vergleichbare Ergebnisse für die 5- und 10-tägigen Behandlungsschemata beim Test-of-Cure-Besuch 22 Tage nach der Behandlung (siehe Tabelle 14). .
Komplizierte Haut- und Hautstrukturinfektionen
399 Patienten wurden in eine unverblindete, randomisierte Vergleichsstudie zu komplizierten Haut- und Hautstrukturinfektionen aufgenommen. Die Patienten wurden randomisiert und erhielten entweder LEVAQUIN® 750 mg einmal täglich (i.v. gefolgt von oral) oder ein zugelassenes Vergleichspräparat für einen Median von 10 ± 4,7 Tagen. Wie bei komplizierten Haut- und Hautstrukturinfektionen zu erwarten, wurden chirurgische Eingriffe in der LEVAQUIN®- und der Vergleichsgruppe durchgeführt. Eine Operation (Inzision und Drainage oder Debridement) wurde bei 45 % der mit LEVAQUIN® behandelten Patienten und 44 % der mit dem Vergleichspräparat behandelten Patienten entweder kurz vor oder während der Antibiotikabehandlung durchgeführt und bildete einen integralen Bestandteil der Therapie für diese Indikation.
Unter denjenigen, die 2–5 Tage nach Abschluss der Studienmedikation klinisch bewertet werden konnten, betrugen die Gesamterfolgsraten (Verbesserung oder Heilung) 116/138 (84,1 %) für die mit LEVAQUIN® behandelten Patienten und 106/132 (80,3 %) für die behandelten Patienten mit dem Komparator.
Die Erfolgsraten variierten mit der Art der Diagnose und reichten von 68 % bei Patienten mit infizierten Geschwüren bis zu 90 % bei Patienten mit infizierten Wunden und Abszessen. Diese Raten entsprachen denen, die bei Vergleichsarzneimitteln beobachtet wurden.
Chronische bakterielle Prostatitis
Erwachsene Patienten mit einer klinischen Diagnose von Prostatitis und mikrobiologischen Kulturergebnissen aus Urinproben, die nach einer Prostatamassage (VB3) entnommen wurden, oder Proben von exprimiertem Prostatasekret (EPS), die über das Meares-Stamey-Verfahren gewonnen wurden, wurden in eine multizentrische, randomisierte, doppelblinde Vergleichsstudie aufgenommen orales LEVAQUIN® 500 mg, einmal täglich für insgesamt 28 Tage zu oralem Ciprofloxacin 500 mg, zweimal täglich für insgesamt 28 Tage. Der primäre Wirksamkeitsendpunkt war die mikrobiologische Wirksamkeit bei mikrobiologisch auswertbaren Patienten. Insgesamt 136 bzw. 125 mikrobiologisch auswertbare Patienten wurden in die LEVAQUIN®- bzw. Ciprofloxacin-Gruppe aufgenommen. Die mikrobiologische Eradikationsrate durch Patienteninfektion 5–18 Tage nach Abschluss der Therapie betrug 75,0 % in der LEVAQUIN®-Gruppe und 76,8 % in der Ciprofloxacin-Gruppe (95 %-KI [-12,58; 8,98] für LEVAQUIN® minus Ciprofloxacin). Die Gesamtausrottungsraten für interessierende Krankheitserreger sind in Tabelle 15 dargestellt.
Die Eradikationsraten für S. epidermidis, wenn sie zusammen mit anderen Co-Pathogenen gefunden werden, stimmen mit den Raten überein, die bei reinen Isolaten beobachtet wurden.
Klinische Erfolgsraten (Heilung + Verbesserung ohne Notwendigkeit einer weiteren Antibiotikatherapie) in einer mikrobiologisch auswertbaren Population 5–18 Tage nach Abschluss der Therapie betrugen 75,0 % für mit LEVAQUIN® behandelte Patienten und 72,8 % für mit Ciprofloxacin behandelte Patienten (95 % KI [- 8,87, 13,27] für LEVAQUIN® minus Ciprofloxacin). Klinische Langzeiterfolgsraten (24–45 Tage nach Abschluss der Therapie) betrugen 66,7 % für die mit LEVAQUIN® behandelten Patienten und 76,9 % für die mit Ciprofloxacin behandelten Patienten (95 % KI [-23,40; 2,89] für LEVAQUIN® minus Ciprofloxacin).
Komplizierte Harnwegsinfektionen und akute Pyelonephritis
5-tägiges Behandlungsschema
Um die Sicherheit und Wirksamkeit der höheren Dosis und des kürzeren Verlaufs von LEVAQUIN® zu bewerten, wurden 1109 Patienten mit cUTI und AP in eine randomisierte, doppelblinde, multizentrische klinische Studie aufgenommen, die in den USA von November 2004 bis April 2006 zum Vergleich von LEVAQUIN® 750 durchgeführt wurde mg i.v. oder einmal täglich p.o. für 5 Tage (546 Patienten) mit Ciprofloxacin 400 mg i.v. oder 500 mg p.o. zweimal täglich für 10 Tage (563 Patienten). Patienten mit AP, die durch zugrunde liegende Nierenerkrankungen oder Zustände wie vollständige Obstruktion, Operation, Transplantation, gleichzeitige Infektion oder angeborene Fehlbildung kompliziert waren, wurden ausgeschlossen. Die Wirksamkeit wurde durch bakteriologische Eradikation des/der Ausgangsorganismus(se) beim Besuch nach der Therapie bei Patienten mit einem bei Ausgangswert identifizierten Pathogen gemessen. Der Besuch nach der Behandlung (Test-of-Cure) fand 10 bis 14 Tage nach der letzten aktiven Dosis von LEVAQUIN® und 5 bis 9 Tage nach der letzten Dosis von aktivem Ciprofloxacin statt.
Die bakteriologischen Heilungsraten insgesamt für LEVAQUIN® und Kontrolle beim Test-of-Cure (TOC)-Besuch für die Gruppe aller Patienten mit einem dokumentierten Erreger zu Studienbeginn (modifizierte Behandlungsabsicht oder mITT) und die Gruppe der Patienten in der mITT-Population die sich strikt an das Protokoll (mikrobiologisch auswertbar) gehalten haben, sind in Tabelle 16 zusammengefasst.
In Tabelle 17 sind die mikrobiologischen Eradikationsraten in der mikrobiologisch auswertbaren Population bei TOC für einzelne Krankheitserreger, die bei Patienten, die randomisiert einer LEVAQUIN®-Behandlung zugeteilt wurden, wiedergefunden wurden, dargestellt.
Komplizierte Harnwegsinfektionen und akute Pyelonephritis
10-tägiges Behandlungsschema
Um die Sicherheit und Wirksamkeit der 250-mg-Dosis, des 10-tägigen LEVAQUIN®-Regimes zu bewerten, wurden 567 Patienten mit unkomplizierter HWI, leichter bis mittelschwerer cUTI und leichter bis mittelschwerer AP in ein randomisiertes, doppelblindes, multizentrisches Studienprogramm aufgenommen klinische Studie, die in den USA von Juni 1993 bis Januar 1995 durchgeführt wurde und LEVAQUIN® 250 mg oral einmal täglich für 10 Tage (285 Patienten) mit Ciprofloxacin 500 mg oral zweimal täglich für 10 Tage (282 Patienten) verglich. Patienten mit einem resistenten Erreger, wiederkehrenden Harnwegsinfekten, Frauen über 55 Jahren und mit einem Verweilkatheter wurden zunächst ausgeschlossen, bevor die Änderung des Protokolls nach 30 % der Einschreibung erfolgte. Die mikrobiologische Wirksamkeit wurde durch bakteriologische Eradikation des Ausgangsorganismus/der Ausgangsorganismen 1–12 Tage nach der Therapie bei Patienten mit einem bei Ausgangswert identifizierten Pathogen gemessen.
Die bakteriologischen Heilungsraten insgesamt für LEVAQUIN® und Kontrolle beim Test-of-Cure (TOC)-Besuch für die Gruppe aller Patienten mit einem dokumentierten Erreger zu Studienbeginn (modifizierte Behandlungsabsicht oder mITT) und die Gruppe der Patienten in der mITT-Population die das Protokoll (mikrobiologisch auswertbar) genau befolgt haben, sind in Tabelle 18 zusammengefasst.
Inhalativer Anthrax (Post-Exposition)
Die Wirksamkeit von LEVAQUIN® für diese Indikation basiert auf den beim Menschen erreichten Plasmakonzentrationen, einem Surrogat-Endpunkt, der mit ziemlicher Wahrscheinlichkeit den klinischen Nutzen vorhersagen kann. LEVAQUIN® wurde am Menschen nicht zur Postexpositionsprävention von Inhalationsmilzbrand getestet. Die mittleren Plasmakonzentrationen von LEVAQUIN®, die mit einer statistisch signifikanten Verbesserung des Überlebens gegenüber Placebo im Rhesusaffen-Modell für Inhalationsmilzbrand verbunden sind, werden bei erwachsenen und pädiatrischen Patienten, die die empfohlenen oralen und intravenösen Dosierungsschemata erhalten, erreicht oder überschritten [siehe INDIKATIONEN und DOSIERUNG UND ANWENDUNG ].
Die Pharmakokinetik von Levofloxacin wurde bei erwachsenen und pädiatrischen Patienten untersucht. Die mittlere (± Standardabweichung) maximale Plasmakonzentration im Steady State bei Erwachsenen, die einmal täglich 500 mg oral oder intravenös erhalten, beträgt 5,7 ± 1,4 bzw. 6,4 ± 0,8 µg/ml; und die entsprechende Gesamtplasmaexposition (AUC) beträgt 47,5 ± 6,7 bzw. 54,6 ± 11,1 µg·h/ml. Die vorhergesagten pharmakokinetischen Parameter im Steady State bei pädiatrischen Patienten im Alter von 6 Monaten bis 17 Jahren, die 8 mg/kg oral alle 12 Stunden (nicht mehr als 250 mg pro Dosis) erhielten, wurden als vergleichbar mit denen berechnet, die bei Erwachsenen beobachtet wurden, die 500 mg erhielten oral einmal täglich [vgl KLINISCHE PHARMAKOLOGIE ].
LEVAQUIN® Tabletten können aufgrund der Einschränkungen der verfügbaren Stärken nur pädiatrischen Patienten mit Lungenmilzbrand (Postexposition) oder Pest verabreicht werden, die 30 kg oder mehr wiegen [siehe DOSIERUNG UND ANWENDUNG ].
Bei Erwachsenen ist die Sicherheit von LEVAQUIN® für eine Behandlungsdauer von bis zu 28 Tagen gut charakterisiert. Allerdings sind die Informationen über eine längere Anwendung von 500 mg täglich bis zu 60 Tagen begrenzt. Eine Langzeittherapie mit LEVAQUIN® sollte bei Erwachsenen nur angewendet werden, wenn der Nutzen das Risiko überwiegt.
Bei pädiatrischen Patienten wurde die Sicherheit von Levofloxacin für eine Behandlungsdauer von mehr als 14 Tagen nicht untersucht. In klinischen Studien mit einer Behandlungsdauer von bis zu 14 Tagen wurde eine erhöhte Inzidenz muskuloskelettaler Nebenwirkungen (Arthralgie, Arthritis, Tendinopathie, Gangstörungen) im Vergleich zu Kontrollpersonen beobachtet. Langzeitsicherheitsdaten, einschließlich Auswirkungen auf den Knorpel, nach der Verabreichung von Levofloxacin an pädiatrische Patienten sind begrenzt [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und Verwendung in bestimmten Bevölkerungsgruppen ].
Es wurde eine placebokontrollierte Tierstudie an Rhesusaffen durchgeführt, die einer inhalierten mittleren Dosis von 49 LD50 (~2,7 × 106) Sporen (Bereich 17 – 118 LD50) von B. anthracis (Stamm Ames) ausgesetzt waren. Die minimale Hemmkonzentration (MHK) von Levofloxacin für den Milzbrandstamm, der in dieser Studie verwendet wurde, betrug 0,125 µg/ml. Bei den untersuchten Tieren lagen die mittleren Plasmakonzentrationen von Levofloxacin, die bei der erwarteten Tmax (1 Stunde nach Einnahme) nach oraler Gabe bis zum Steady State erreicht wurden, zwischen 2,79 und 4,87 µg/ml. Steady-State-Talkonzentrationen 24 Stunden nach der Verabreichung lagen im Bereich von 0,107 bis 0,164 µg/ml. Die mittlere (SD) AUC0-24 im Steady State betrug 33,4 ± 3,2 µg.h/ml (Bereich 30,4 bis 36,0 µg.h/ml). Die Sterblichkeit aufgrund von Milzbrand bei Tieren, die eine 30-tägige Behandlung mit oralem LEVAQUIN® erhielten, beginnend 24 Stunden nach der Exposition, war signifikant niedriger (1/10) im Vergleich zur Placebogruppe (9/10) [P = 0,0011, 2-seitig Fisher 39;s Genauer Test]. Das eine mit Levofloxacin behandelte Tier, das an Milzbrand starb, tat dies nach der 30-tägigen Arzneimittelverabreichungsperiode.
Pest
Wirksamkeitsstudien zu LEVAQUIN® konnten aus ethischen und Machbarkeitsgründen nicht an Menschen mit Lungenpest durchgeführt werden. Daher basierte die Zulassung dieser Indikation auf einer an Tieren durchgeführten Wirksamkeitsstudie.
Die mittleren Plasmakonzentrationen von LEVAQUIN®, die mit einer statistisch signifikanten Verbesserung des Überlebens gegenüber Placebo in einem Modell der afrikanischen grünen Meerkatze der Lungenpest verbunden sind, werden bei erwachsenen und pädiatrischen Patienten, die die empfohlenen oralen und intravenösen Dosierungsschemata erhalten, erreicht oder überschritten [siehe INDIKATIONEN und DOSIERUNG UND ANWENDUNG ].
Die Pharmakokinetik von Levofloxacin wurde bei erwachsenen und pädiatrischen Patienten untersucht. Die mittlere (± Standardabweichung) maximale Plasmakonzentration im Steady State bei Erwachsenen, die einmal täglich 500 mg oral oder intravenös erhalten, beträgt 5,7 ± 1,4 bzw. 6,4 ± 0,8 µg/ml; und die entsprechende Gesamtplasmaexposition (AUC0-24) beträgt 47,5 ± 6,7 bzw. 54,6 ± 11,1 µg.h/ml. Die vorhergesagten pharmakokinetischen Parameter im Steady State bei pädiatrischen Patienten im Alter von 6 Monaten bis 17 Jahren, die 8 mg/kg oral alle 12 Stunden (nicht mehr als 250 mg pro Dosis) erhielten, wurden als vergleichbar mit denen berechnet, die bei Erwachsenen beobachtet wurden, die 500 mg erhielten oral einmal täglich [vgl KLINISCHE PHARMAKOLOGIE ]. LEVAQUIN® Tabletten können aufgrund der Einschränkungen der verfügbaren Stärken nur pädiatrischen Patienten mit Lungenmilzbrand (Postexposition) oder Pest verabreicht werden, die 30 kg oder mehr wiegen [siehe DOSIERUNG UND ANWENDUNG ].
Es wurde eine placebokontrollierte Tierstudie an afrikanischen grünen Meerkatzen durchgeführt, die einer inhalierten mittleren Dosis von 65 LD (Bereich 3 bis 145 LD50) von Yersinia pestis (Stamm CO92) ausgesetzt waren. Die minimale Hemmkonzentration (MHK) von Levofloxacin für den in dieser Studie verwendeten Y. pestis-Stamm betrug 0,03 µg/ml. Die mittleren Plasmakonzentrationen von Levofloxacin, die am Ende einer einzelnen 30-minütigen Infusion bei afrikanischen grünen Meerkatzen erreicht wurden, lagen im Bereich von 2,84 bis 3,50 µg/ml. Die Talkonzentrationen 24 Stunden nach der Verabreichung lagen im Bereich von
INFORMATIONEN ZUM PATIENTEN
LEVAQUIN® (Lass ah kwin) (Levofloxacin) Tabletten
Was sind die wichtigsten Informationen, die ich über LEVAQUIN 500 mg wissen sollte?
LEVAQUIN 500 mg, ein Fluorchinolon-Antibiotikum, kann schwerwiegende Nebenwirkungen verursachen. Einige dieser schwerwiegenden Nebenwirkungen können gleichzeitig auftreten und zum Tod führen.
Wenn Sie während der Einnahme von LEVAQUIN 500 mg eine der folgenden schwerwiegenden Nebenwirkungen haben, Sie sollten die Einnahme von LEVAQUIN sofort abbrechen und sofort medizinische Hilfe in Anspruch nehmen.
Der Nervenschaden kann dauerhaft sein.
Was ist LEVAQUIN?
LEVAQUIN 500 mg ist ein Fluorchinolon-Antibiotikum, das bei Erwachsenen ab 18 Jahren zur Behandlung bestimmter Infektionen angewendet wird, die durch bestimmte Keime, sogenannte Bakterien, verursacht werden. Zu diesen bakteriellen Infektionen gehören:
Studien mit LEVAQUIN zur Anwendung bei der Behandlung von Pest und Anthrax wurden nur an Tieren durchgeführt, da Pest und Anthrax nicht an Menschen untersucht werden konnten.
LEVAQUIN sollte bei Patienten mit unkomplizierten Harnwegsinfektionen, akuter bakterieller Exazerbation einer chronischen Bronchitis oder akuter bakterieller Sinusitis nicht angewendet werden, wenn andere Behandlungsoptionen zur Verfügung stehen.
LEVAQUIN 750 mg Tabletten werden auch zur Behandlung von Kindern verwendet, die mindestens 66 Pfund (oder mindestens 30 Kilogramm) wiegen und Milzbrandkeime eingeatmet haben, an der Pest erkrankt sind oder Pestkeimen ausgesetzt waren. Es ist nicht bekannt, ob LEVAQUIN bei Kindern unter 6 Monaten sicher und wirksam ist.
Die Sicherheit und Wirksamkeit bei Kindern, die länger als 14 Tage mit LEVAQUIN® behandelt wurden, ist nicht bekannt.
Wer sollte LEVAQUIN 750 mg nicht einnehmen?
Levaquin darf nicht eingenommen werden: wenn Sie schon einmal eine schwere allergische Reaktion auf ein als Fluorchinolon bekanntes Antibiotikum hatten oder wenn Sie allergisch gegen Levofloxacin oder einen der Bestandteile von LEVAQUIN sind. Eine vollständige Liste der Inhaltsstoffe von LEVAQUIN finden Sie am Ende dieser Packungsbeilage.
Bevor Sie LEVAQUIN einnehmen, informieren Sie Ihren Arzt über alle Ihre Erkrankungen, auch wenn Sie:
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger und rezeptfreier Arzneimittel, Vitamine und Kräuterergänzungen.
LEVAQUIN und andere Arzneimittel können sich gegenseitig beeinflussen und Nebenwirkungen verursachen.
Informieren Sie Ihren Arzt insbesondere, wenn Sie Folgendes einnehmen:
Fragen Sie Ihren Arzt, wenn Sie sich nicht sicher sind, ob eines Ihrer Arzneimittel oben aufgeführt ist. Informieren Sie sich über die Medikamente, die Sie einnehmen. Führen Sie eine Liste Ihrer Arzneimittel und zeigen Sie diese Ihrem Arzt und Apotheker, wenn Sie ein neues Arzneimittel erhalten.
Wie sollte ich LEVAQUIN 500 mg einnehmen?
Die Einnahme Ihrer gesamten LEVAQUIN 500 mg-Dosen trägt dazu bei, dass alle Bakterien abgetötet werden. Die Einnahme Ihrer gesamten 250-mg-Dosen von LEVAQUIN hilft Ihnen, die Wahrscheinlichkeit zu verringern, dass die Bakterien gegen LEVAQUIN resistent werden. Wenn sich Ihre Infektion während der Einnahme von LEVAQUIN 750 mg nicht bessert, kann dies bedeuten, dass die Bakterien, die Ihre Infektion verursachen, möglicherweise gegen LEVAQUIN resistent sind. Wenn sich Ihre Infektion nicht bessert, wenden Sie sich an Ihren Arzt. Wenn sich Ihre Infektion nicht bessert, wirken LEVAQUIN und andere ähnliche antibiotische Arzneimittel in Zukunft möglicherweise nicht mehr bei Ihnen.
Was sollte ich während der Einnahme von LEVAQUIN 500 mg vermeiden?
Welche Nebenwirkungen kann LEVAQUIN 750 mg haben?
LEVAQUIN 750 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Bei Personen, die Fluorchinolone, einschließlich LEVAQUIN 500 mg, einnehmen, können allergische Reaktionen auch nach nur 1 Dosis auftreten. Brechen Sie die Einnahme von LEVAQUIN 500 mg ab und suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der folgenden Symptome einer schweren allergischen Reaktion haben:
Hautausschlag kann bei Personen auftreten, die LEVAQUIN 500 mg einnehmen, selbst nach nur 1 Dosis. Beenden Sie die Einnahme von LEVAQUIN 250 mg beim ersten Anzeichen eines Hautausschlags und rufen Sie sofort Ihren Arzt an. Hautausschlag kann ein Zeichen für eine schwerwiegendere Reaktion auf LEVAQUIN sein.
Brechen Sie die Einnahme von LEVAQUIN 750 mg ab und informieren Sie sofort Ihren Arzt, wenn Sie eine Gelbfärbung Ihrer Haut oder Ihrer weißen Augenpartie haben oder wenn Sie dunklen Urin haben. Dies können Anzeichen einer schwerwiegenden Reaktion auf LEVAQUIN sein (ein Leberproblem).
Bei Kindern ab 6 Monaten, die LEVAQUIN zur Behandlung von Milzbrand oder Pest einnehmen, kommt es ebenfalls häufig zu Erbrechen.
LEVAQUIN kann zu falsch-positiven Urin-Screening-Ergebnissen für Opiate führen, wenn Tests mit einigen im Handel erhältlichen Kits durchgeführt werden. Ein positives Ergebnis sollte mit einem spezifischeren Test bestätigt werden. Dies sind nicht alle möglichen Nebenwirkungen von LEVAQUIN.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Wie ist LEVAQUIN 250 mg aufzubewahren?
Allgemeine Informationen zur sicheren und wirksamen Anwendung von LEVAQUIN.
Medikamente werden manchmal für andere als die in einem Medikationsleitfaden aufgeführten Zwecke verschrieben. Verwenden Sie LEVAQUIN nicht für einen Zustand, für den es nicht verschrieben ist. Geben Sie LEVAQUIN 500 mg nicht an andere Personen weiter, selbst wenn diese die gleichen Symptome wie Sie haben. Es kann ihnen schaden. Dieser Arzneimittelleitfaden fasst die wichtigsten Informationen zu LEVAQUIN zusammen. Wenn Sie weitere Informationen zu LEVAQUIN 750 mg wünschen, sprechen Sie mit Ihrem Arzt. Sie können Ihren Arzt oder Apotheker um Informationen zu LEVAQUIN 500 mg bitten, die für Angehörige der Gesundheitsberufe bestimmt sind.
Was sind die Inhaltsstoffe von LEVAQUIN 500mg?
Wirkstoff: Levofloxacin
Inaktive Zutaten : Crospovidon, Hypromellose, Magnesiumstearat, mikrokristalline Cellulose, Polyethylenglykol, Polysorbat 80, Titandioxid.
LEVAQUIN 250 mg Tabletten enthalten auch synthetisches rotes Eisenoxid.
LEVAQUIN 500 mg Tabletten enthalten auch synthetisches rotes Eisenoxid und synthetisches gelbes Eisenoxid.
Dieser Medikationsleitfaden wurde von der US Food and Drug Administration genehmigt