Adalat 10mg, 20mg, 30mg Nifedipine Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Adalat und wie wird es angewendet?
Adalat ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Brustschmerzen (Angina pectoris), Bluthochdruck (Hypertonie) und pulmonaler Hypertonie. Adalat 30 mg kann allein oder mit anderen Medikamenten verwendet werden.
Adalat 20 mg gehört zu einer Klasse von Arzneimitteln, die Kalziumkanalblocker genannt werden; Kalziumkanalblocker, Dihydropyridin.
Es ist nicht bekannt, ob Adalat 30 mg bei Kindern unter 6 Jahren sicher und wirksam ist.
Welche Nebenwirkungen kann Adalat 10mg haben?
Adalat kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Die häufigsten Nebenwirkungen von Adalat sind:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Adalat. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
Adalat® CC ist eine Tablette mit verlängerter Wirkstofffreisetzung des Kalziumkanalblockers Nifedipin. Nifedipin ist 3,5-Pyridindicarbonsäure, 1,4-Dihydro-2,6-dimethyl-4-(2-nitrophenyl)-dimethylester, C17H18N2O6, und hat die Strukturformel:
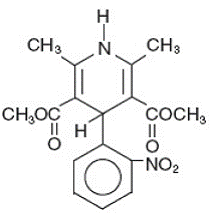
Nifedipin ist eine gelbe kristalline Substanz, praktisch unlöslich in Wasser, aber löslich in Ethanol. Es hat ein Molekulargewicht von 346,3. Adalat CC-Tabletten bestehen aus einer äußeren Hülle und einem inneren Kern. Beide enthalten Nifedipin, der Mantel als Formulierung mit langsamer Freisetzung und der Kern als Formulierung mit schneller Freisetzung. Adalat CC-Tabletten enthalten entweder: 30, 60 oder 90 mg Nifedipin zur einmal täglichen oralen Verabreichung.
Inerte Inhaltsstoffe in der Formulierung sind: Hydroxypropylcellulose, Lactose, Maisstärke, Crospovidon, mikrokristalline Cellulose, Siliciumdioxid und Magnesiumstearat. Die inerten Bestandteile im Filmüberzug für Adalat 30 mg CC 30 und 60 sind: Hypromellose, Polyethylenglykol, Eisenoxid und Titandioxid. Die inerten Bestandteile im Filmüberzug für Adalat 20 mg CC 90 sind: Hypromellose, Polyethylenglycol und Eisenoxid
INDIKATIONEN
Adalat 10 mg CC ist zur Behandlung von Bluthochdruck indiziert. Es kann allein oder in Kombination mit anderen blutdrucksenkenden Mitteln verwendet werden.
DOSIERUNG UND ANWENDUNG
Die Dosierung sollte entsprechend den Bedürfnissen jedes Patienten angepasst werden. Es wird empfohlen, Adalat 20 mg CC einmal täglich auf nüchternen Magen einzunehmen. Adalat 10 mg CC ist eine Darreichungsform mit verlängerter Freisetzung und Tabletten sollten ganz geschluckt, nicht gebissen oder geteilt werden. Im Allgemeinen sollte die Titration über einen Zeitraum von 7 bis 14 Tagen erfolgen, beginnend mit 30 mg einmal täglich. Die Aufwärtstitration sollte auf der therapeutischen Wirksamkeit und Sicherheit basieren. Die übliche Erhaltungsdosis beträgt 30 mg bis 60 mg einmal täglich. Eine Titration auf Dosen über 90 mg täglich wird nicht empfohlen.
Wenn ein Absetzen von Adalat 30 mg CC erforderlich ist, empfiehlt die solide klinische Praxis, die Dosis unter engmaschiger ärztlicher Überwachung schrittweise zu verringern.
Die gleichzeitige Verabreichung von Nifedipin mit Grapefruitsaft ist zu vermeiden (siehe KLINISCHE PHARMAKOLOGIE und VORSICHTSMASSNAHMEN ).
Bei der Abgabe von Adalat CC ist darauf zu achten, dass die Darreichungsform mit verlängerter Freisetzung verschrieben wurde.
WIE GELIEFERT
Adalat CC Retardtabletten sind als runde Filmtabletten zu 30 mg, 60 mg und 90 mg erhältlich. Die unterschiedlichen Stärken können wie folgt identifiziert werden:
Adalat® CC-Tabletten werden geliefert in:
Die Tabletten sollten vor Licht und Feuchtigkeit geschützt und unter 30 °C (86 °F) gelagert werden. In dichten, lichtbeständigen Behältern abgeben.
Hergestellt für: Bayer HealthCare Pharmaceuticals Inc., Wayne, NJ 07470. Hergestellt in Deutschland. Überarbeitet: Dezember 2015
NEBENWIRKUNGEN
Negative Erfahrungen
Die Inzidenz unerwünschter Ereignisse während der Behandlung mit Adalat CC in Dosen von bis zu 90 mg täglich wurde aus multizentrischen placebokontrollierten klinischen Studien mit 370 Bluthochdruckpatienten abgeleitet. Atenolol 50 mg einmal täglich wurde gleichzeitig bei 187 der 370 Patienten unter Adalat CC und bei 64 der 126 Patienten unter Placebo angewendet. Alle unerwünschten Ereignisse, die während der Adalat 30 mg CC-Therapie berichtet wurden, wurden unabhängig von ihrem kausalen Zusammenhang mit der Medikation tabelliert.
Die am häufigsten berichtete Nebenwirkung unter Adalat 10 mg CC war ein peripheres Ödem. Dies war dosisabhängig und die Häufigkeit betrug 18 % unter Adalat 30 mg CC 30 mg täglich, 22 % unter Adalat 30 mg CC 60 mg täglich und 29 % unter Adalat 10 mg CC 90 mg täglich gegenüber 10 % unter Placebo.
Andere häufige unerwünschte Ereignisse, die in den oben genannten Placebo-kontrollierten Studien berichtet wurden, umfassen:
Wenn die Häufigkeit von Nebenwirkungen unter Adalat 20 mg CC und Placebo ähnlich ist, kann kein kausaler Zusammenhang hergestellt werden.
Die folgenden Nebenwirkungen wurden mit einer Inzidenz von 3 % oder weniger bei Tagesdosen bis zu 90 mg berichtet:
Gesamtkörper/systemisch: Brustschmerzen, Beinschmerzen
Zentrales Nervensystem: Parästhesien, Schwindel
Dermatologisch: Ausschlag
Magen-Darm: Verstopfung
Bewegungsapparat: Beinkrämpfe
Atmung: Epistaxis, Rhinitis
Urogenital: Impotenz, häufiges Wasserlassen
Andere unerwünschte Ereignisse, die mit einer Inzidenz von weniger als 1,0 % berichtet wurden, waren:
Gesamtkörper/systemisch: allergische Reaktion, Asthenie, Zellulitis, substernaler Brustschmerz, Schüttelfrost, Gesichtsödem, anormaler Labortest, Unwohlsein, Nackenschmerzen, Beckenschmerzen, Schmerzen, Lichtempfindlichkeitsreaktion , Phlebitis, orthostatische Hypotonie, Tachykardie, kutane Angiektasien
Zentrales Nervensystem: Angst, Verwirrtheit, verminderte Libido, Depression, Hypertonie, Hypästhesie, Schlaflosigkeit, Somnolenz
Dermatologisch: Angioödem, petechialer Ausschlag, Juckreiz, Schwitzen
Magen-Darm: Bauchschmerzen, Durchfall, Mundtrockenheit, Dysphagie, Dyspepsie, Aufstoßen, Ösophagitis, Flatulenz, Magen-Darm-Störung, Magen-Darm-Blutung, GGT erhöht, Zahnfleischerkrankung, Zahnfleischblutung, Erbrechen
Hämatologisch: Eosinophilie, Lymphadenopathie
Stoffwechsel: Gicht, Gewichtsverlust
Bewegungsapparat: Arthralgie, Arthritis, Gelenkerkrankung, Myalgie, Myasthenie
Atmung: Dyspnoe, verstärkter Husten, Rasseln, Pharyngitis, Stridor
Besondere Sinne: Sehstörungen, Amblyopie, Konjunktivitis, Diplopie, Augenerkrankung, Augenblutung, Tinnitus
Urogenital/Reproduktion: Dysurie, Nierensteine, Nykturie, Milchstau, Polyurie, Urogenitalstörung, erektile Dysfunktion (ED)
Die folgenden Nebenwirkungen wurden selten bei Patienten berichtet, denen Nifedipin in Fellkern- oder anderen Formulierungen verabreicht wurde: allergische Hepatitis, Alopezie, anaphylaktische Reaktion, Anämie, Arthritis mit ANA (+), Depression, Erythromelalgie, exfoliative Dermatitis, Fieber, Gingivahyperplasie, Gynäkomastie, Hyperglykämie, Gelbsucht, Leukopenie, Stimmungsschwankungen, Muskelkrämpfe, Nervosität, paranoides Syndrom, Purpura, Zittern, Schlafstörungen, Stevens-Johnson-Syndrom, Synkope, Geschmacksstörungen, Thrombozytopenie, toxische epidermale Nekrolyse, vorübergehende Erblindung am Höhepunkt des Plasmaspiegels, Tremor und Urtikaria.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Nifedipin wird hauptsächlich durch Metabolisierung eliminiert und ist ein Substrat von CYP3A. Inhibitoren und Induktoren von CYP3A können die Exposition gegenüber Nifedipin und folglich seine erwünschten und unerwünschten Wirkungen beeinflussen. In-vitro- und In-vivo-Daten weisen darauf hin, dass Nifedipin den Metabolismus von Arzneimitteln hemmen kann, die Substrate von CYP3A sind, wodurch die Exposition gegenüber anderen Arzneimitteln erhöht wird. Nifedipin ist ein Vasodilatator, und die gleichzeitige Verabreichung von anderen Arzneimitteln, die den Blutdruck beeinflussen, kann zu pharmakodynamischen Wechselwirkungen führen.
CYP3A-Inhibitoren
CYP3A-Hemmer wie Ketoconazol, Fluconazol, Itraconazol, Clarithromycin, Erythromycin (Azithromycin, obwohl es strukturell mit der Klasse der Makrolid-Antibiotika verwandt ist, hat keine klinisch relevante CYP3A4-Hemmung), Grapefruit, Nefazodon, Fluoxetin, Saquinavir, Indinavir, Nelfinavir und Ritonavir können die Folge sein bei erhöhter Nifedipin-Exposition bei gleichzeitiger Verabreichung. Sorgfältige Überwachung und Dosisanpassung können erforderlich sein; erwägen Sie, Nifedipin mit der niedrigsten verfügbaren Dosis zu beginnen, wenn es gleichzeitig mit diesen Medikamenten gegeben wird.
Starke CYP3A-Induktoren
Starke CYP3A-Induktoren wie Rifampin, Rifabutin, Phenobarbital, Phenytoin, Carbamazepin und Johanniskraut reduzieren die Bioverfügbarkeit und Wirksamkeit von Nifedipin; daher sollte Nifedipin nicht in Kombination mit starken CYP3A-Induktoren wie Rifampin angewendet werden (vgl KONTRAINDIKATIONEN ).
Herz-Kreislauf-Medikamente
Antiarrhythmika
Chinidin: Chinidin ist ein Substrat von CYP3A und es wurde gezeigt, dass es CYP3A in vitro hemmt. Die gleichzeitige Verabreichung mehrerer Dosen von Chinidinsulfat, 200 mg dreimal täglich, und Nifedipin, 20 mg dreimal täglich, erhöhte Cmax und AUC von Nifedipin bei gesunden Probanden um den Faktor 2,30 bzw. 1,37. Die Herzfrequenz im Anfangsintervall nach der Arzneimittelgabe war um bis zu 17,9 Schläge/Minute erhöht. Die Exposition gegenüber Chinidin wurde in Gegenwart von Nifedipin nicht wesentlich verändert. Eine Überwachung der Herzfrequenz und gegebenenfalls eine Anpassung der Nifedipin-Dosis werden empfohlen, wenn Chinidin zu einer Behandlung mit Nifedipin hinzugefügt wird.
Flecainid: Es liegen zu wenig Erfahrungen mit der gleichzeitigen Anwendung von Tambocor mit Nifedipin vor, um eine gleichzeitige Anwendung zu empfehlen.
Kalziumkanalblocker
Diltiazem: Die Vorbehandlung gesunder Probanden mit 30 mg oder 90 mg tid Diltiazem po erhöhte die AUC von Nifedipin nach einer Einzeldosis von 20 mg Nifedipin um den Faktor 2,2 bzw. 3,1. Die entsprechenden Cmax-Werte von Nifedipin erhöhten sich um den Faktor 2,0 bzw. 1,7. Bei gleichzeitiger Anwendung von Diltiazem und Nifedipin ist Vorsicht geboten und eine Reduzierung der Nifedipin-Dosis sollte in Erwägung gezogen werden.
Verapamil: Verapamil, ein CYP3A-Hemmer, kann den Metabolismus von Nifedipin hemmen und die Nifedipin-Exposition während einer Begleittherapie erhöhen. Der Blutdruck sollte überwacht und eine Reduzierung der Nifedipin-Dosis in Erwägung gezogen werden.
ACE-Hemmer
Benazepril: Bei gesunden Probanden, die eine Einzeldosis von 20 mg Nifedipin ER und 10 mg Benazepril erhielten, waren die Plasmakonzentrationen von Benazeprilat und Nifedipin in Gegenwart und Abwesenheit voneinander nicht statistisch signifikant unterschiedlich. Eine blutdrucksenkende Wirkung wurde nur nach gleichzeitiger Verabreichung der beiden Arzneimittel beobachtet. Die tachykarde Wirkung von Nifedipin wurde in Gegenwart von Benazepril abgeschwächt.
Angiotensin-II-Blocker
Irbesartan: In-vitro-Studien zeigen eine signifikante Hemmung der Bildung von oxidierten Irbesartan-Metaboliten durch Nifedipin. In klinischen Studien hatte die gleichzeitige Gabe von Nifedipin jedoch keine Auswirkung auf die Pharmakokinetik von Irbesartan.
Candesartan: In Studien mit Candesartancilexitil, das zusammen mit Nifedipin gegeben wurde, wurden keine signifikanten Arzneimittelwechselwirkungen berichtet. Da Candesartan nicht signifikant durch das Cytochrom-P450-System metabolisiert wird und in therapeutischen Konzentrationen keine Wirkung auf Cytochrom-P450-Enzyme hat, sind Wechselwirkungen mit Arzneimitteln, die diese Enzyme hemmen oder durch diese metabolisiert werden, nicht zu erwarten.
Betablocker
Adalat 10 mg CC wurde bei Verabreichung in Kombination mit Betablockern bei 187 Bluthochdruckpatienten in einer placebokontrollierten klinischen Studie gut vertragen. Es gab jedoch gelegentlich Literaturberichte, die darauf hindeuteten, dass die Kombination von Nifedipin und beta-adrenergen Blockern die Wahrscheinlichkeit einer dekompensierten Herzinsuffizienz, einer schweren Hypotonie oder einer Exazerbation von Angina bei Patienten mit kardiovaskulären Erkrankungen erhöhen könnte. Eine klinische Überwachung wird empfohlen und eine Dosisanpassung von Nifedipin sollte in Erwägung gezogen werden.
Timolol: Eine Hypotonie tritt eher auf, wenn Dihydropyridin-Calciumantagonisten wie Nifedipin zusammen mit Timolol verabreicht werden.
Zentrale Alpha1-Blocker
Doxazosin: Gesunde Freiwillige, die an einer Doxazosin-Nifedipin-Wechselwirkungsstudie mit Mehrfachdosis teilnahmen, erhielten 2 mg Doxazosin qd allein oder in Kombination mit 20 mg Nifedipin ER bid. Die gleichzeitige Anwendung von Nifedipin führte zu einer Abnahme der AUC und Cmax von Doxazosin auf 83 % bzw in Abwesenheit von Nifedipin. In Gegenwart von Doxazosin waren AUC und Cmax von Nifedipin um den Faktor 1,13 bzw. 1,23 erhöht. Im Vergleich zur Nifedipin-Monotherapie war der Blutdruck in Gegenwart von Doxazosin niedriger. Bei gleichzeitiger Anwendung von Doxazosin und Nifedipin sollte der Blutdruck überwacht und eine Dosisreduktion von Nifedipin in Betracht gezogen werden.
Digitalis
Digoxin: Die gleichzeitige Verabreichung von Nifedipin und Digoxin kann zu einer verringerten Clearance führen, was zu einem Anstieg der Plasmakonzentrationen von Digoxin führt. Da vereinzelt über Patienten mit erhöhten Digoxinspiegeln berichtet wurde und eine mögliche Wechselwirkung zwischen Digoxin und Adalat CC besteht, wird empfohlen, die Digoxinspiegel zu Beginn, bei der Anpassung und beim Absetzen von Adalat 10 mg CC zu überwachen, um eine mögliche Über- oder Unterschreitung zu vermeiden. Digitalisierung.
Antithrombotika
Cumarine: Es gab seltene Berichte über eine verlängerte Prothrombinzeit bei Patienten, die Cumarin-Antikoagulanzien einnahmen und denen Nifedipin verabreicht wurde. Die Beziehung zur Nifedipin-Therapie ist jedoch ungewiss.
Thrombozytenaggregationshemmer
Clopidogrel: Bei gleichzeitiger Anwendung von Clopidrogrel und Nifedipin wurden keine klinisch signifikanten pharmakodynamischen Wechselwirkungen beobachtet.
Tirofiban: Die gleichzeitige Verabreichung von Nifedipin veränderte die Exposition gegenüber Tirofiban nicht wesentlich.
Sonstiges
Diuretika, PDE5-Hemmer, Alpha-Methyldopa: Nifedipin kann die blutdrucksenkende Wirkung dieser gleichzeitig angewendeten Arzneimittel verstärken.
Nicht-kardiovaskuläre Medikamente
Antimykotische Medikamente
Ketoconazol, Itraconazol und Fluconazol sind CYP3A-Inhibitoren und können den Metabolismus von Nifedipin hemmen und die Nifedipin-Exposition während einer Begleittherapie erhöhen. Der Blutdruck sollte überwacht und eine Dosisreduktion von Nifedipin in Erwägung gezogen werden.
Antisekretorische Medikamente
Omeprazol: Bei gesunden Probanden, die eine Einzeldosis von 10 mg Nifedipin erhielten, waren AUC und Cmax von Nifedipin nach Vorbehandlung mit 20 mg Omeprazol qd für 8 Tage 1,26- und 0,87-mal höher als nach Vorbehandlung mit Placebo. Eine Vorbehandlung mit oder gleichzeitige Verabreichung von Omeprazol hatte keinen Einfluss auf die Wirkung von Nifedipin auf den Blutdruck oder die Herzfrequenz. Die Wirkung von Omeprazol auf Nifedipin ist wahrscheinlich nicht von klinischer Relevanz.
Pantoprazol: Bei gesunden Probanden war die Exposition gegenüber keinem der beiden Medikamente in Gegenwart des anderen Medikaments signifikant verändert.
Ranitidin: Fünf Studien mit gesunden Probanden untersuchten die Auswirkungen mehrerer Ranitidin-Dosen auf die Pharmakokinetik von Nifedipin nach einmaliger oder mehrfacher Gabe. Zwei Studien untersuchten die Wirkung von gleichzeitig verabreichtem Ranitidin auf den Blutdruck bei Hypertonikern unter Nifedipin. Die gleichzeitige Verabreichung von Ranitidin hatte keine relevanten Auswirkungen auf die Nifedipin-Exposition, die den Blutdruck oder die Herzfrequenz bei normotensiven oder hypertensiven Probanden beeinflusste.
Cimetidin: Fünf Studien mit gesunden Probanden untersuchten die Auswirkung mehrerer Cimetidin-Dosen auf die Pharmakokinetik von Nifedipin nach einmaliger oder mehrfacher Gabe. Zwei Studien untersuchten die Wirkung von gleichzeitig verabreichtem Cimetidin auf den Blutdruck bei Hypertonikern unter Nifedipin. Bei normotensiven Probanden, die Einzeldosen von 10 mg oder Mehrfachdosen von bis zu 20 mg Nifedipin 3-mal täglich allein oder zusammen mit Cimetidin bis zu 1000 mg/Tag erhielten, lagen die AUC-Werte von Nifedipin in Gegenwart von Cimetidin zwischen dem 1,52- und 2,01-Fachen derjenigen von Nifedipin Abwesenheit von Cimetidin. Die Cmax-Werte von Nifedipin in Gegenwart von Cimetidin waren um Faktoren zwischen 1,60 und 2,02 erhöht. Die Erhöhung der Nifedipin-Exposition durch Cimetidin wurde von relevanten Veränderungen des Blutdrucks oder der Herzfrequenz bei normotensiven Probanden begleitet. Patienten mit Bluthochdruck, die 10 mg qd Nifedipin allein oder in Kombination mit Cimetidin 1000 mg qd erhielten, erlebten ebenfalls relevante Veränderungen des Blutdrucks, wenn Cimetidin zu Nifedipin hinzugefügt wurde. Die Wechselwirkung zwischen Cimetidin und Nifedipin ist von klinischer Relevanz und der Blutdruck sollte überwacht und eine Reduzierung der Nifedipin-Dosis in Betracht gezogen werden.
Cisaprid: Die gleichzeitige Verabreichung von Cisaprid und Nifedipin kann zu erhöhten Plasmakonzentrationen von Nifedipin führen.
Antibakterielle Medikamente
Quinupristin/Dalfopristin: In-vitro-Interaktionsstudien haben gezeigt, dass Quinupristin/Dalfopristin den CYP3A-Metabolismus von Nifedipin signifikant hemmt. Die gleichzeitige Verabreichung von Quinupristin/Dalfopristin und Nifedipin (wiederholte orale Gabe) bei gesunden Probanden erhöhte die AUC und Cmax für Nifedipin um den Faktor 1,44 bzw. 1,18 im Vergleich zur Nifedipin-Monotherapie. Bei gleichzeitiger Anwendung von Quinupristin/Dalfopristin mit Nifedipin sollte der Blutdruck überwacht und eine Reduzierung der Nifedipin-Dosis in Erwägung gezogen werden.
Erythromycin: Erythromycin, ein CYP3A-Inhibitor, kann den Metabolismus von Nifedipin hemmen und die Nifedipin-Exposition während einer Begleittherapie erhöhen. Der Blutdruck sollte überwacht und eine Reduzierung der Nifedipin-Dosis in Erwägung gezogen werden.
Antituberkulöse Medikamente
Rifampin: Starke CYP3A-Induktoren wie Rifampin, Rifapentin und Rifabutin verringern die Bioverfügbarkeit von Nifedipin, was die Wirksamkeit von Nifedipin verringern kann; daher sollte Nifedipin nicht in Kombination mit starken CYP3A-Induktoren wie Rifampin angewendet werden (vgl KONTRAINDIKATIONEN ). Die Auswirkung mehrerer oraler Dosen von 600 mg Rifampin auf die Pharmakokinetik von Nifedipin nach einer oralen Einzeldosis von 20 mg Nifedipin-Kapsel wurde in einer klinischen Studie untersucht. Zwölf gesunde männliche Probanden erhielten am Studientag 1 eine orale Einzeldosis von 20 mg Nifedipin-Kapsel. Beginnend am Studientag 2 erhielten die Probanden 14 Tage lang einmal täglich 600 mg Rifampin. Am Studientag 15 wurde eine zweite orale Einzeldosis von 20 mg Nifedipin-Kapsel zusammen mit der letzten Rifampin-Dosis verabreicht. Im Vergleich zu Tag 1 der Studie reduzierte eine 14-tägige Vorbehandlung mit Rifampin die Cmax und AUC von gleichzeitig verabreichtem Nifedipin im Durchschnitt um 95 % bzw. 97 %.

Antivirale Medikamente
Amprenavir, Atanazavir, Delavirin, Fosamprinavir, Indinavir, Nelfinavir und Ritonavir können als CYP3A-Inhibitoren den Metabolismus von Nifedipin hemmen und die Nifedipin-Exposition erhöhen. Vorsicht ist geboten und eine klinische Überwachung der Patienten wird empfohlen.
ZNS-Medikamente
Nefazodon, ein CYP3A-Hemmer, kann den Metabolismus von Nifedipin hemmen und die Nifedipin-Exposition während einer Begleittherapie erhöhen. Der Blutdruck sollte überwacht und eine Reduktion der Nifedipin-Dosis in Erwägung gezogen werden.
Fluoxetin, ein CYP3A-Hemmer, kann den Metabolismus von Nifedipin hemmen und die Nifedipin-Exposition während einer Begleittherapie erhöhen. Der Blutdruck sollte überwacht und eine Reduktion der Nifedipin-Dosis in Erwägung gezogen werden.
Valproinsäure kann die Exposition gegenüber Nifedipin während einer Begleittherapie erhöhen. Der Blutdruck sollte überwacht und eine Dosisreduktion von Nifedipin in Erwägung gezogen werden.
Phenytoin, Phenobarbital und Carbamazepin: Nifedipin wird durch CYP3A metabolisiert. Die gleichzeitige Anwendung von Nifedipin 10 mg Kapsel und 60 mg Nifedipin Mantelkerntablette mit Phenytoin, einem Induktor von CYP3A, senkte die AUC und Cmax von Nifedipin um etwa 70 %. Phenobarbital und Carbamazepin sind ebenfalls Induktoren von CYP3A. Bei Patienten, die Phenytoin, Phenobarbital und Carbamazepin einnehmen, sollte eine alternative blutdrucksenkende Therapie in Erwägung gezogen werden.
Antiemetika
Dolasetron: Bei Patienten, die Dolasetron oral oder intravenös und Nifedipin einnahmen, wurde keine Wirkung auf die Clearance von Hydrodolasetron gezeigt.
Immunsuppressive Medikamente
Tacrolimus: Es wurde gezeigt, dass Tacrolimus über das CYP3A-System metabolisiert wird. Es wurde gezeigt, dass Nifedipin den Metabolismus von Tacrolimus in vitro hemmt. Transplantationspatienten, die Tacrolimus und Nifedipin erhielten, benötigten um 26 % bis 38 % geringere Dosen als Patienten, die kein Nifedipin erhielten. Nifedipin kann die Tacrolimus-Exposition erhöhen. Wenn Nifedipin zusammen mit Tacrolimus angewendet wird, sollten die Blutkonzentrationen von Tacrolimus überwacht und eine Reduzierung der Tacrolimus-Dosis in Erwägung gezogen werden.
Sirolimus: Eine Einzeldosis von 60 mg Nifedipin und eine Einzeldosis von 10 mg Sirolimus-Lösung zum Einnehmen wurden 24 gesunden Freiwilligen verabreicht. Klinisch signifikante pharmakokinetische Arzneimittelwechselwirkungen wurden nicht beobachtet.
Glukosesenkende Medikamente
Pioglitazon: Die gleichzeitige Verabreichung von Pioglitazon über 7 Tage mit 30 mg Nifedipin ER, oral qd für 4 Tage an männliche und weibliche Probanden verabreicht, führte zu Werten der kleinsten Quadrate (90 % KI) für unverändertes Nifedipin von 0,83 (0,73-0,95) für Cmax und 0,88 ( 0,80-0,96) für die AUC relativ zur Nifedipin-Monotherapie. Angesichts der hohen Variabilität der Nifedipin-Pharmakokinetik ist die klinische Bedeutung dieses Befunds nicht bekannt.
Rosiglitazon: Es zeigte sich, dass die gleichzeitige Anwendung von Rosiglitazon (4 mg zweimal täglich) keine klinisch relevante Wirkung auf die Pharmakokinetik von Nifedipin hatte.
Metformin: Eine Wechselwirkungsstudie mit Einzeldosis Metformin und Nifedipin an gesunden Probanden zeigte, dass die gleichzeitige Gabe von Nifedipin die Cmax und AUC von Metformin im Plasma um 20 % bzw. 9 % und die im Urin ausgeschiedene Metforminmenge erhöhte. Tmax und Halbwertszeit wurden nicht beeinflusst. Nifedipin scheint die Resorption von Metformin zu verstärken.
Miglitol: Es wurde keine Wirkung von Miglitol auf die Pharmakokinetik und Pharmakodynamik von Nifedipin beobachtet.
Repaglinid: Die gleichzeitige Anwendung von 10 mg Nifedipin mit einer Einzeldosis von 2 mg Repaglinid (nach 4 Tagen Nifedipin 10 mg dreimal täglich und Repaglinid 2 mg dreimal täglich) führte zu unveränderten AUC- und Cmax-Werten für beide Arzneimittel.
Acarbose: Nifedipin neigt zu Hyperglykämie und kann zu einem Verlust der Glukosekontrolle führen. Wenn Nifedipin zusammen mit Acarbose angewendet wird, sollten die Blutzuckerspiegel sorgfältig überwacht und eine Dosisanpassung von Nifedipin in Betracht gezogen werden.
Medikamente, die die Nahrungsaufnahme beeinträchtigen
Orlistat: Bei 17 normalgewichtigen Probanden, die Orlistat 120 mg dreimal täglich über 6 Tage erhielten, veränderte Orlistat die Bioverfügbarkeit von 60 mg Nifedipin (Retardtabletten) nicht.
Nahrungsergänzungsmittel
Grapefruitsaft: Bei gesunden Probanden erhöhte eine gleichzeitige Gabe einer Einzeldosis von 250 ml doppelt konzentriertem Grapefruitsaft mit 10 mg Nifedipin die AUC und Cmax um den Faktor 1,35 bzw. 1,13. Die Einnahme wiederholter Dosen von Grapefruitsaft (5 x 200 ml in 12 Stunden) nach Verabreichung von 20 mg Nifedipin ER erhöhte die AUC und Cmax von Nifedipin um den Faktor 2. Grapefruitsaft sollte von Patienten unter Nifedipin vermieden werden. Die Einnahme von Grapefruitsaft sollte mindestens 3 Tage vor Beginn der Behandlung mit Nifedipin beendet werden.
Kräuter
Johanniskraut: Johanniskraut ist ein Induktor von CYP3A und kann die Exposition gegenüber Nifedipin verringern. Bei Patienten, bei denen eine Therapie mit Johanniskraut erforderlich ist, sollte eine alternative antihypertensive Therapie in Erwägung gezogen werden.
CYP2D6-Sonden-Medikament
Debrisoquin: Bei gesunden Probanden veränderte die Vorbehandlung mit Nifedipin 20 mg dreimal täglich über 5 Tage das metabolische Verhältnis von Hydroxydebrisoquin zu Debrisoquin, gemessen im Urin nach einer Einzeldosis von 10 mg Debrisoquin, nicht. Daher ist es unwahrscheinlich, dass Nifedipin in vivo den Metabolismus anderer Arzneimittel hemmt, die Substrate von CYP2D6 sind.
WARNUNGEN
Übermäßige Hypotonie
Obwohl die blutdrucksenkende Wirkung von Nifedipin bei den meisten Patienten gering ist und gut vertragen wird, kam es gelegentlich bei Patienten zu übermäßiger und schlecht vertragener Hypotonie. Diese Reaktionen traten in der Regel während der anfänglichen Titration oder zum Zeitpunkt der anschließenden Dosiserhöhung auf und können bei Patienten, die gleichzeitig Betablocker anwenden, wahrscheinlicher sein.
Schwere Hypotonie und/oder erhöhter Flüssigkeitsbedarf wurden bei Patienten berichtet, die Kapseln mit sofortiger Wirkstofffreisetzung zusammen mit einem Betablocker erhielten und sich einer Koronararterien-Bypass-Operation unter Verwendung einer Hochdosis-Fentanyl-Anästhesie unterzogen. Die Wechselwirkung mit hochdosiertem Fentanyl scheint auf die Kombination von Nifedipin und einem Betablocker zurückzuführen zu sein, aber die Möglichkeit, dass sie mit Nifedipin allein, mit niedrigen Dosen von Fentanyl, bei anderen chirurgischen Eingriffen oder mit anderen narkotischen Analgetika auftreten kann, kann dies nicht sein ausgeschlossen. Bei mit Nifedipin behandelten Patienten, bei denen eine Operation mit hochdosierter Fentanyl-Anästhesie in Betracht gezogen wird, sollte sich der Arzt dieser potenziellen Probleme bewusst sein und, sofern der Zustand des Patienten dies zulässt, ausreichend Zeit (mindestens 36 Stunden) einräumen, damit Nifedipin ausgewaschen werden kann Der Körper vor der Operation.
Erhöhte Angina pectoris und/oder Myokardinfarkt
Selten haben Patienten, insbesondere Patienten mit schwerer obstruktiver Koronararterienerkrankung, eine gut dokumentierte erhöhte Häufigkeit, Dauer und/oder Schwere von Angina pectoris oder akutem Myokardinfarkt zu Beginn der Behandlung mit Nifedipin oder zum Zeitpunkt einer Dosiserhöhung entwickelt. Der Mechanismus dieses Effektes ist nicht bestimmt.
Beta-Blocker-Entzug
Wenn Sie einen Betablocker absetzen, ist es wichtig, seine Dosis nach Möglichkeit zu verringern, anstatt abrupt zu stoppen, bevor Sie mit Nifedipin beginnen. Patienten, die kürzlich Betablocker abgesetzt haben, können ein Entzugssyndrom mit verstärkter Angina pectoris entwickeln, wahrscheinlich im Zusammenhang mit einer erhöhten Empfindlichkeit gegenüber Katecholaminen. Der Beginn einer Behandlung mit Nifedipin wird dieses Auftreten nicht verhindern und gelegentlich wurde über eine Verstärkung berichtet.
Kongestive Herzinsuffizienz
Selten haben Patienten (normalerweise während der Einnahme eines Betablockers) nach Beginn der Behandlung mit Nifedipin eine Herzinsuffizienz entwickelt. Bei Patienten mit festsitzender Aortenstenose besteht möglicherweise ein größeres Risiko für ein solches Ereignis, da erwartet wird, dass die Entlastungswirkung von Nifedipin für diese Patienten aufgrund ihrer festen Impedanz für den Fluss durch die Aortenklappe von geringerem Nutzen ist.
VORSICHTSMASSNAHMEN
Allgemein
Hypotonie
Da Nifedipin den peripheren Gefäßwiderstand verringert, wird eine sorgfältige Überwachung des Blutdrucks während der anfänglichen Verabreichung und Titration von Adalat CC empfohlen. Eine engmaschige Überwachung wird besonders für Patienten empfohlen, die bereits Medikamente einnehmen, die bekanntermaßen den Blutdruck senken (siehe WARNUNGEN ).
Periphere Ödeme
Unter Adalat CC treten dosisabhängig leichte bis mittelschwere periphere Ödeme auf. Die Placebo-Abzugsrate beträgt ungefähr 8 % bei 30 mg, 12 % bei 60 mg und 19 % bei 90 mg täglich. Dieses Ödem ist ein lokalisiertes Phänomen, von dem angenommen wird, dass es mit der Vasodilatation abhängiger Arteriolen und kleiner Blutgefäße zusammenhängt und nicht auf eine linksventrikuläre Dysfunktion oder eine allgemeine Flüssigkeitsretention zurückzuführen ist. Bei Patienten, deren Hypertonie durch dekompensierte Herzinsuffizienz kompliziert wird, sollte darauf geachtet werden, dieses periphere Ödem von den Auswirkungen einer zunehmenden linksventrikulären Dysfunktion zu unterscheiden.
Anwendung bei Patienten mit Zirrhose
Bei Patienten mit Zirrhose ist die Clearance von Nifedipin reduziert und die systemische Exposition erhöht. Es ist nicht bekannt, wie sich die systemische Exposition bei Patienten mit mäßiger oder schwerer Leberfunktionsstörung verändern kann. Sorgfältige Überwachung und Dosisreduktion können erforderlich sein; Erwägen Sie, die Therapie mit der niedrigsten verfügbaren Dosis zu beginnen.
Labortests
Seltene, normalerweise vorübergehende, aber gelegentlich signifikante Erhöhungen von Enzymen wie alkalischer Phosphatase, CPK, LDH, SGOT und SGPT wurden festgestellt. Die Beziehung zur Nifedipin-Therapie ist in den meisten Fällen ungewiss, in einigen Fällen jedoch wahrscheinlich. Diese Laboranomalien wurden selten mit klinischen Symptomen in Verbindung gebracht; es wurde jedoch über Cholestase mit oder ohne Gelbsucht berichtet. Bei Patienten, die mit Adalat 10 mg CC behandelt wurden, wurde ein geringer Anstieg (
Nifedipin verringert, wie andere Calciumkanalblocker, die Thrombozytenaggregation in vitro. Begrenzte klinische Studien haben bei einigen Nifedipin-Patienten eine moderate, aber statistisch signifikante Verringerung der Thrombozytenaggregation und eine Verlängerung der Blutungszeit gezeigt. Es wird angenommen, dass dies eine Funktion der Hemmung des Calciumtransports durch die Blutplättchenmembran ist. Für diese Befunde wurde keine klinische Bedeutung nachgewiesen.
Positive direkte Coombs-Tests mit oder ohne hämolytische Anämie wurden berichtet, aber ein kausaler Zusammenhang zwischen der Verabreichung von Nifedipin und der Positivität dieses Labortests, einschließlich Hämolyse, konnte nicht festgestellt werden.
Obwohl Nifedipin bei Patienten mit Nierenfunktionsstörung sicher angewendet wurde und in bestimmten Fällen über eine positive Wirkung berichtet wurde, wurde bei Patienten mit vorbestehender chronischer Niereninsuffizienz über seltene reversible Erhöhungen von BUN und Serum-Kreatinin berichtet. Die Beziehung zur Nifedipintherapie ist in den meisten Fällen ungewiss, in einigen Fällen jedoch wahrscheinlich.
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Nifedipin wurde zwei Jahre lang oral an Ratten verabreicht und erwies sich nicht als krebserregend. Bei Verabreichung an Ratten vor der Paarung verursachte Nifedipin eine verringerte Fertilität bei einer Dosis, die etwa dem 30-Fachen der maximal empfohlenen Dosis für den Menschen entsprach. Es gibt einen Literaturbericht über eine reversible Verringerung der Fähigkeit menschlicher Spermien, die von einer begrenzten Anzahl unfruchtbarer Männer erhalten wurden, die die empfohlenen Nifedipin-Dosen einnahmen, um in vitro an eine Eizelle zu binden und diese zu befruchten. In-vivo-Mutagenitätsstudien waren negativ.
Schwangerschaft
Schwangerschaftskategorie C
Bei Nagetieren, Kaninchen und Affen hat sich gezeigt, dass Nifedipin eine Vielzahl von embryotoxischen, plazentotoxischen, teratogenen und fetotoxischen Wirkungen hat, einschließlich verkümmerter Föten (Ratten, Mäuse und Kaninchen), digitalen Anomalien (Ratten und Kaninchen), Rippendeformitäten (Mäuse), Gaumenspalten (Mäuse), kleine Plazentas und unterentwickelte Chorionzotten (Affen), embryonaler und fötaler Tod (Ratten, Mäuse und Kaninchen), verlängerte Trächtigkeit (Ratten; bei anderen Spezies nicht untersucht) und verringerte Überlebensrate von Neugeborenen (Ratten; nicht untersucht bei andere Arten). Auf einer mg/kg- oder mg/m²-Basis sind einige der mit diesen verschiedenen Wirkungen verbundenen Dosen höher als die maximal empfohlene Dosis für den Menschen und einige niedriger, aber alle liegen in einer Größenordnung davon.
Die bei Nifedipin-exponierten Kaninchenwelpen beobachteten digitalen Anomalien sind denen, die bei Welpen beobachtet werden, die Phenytoin ausgesetzt waren, auffallend ähnlich, und diese ähneln wiederum den Phalangealdeformitäten, die die häufigste Missbildung sind, die bei menschlichen Kindern mit in utero-Exposition gegenüber Phenytoin beobachtet wird.
Aus den verfügbaren klinischen Nachweisen geht kein spezifisches pränatales Risiko hervor. Es wurde jedoch über eine Zunahme von perinataler Asphyxie, Kaiserschnittgeburten, Frühgeburten und intrauteriner Wachstumsverzögerung berichtet.
Bei schwangeren Frauen muss der Blutdruck sorgfältig überwacht werden, wenn Nifedipin in Kombination mit IV-Magnesiumsulfat verabreicht wird, da die Möglichkeit eines übermäßigen Blutdruckabfalls besteht, der Mutter und Fötus schaden könnte.
Es liegen keine adäquaten und gut kontrollierten Studien bei Schwangeren vor.
Stillende Mutter
Nifedipin wird in die Muttermilch ausgeschieden. Stillenden Müttern wird geraten, ihre Babys während der Einnahme des Arzneimittels nicht zu stillen.
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von Adalat 30 mg CC bei pädiatrischen Patienten wurde nicht nachgewiesen.
Geriatrische Verwendung
Obwohl kleine pharmakokinetische Studien eine verlängerte Halbwertszeit und erhöhte Cmax und AUC identifiziert haben (siehe KLINISCHE PHARMAKOLOGIE : Pharmakokinetik und Stoffwechsel ) schlossen klinische Studien mit Nifedipin nicht genügend Probanden ab 65 Jahren ein, um festzustellen, ob sie anders reagieren als jüngere Probanden. Andere berichtete klinische Erfahrungen haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt. Im Allgemeinen sollte die Dosisauswahl für einen älteren Patienten vorsichtig sein und normalerweise am unteren Ende des Dosierungsbereichs beginnen, um die größere Häufigkeit einer verminderten Leber-, Nieren- oder Herzfunktion und einer Begleiterkrankung oder einer anderen medikamentösen Therapie widerzuspiegeln.
Patienten mit Galactose-Intoleranz
Da dieses Arzneimittel Lactose enthält, sollten Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorption dieses Arzneimittel nicht einnehmen.
ÜBERDOSIS
Die Erfahrungen mit einer Nifedipin-Überdosierung sind begrenzt. Symptome im Zusammenhang mit einer schweren Nifedipin-Überdosierung sind Bewusstlosigkeit, Blutdruckabfall, Herzrhythmusstörungen, metabolische Azidose, Hypoxie, kardiogener Schock mit Lungenödem. Im Allgemeinen erfordert eine Überdosierung mit Nifedipin, die zu einer ausgeprägten Hypotonie führt, eine aktive kardiovaskuläre Unterstützung, einschließlich Überwachung der kardiovaskulären und respiratorischen Funktion, Anheben der Extremitäten, vernünftige Anwendung von Kalziuminfusionen, blutdruckerhöhenden Mitteln und Flüssigkeiten. Nach oraler Einnahme ist eine gründliche Magenspülung angezeigt, ggf. in Kombination mit einer Dünndarmspülung. Im Falle einer Überdosierung eines Arzneimittels mit verzögerter Wirkstofffreisetzung wie Nifedipin muss die Elimination so vollständig wie möglich, auch aus dem Dünndarm, erfolgen, um eine spätere Resorption des Wirkstoffs zu verhindern. Zusätzliche Flüssigkeit oder zusätzliches Volumen muss wegen des Risikos einer Flüssigkeitsüberladung mit Vorsicht verabreicht werden.
Es ist zu erwarten, dass die Clearance von Nifedipin bei Patienten mit eingeschränkter Leberfunktion verlängert ist. Da Nifedipin stark an Proteine gebunden ist, ist eine Dialyse wahrscheinlich nicht von Nutzen; Plasmapherese kann jedoch vorteilhaft sein.
Es wurde ein Fall einer massiven Überdosierung mit Tabletten einer anderen Retardformulierung von Nifedipin berichtet. Die Hauptwirkungen der Einnahme von etwa 4800 mg Nifedipin bei einem jungen Mann, der infolge einer kokaininduzierten Depression einen Selbstmordversuch unternahm, waren anfänglicher Schwindel, Herzklopfen, Hitzewallungen und Nervosität. Innerhalb weniger Stunden nach der Einnahme traten Übelkeit, Erbrechen und allgemeine Ödeme auf. Bei der Präsentation, 18 Stunden nach der Einnahme, war keine signifikante Hypotonie erkennbar. Anomalien der Blutchemie bestanden aus einer leichten, vorübergehenden Erhöhung des Serumkreatinins und mäßigen Erhöhungen von LDH und CPK, aber normaler SGOT. Die Vitalfunktionen blieben stabil, es wurden keine elektrokardiographischen Anomalien festgestellt und die Nierenfunktion normalisierte sich innerhalb von 24 bis 48 Stunden allein mit routinemäßigen unterstützenden Maßnahmen. Es wurden keine längeren Folgen beobachtet.
Die Wirkung einer einzelnen Einnahme von 900 mg Nifedipin-Kapseln bei einem Patienten mit depressiver Angina pectoris auf trizyklische Antidepressiva war Bewusstlosigkeit innerhalb von 30 Minuten nach der Einnahme und schwere Hypotonie, die auf Calciuminfusion, blutdruckerhöhende Mittel und Flüssigkeitsersatz ansprach. Bei diesem Patienten mit Schenkelblock in der Anamnese, einschließlich Sinusbradykardie und AV-Block in unterschiedlichem Ausmaß, wurden verschiedene EKG-Anomalien beobachtet. Diese erforderten die prophylaktische Platzierung eines temporären ventrikulären Schrittmachers, lösten sich aber ansonsten spontan auf. Bei diesem Patienten wurde anfänglich eine signifikante Hyperglykämie beobachtet, aber die Plasmaglukosespiegel normalisierten sich schnell ohne weitere Behandlung.
Ein junger hypertensiver Patient mit fortgeschrittenem Nierenversagen nahm 280 mg Nifedipin-Kapseln auf einmal ein, was zu einer ausgeprägten Hypotonie führte, die auf eine Calciuminfusion und Flüssigkeiten ansprach. Es wurden weder Anomalien der AV-Überleitung, Arrhythmien oder ausgeprägte Änderungen der Herzfrequenz festgestellt, noch kam es zu einer weiteren Verschlechterung der Nierenfunktion.
Bradykarde Herzrhythmusstörungen können symptomatisch mit ß-Sympathomimetika behandelt werden, bei lebensbedrohlichen bradykarden Herzrhythmusstörungen kann eine vorübergehende Schrittmachertherapie sinnvoll sein.
KONTRAINDIKATIONEN
Die gleichzeitige Verabreichung mit starken P450-Induktoren wie Rifampin ist kontraindiziert, da die Wirksamkeit von Nifedipin-Tabletten erheblich reduziert werden könnte. (Sehen WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN )
Nifedipin darf nicht bei kardiogenem Schock angewendet werden.
Adalat ist bei Patienten mit bekannter Überempfindlichkeit gegen einen der Bestandteile der Tablette kontraindiziert.
KLINISCHE PHARMAKOLOGIE
Nifedipin ist ein Inhibitor des Calciumioneneinstroms (Slow-Channel-Blocker oder Calciumionenantagonist), der den transmembranösen Einstrom von Calciumionen in die glatte Gefäßmuskulatur und den Herzmuskel hemmt. Die kontraktilen Prozesse der glatten Gefäßmuskulatur und des Herzmuskels hängen von der Bewegung extrazellulärer Calciumionen in diese Zellen durch spezifische Ionenkanäle ab. Nifedipin hemmt selektiv den Einstrom von Calciumionen durch die Zellmembran der glatten Gefäßmuskulatur und des Herzmuskels, ohne die Calciumkonzentrationen im Serum zu verändern.
Wirkmechanismus
Der Mechanismus, durch den Nifedipin den arteriellen Blutdruck senkt, umfasst eine periphere arterielle Vasodilatation und folglich eine Verringerung des peripheren Gefäßwiderstands. Der erhöhte periphere Gefäßwiderstand, eine zugrunde liegende Ursache von Bluthochdruck, resultiert aus einer Erhöhung der aktiven Spannung in der glatten Gefäßmuskulatur. Studien haben gezeigt, dass die Erhöhung der aktiven Spannung eine Erhöhung des zytosolischen freien Calciums widerspiegelt.
Nifedipin ist ein peripherer arterieller Vasodilatator, der direkt auf die glatte Gefäßmuskulatur wirkt. Die Bindung von Nifedipin an spannungsabhängige und möglicherweise rezeptorgesteuerte Kanäle in der glatten Gefäßmuskulatur führt zu einer Hemmung des Calciumeinstroms durch diese Kanäle. Die intrazellulären Calciumvorräte in der glatten Gefäßmuskulatur sind begrenzt und hängen somit vom Einstrom von extrazellulärem Calcium ab, damit eine Kontraktion auftritt. Die Verringerung des Calciumeinstroms durch Nifedipin verursacht eine arterielle Vasodilatation und einen verringerten peripheren Gefäßwiderstand, was zu einem verringerten arteriellen Blutdruck führt.
Pharmakokinetik und Stoffwechsel
Nifedipin wird nach oraler Gabe vollständig resorbiert. Die Bioverfügbarkeit von Nifedipin als Adalat CC im Vergleich zu Nifedipin mit sofortiger Freisetzung liegt im Bereich von 84 % bis 89 %. Nach der Einnahme von Adalat CC-Tabletten unter nüchternen Bedingungen erreichen die Plasmakonzentrationen ihren Höhepunkt nach etwa 2,5 bis 5 Stunden, wobei ein zweiter kleiner Peak oder eine zweite Schulter etwa 6 bis 12 Stunden nach der Einnahme auftritt. Die Eliminationshalbwertszeit von Nifedipin, verabreicht als Adalat CC, beträgt etwa 7 Stunden im Gegensatz zu der bekannten Eliminationshalbwertszeit von 2 Stunden von Nifedipin, verabreicht als Kapsel mit sofortiger Freisetzung.
Wenn Adalat CC als Vielfaches von 30-mg-Tabletten über einen Dosisbereich von 30 mg bis 90 mg verabreicht wird, ist die Fläche unter der Kurve (AUC) dosisproportional; Die maximale Plasmakonzentration für die 90-mg-Dosis, gegeben als 3 x 30 mg, ist jedoch um 29 % höher als anhand der 30-mg- und 60-mg-Dosen vorhergesagt.
Zwei 30 mg Adalat CC Tabletten können gegen eine 60 mg Adalat CC Tablette ausgetauscht werden. Drei 30 mg Adalat CC-Tabletten führen jedoch zu wesentlich höheren Cmax-Werten als nach einer einzelnen 90 mg Adalat 20 mg CC-Tablette. Drei 30-mg-Tabletten sollten daher nicht als austauschbar mit einer 90-mg-Tablette angesehen werden.
Die einmal tägliche Gabe von Adalat CC unter nüchternen Bedingungen führt zu geringeren Schwankungen der Nifedipin-Plasmakonzentration im Vergleich zur 3-mal täglichen Gabe von Nifedipin-Kapseln mit sofortiger Wirkstofffreisetzung. Die mittlere Spitzenplasmakonzentration von Nifedipin nach Einnahme einer 90-mg-Tablette Adalat 30 mg CC im Nüchternzustand beträgt etwa 115 ng/ml. Wenn Adalat CC bei gesunden Probanden unmittelbar nach einer fettreichen Mahlzeit verabreicht wird, kommt es zu einem durchschnittlichen Anstieg der Nifedipin-Spitzenkonzentration im Plasma um 60 %, zu einer Verlängerung der Zeit bis zur Spitzenkonzentration, aber zu keiner signifikanten Veränderung der AUC. Die Plasmakonzentrationen von Nifedipin, wenn Adalat 20 mg CC nach einer fettreichen Mahlzeit eingenommen wird, führen zu leicht niedrigeren Spitzen im Vergleich zur gleichen Tagesdosis der Formulierung mit sofortiger Freisetzung, die in drei getrennten Dosen verabreicht wird. Dies kann teilweise daran liegen, dass Adalat CC weniger bioverfügbar ist als die Formulierung mit sofortiger Freisetzung.
Nifedipin wird weitgehend zu hoch wasserlöslichen, inaktiven Metaboliten metabolisiert, die 60 % bis 80 % der mit dem Urin ausgeschiedenen Dosis ausmachen. Im Urin sind nur Spuren (weniger als 0,1 % der Dosis) der unveränderten Form nachweisbar. Der Rest wird in metabolisierter Form mit dem Kot ausgeschieden, höchstwahrscheinlich als Folge einer biliären Ausscheidung.
Nifedipin wird über das Cytochrom P450 3A4-System metabolisiert. Arzneimittel, von denen bekannt ist, dass sie dieses Enzymsystem entweder hemmen oder induzieren, können den First Pass oder die Clearance von Nifedipin verändern.
Es wurden keine Studien mit Adalat 30 mg CC bei Patienten mit Nierenversagen durchgeführt; Es wurden jedoch keine signifikanten Veränderungen der Pharmakokinetik von Nifedipin-Kapseln mit sofortiger Freisetzung bei Patienten berichtet, die sich einer Hämodialyse oder einer chronischen ambulanten Peritonealdialyse unterziehen. Da die Resorption von Nifedipin aus Adalat CC durch eine Nierenerkrankung verändert werden könnte, ist bei der Behandlung solcher Patienten Vorsicht geboten.
Da Nifedipin über das Cytochrom-P450-3A4-System metabolisiert wird, kann seine Pharmakokinetik bei Patienten mit chronischer Lebererkrankung verändert sein. Adalat 20 mg CC wurde bei Patienten mit Lebererkrankungen nicht untersucht; bei Patienten mit eingeschränkter Leberfunktion (Leberzirrhose) hat Nifedipin jedoch eine längere Eliminationshalbwertszeit und eine höhere Bioverfügbarkeit als bei gesunden Probanden.
Der Proteinbindungsgrad von Nifedipin ist hoch (92 % - 98 %). Die Proteinbindung kann bei Patienten mit eingeschränkter Nieren- oder Leberfunktion stark reduziert sein.
Nach Verabreichung von Adalat 30 mg CC an gesunde ältere Männer und Frauen (Alter > 60 Jahre) ist die mittlere Cmax um 36 % höher und die durchschnittliche Plasmakonzentration um 70 % höher als bei jüngeren Patienten.
Bei gesunden Probanden war die Eliminationshalbwertszeit einer anderen Nifedipin-Formulierung mit verzögerter Freisetzung bei älteren Probanden (6,7 h) länger als bei jungen Probanden (3,8 h) nach oraler Verabreichung. Eine verringerte Clearance wurde auch bei älteren Personen (348 ml/min) im Vergleich zu jungen Probanden (519 ml/min) nach intravenöser Verabreichung beobachtet.
Die gleichzeitige Anwendung von Nifedipin mit Grapefruitsaft führt aufgrund der Hemmung des CYP3A-bedingten First-Pass-Metabolismus zu einem bis zu 2-fachen Anstieg der AUC und Cmax. Die Einnahme von Grapefruit und Grapefruitsaft sollte während der Einnahme von Nifedipin vermieden werden.
Klinische Studien
Adalat 10 mg CC führte zu einer dosisabhängigen Senkung des systolischen und diastolischen Blutdrucks, wie in zwei doppelblinden, randomisierten, placebokontrollierten Studien gezeigt wurde, in denen über 350 Patienten 6 Wochen lang einmal täglich mit 30, 60 oder 90 mg Adalat CC behandelt wurden. In der ersten Studie wurde Adalat 10 mg CC als Monotherapie verabreicht und in der zweiten Studie wurde Adalat 20 mg CC zusätzlich zu einem Betablocker bei Patienten verabreicht, die mit einem Betablocker allein nicht kontrolliert werden konnten. Die Ergebnisse des mittleren Talblutdrucks (24 Stunden nach der Einnahme) aus diesen Studien sind nachstehend aufgeführt:
MITTLERE REDUZIERUNGEN DES BLUTDRUCKS IN DER LAGE (MMHg) SYSTOLISCH/DIASTOLISCH
Die aus der 24-Stunden-Blutdrucküberwachung geschätzten Tal-Spitzen-Verhältnisse lagen im Bereich von 41 % bis 78 % für den diastolischen und 46 % bis 91 % für den systolischen Blutdruck.
Hämodynamik
Wie andere Slow-Channel-Blocker übt Nifedipin eine negativ inotrope Wirkung auf isoliertes Myokardgewebe aus. Dies wird selten, wenn überhaupt, bei intakten Tieren oder Menschen beobachtet, wahrscheinlich aufgrund von Reflexreaktionen auf seine gefäßerweiternden Wirkungen. Beim Menschen verringert Nifedipin den peripheren Gefäßwiderstand, was zu einem Abfall des systolischen und diastolischen Drucks führt, der bei normotensiven Freiwilligen normalerweise minimal ist (weniger als 5–10 mm Hg systolisch), aber manchmal größer ist. Bei Adalat 30 mg CC gehen diese Blutdrucksenkungen nicht mit einer signifikanten Änderung der Herzfrequenz einher. Hämodynamische Studien der Nifedipin-Formulierung mit sofortiger Freisetzung bei Patienten mit normaler ventrikulärer Funktion haben im Allgemeinen einen kleinen Anstieg des Herzindex ohne größere Auswirkungen auf die Ejektionsfraktion, den linksventrikulären enddiastolischen Druck (LVEDP) oder das Volumen (LVEDV) festgestellt. Bei Patienten mit eingeschränkter Ventrikelfunktion haben die meisten akuten Studien eine gewisse Erhöhung der Ejektionsfraktion und eine Verringerung des linksventrikulären Füllungsdrucks gezeigt.
Elektrophysiologische Wirkungen
Obwohl Nifedipin, wie andere Mitglieder seiner Klasse, in isolierten myokardialen Präparaten eine leichte Unterdrückung der Funktion des Sinusknotens und der atrioventrikulären Überleitung verursacht, wurden solche Wirkungen in Studien an intakten Tieren oder Menschen nicht beobachtet. In formalen elektrophysiologischen Studien, vorwiegend bei Patienten mit normalem Erregungsleitungssystem, hatte Nifedipin, das als Kapsel mit sofortiger Freisetzung verabreicht wurde, keine Tendenz, die atrioventrikuläre Überleitung oder die Erholungszeit des Sinusknotens zu verlängern oder die Sinusfrequenz zu verlangsamen.
INFORMATIONEN ZUM PATIENTEN
Adalat CC ist eine Retardtablette und sollte unzerkaut geschluckt und auf nüchternen Magen eingenommen werden. Es sollte nicht mit Nahrung verabreicht werden. Tabletten nicht kauen, teilen oder zerdrücken.