Vasotec 2.5mg, 5mg, 10mg Enalapril Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Vasotec und wie wird es angewendet?
Vasotec ist ein verschreibungspflichtiges Arzneimittel zur Behandlung von Symptomen von Bluthochdruck (Hypertonie), linksventrikulärer Dysfunktion und dekompensierter Herzinsuffizienz. Vasotec kann allein oder mit anderen Medikamenten verwendet werden.
Was sind die möglichen Nebenwirkungen von Vasotec 2,5 mg?
Vasotec 2,5 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Vasotec gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Vasotec. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
WARNUNG
Fötale Toxizität
BEZEICHNUNG
VASOTEC® (Enalapril Maleate) ist das Maleatsalz von Enalapril, dem Ethylester eines langwirksamen Angiotensin-Converting-Enzyme-Inhibitors, Enalaprilat. Enalaprilmaleat wird chemisch als (S)-1[N-[1-(Ethoxycarbonyl)-3-phenylpropyl]-L-alanyl]-L-prolin, (Z)-2-Butendioatsalz (1:1) beschrieben. Seine Summenformel ist C20H28N2O5•C4H4O4 und seine Strukturformel ist:
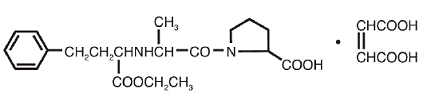
Enalaprilmaleat ist ein weißes bis cremefarbenes, kristallines Pulver mit einem Molekulargewicht von 492,53. Es ist schwer löslich in Wasser, löslich in Ethanol und frei löslich in Methanol.
Enalapril ist ein Prodrug; nach oraler Verabreichung wird es durch Hydrolyse des Ethylesters zu Enalaprilat, dem aktiven Inhibitor des Angiotensin-Converting-Enzyms, bioaktiviert.
Enalaprilmaleat wird als 2,5-mg-, 5-mg-, 10-mg- und 20-mg-Tabletten zur oralen Verabreichung geliefert. Neben dem Wirkstoff Enalaprilmaleat enthält jede Tablette die folgenden Hilfsstoffe: Lactose, Magnesiumstearat, Natriumbicarbonat und Stärke. Die 10-mg- und 20-mg-Tabletten enthalten außerdem Eisenoxide.
INDIKATIONEN
Hypertonie
VASOTEC ist angezeigt zur Behandlung von Bluthochdruck.
VASOTEC ist allein oder in Kombination mit anderen Antihypertonika, insbesondere Diuretika vom Thiazidtyp, wirksam. Die blutdrucksenkende Wirkung von VASOTEC 10 mg und Thiaziden ist ungefähr additiv.
Herzfehler
VASOTEC ist indiziert zur Behandlung der symptomatischen dekompensierten Herzinsuffizienz, üblicherweise in Kombination mit Diuretika und Digitalis. Bei diesen Patienten verbessert VASOTEC 5 mg die Symptome, verlängert die Überlebenszeit und verringert die Häufigkeit von Krankenhauseinweisungen (siehe KLINISCHE PHARMAKOLOGIE , Herzfehler , Mortality Trials für Einzelheiten und Einschränkungen von Überlebensstudien ).
Asymptomatische linksventrikuläre Dysfunktion
Bei klinisch stabilen asymptomatischen Patienten mit linksventrikulärer Dysfunktion (Ejektionsfraktion ≤ 35 Prozent) verringert VASOTEC 5 mg die Rate der Entwicklung einer manifesten Herzinsuffizienz und verringert die Inzidenz von Krankenhauseinweisungen wegen Herzinsuffizienz (siehe KLINISCHE PHARMAKOLOGIE , Herzfehler , Mortality Trials für Einzelheiten und Einschränkungen von Überlebensstudien ).
Bei der Anwendung von VASOTEC 2,5 mg sollte berücksichtigt werden, dass ein anderer Hemmer des Angiotensin-Converting-Enzyms, Captopril, Agranulozytose verursacht hat, insbesondere bei Patienten mit eingeschränkter Nierenfunktion oder Kollagenose, und dass die verfügbaren Daten nicht ausreichen, um zu zeigen, dass dies bei VASOTEC 2,5 mg nicht der Fall ist haben ein ähnliches Risiko (vgl WARNUNGEN ).
Bei der Erwägung der Anwendung von VASOTEC sollte beachtet werden, dass ACE-Hemmer in kontrollierten klinischen Studien bei Patienten mit schwarzer Hautfarbe einen geringeren Einfluss auf den Blutdruck haben als bei Patienten mit nicht schwarzer Hautfarbe. Darüber hinaus sollte beachtet werden, dass bei Patienten mit schwarzer Hautfarbe, die ACE-Hemmer erhielten, im Vergleich zu nicht-schwarzen Patienten eine höhere Inzidenz von Angioödemen berichtet wurde (siehe WARNUNGEN , Kopf-Hals-Angioödem ).
DOSIERUNG UND ANWENDUNG
Hypertonie
Bei Patienten, die derzeit mit einem Diuretikum behandelt werden, kann nach der Anfangsdosis von VASOTEC gelegentlich eine symptomatische Hypotonie auftreten. Das Diuretikum sollte, wenn möglich, zwei bis drei Tage vor Beginn der Therapie mit VASOTEC abgesetzt werden, um die Wahrscheinlichkeit einer Hypotonie zu verringern (siehe WARNUNGEN ). Wenn der Blutdruck des Patienten mit VASOTEC allein nicht kontrolliert werden kann, kann die diuretische Therapie wieder aufgenommen werden.
Wenn das Diuretikum nicht abgesetzt werden kann, sollte eine Anfangsdosis von 2,5 mg unter ärztlicher Aufsicht für mindestens zwei Stunden und bis zur Stabilisierung des Blutdrucks für mindestens eine weitere Stunde angewendet werden (siehe Abschnitt 4.4). WARNUNGEN und VORSICHTSMASSNAHMEN , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ).
Die empfohlene Anfangsdosis bei Patienten, die keine Diuretika einnehmen, beträgt 5 mg einmal täglich. Die Dosierung sollte entsprechend dem Ansprechen des Blutdrucks angepasst werden. Der übliche Dosierungsbereich beträgt 10 bis 40 mg pro Tag, verabreicht in einer Einzeldosis oder zwei aufgeteilten Dosen. Bei einigen Patienten, die einmal täglich behandelt werden, kann die blutdrucksenkende Wirkung gegen Ende des Dosierungsintervalls nachlassen. Bei solchen Patienten sollte eine Erhöhung der Dosis oder eine zweimal tägliche Verabreichung in Betracht gezogen werden. Wenn der Blutdruck mit VASOTEC 2,5 mg allein nicht kontrolliert werden kann, kann ein Diuretikum hinzugefügt werden. Die gleichzeitige Verabreichung von VASOTEC 5 mg mit Kaliumpräparaten, Kaliumsalzersatzmitteln oder kaliumsparenden Diuretika kann zu einem Anstieg des Serumkaliums führen (siehe VORSICHTSMASSNAHMEN ).
Dosisanpassung bei hypertensiven Patienten mit eingeschränkter Nierenfunktion
Die übliche Enalapril-Dosis wird für Patienten mit einer Kreatinin-Clearance von mehr als 30 ml/min (Serum-Kreatinin von bis zu etwa 3 mg/dl) empfohlen. Bei Patienten mit einer Kreatinin-Clearance von höchstens 30 ml/min (Serumkreatinin von höchstens 3 mg/dl) beträgt die erste Dosis 2,5 mg einmal täglich. Die Dosis kann nach oben titriert werden, bis der Blutdruck kontrolliert ist, oder bis zu einer Höchstdosis von 40 mg täglich.
Herzfehler
VASOTEC ist angezeigt zur Behandlung der symptomatischen Herzinsuffizienz, üblicherweise in Kombination mit Diuretika und Digitalis. In den placebokontrollierten Studien, die eine verbesserte Überlebenszeit zeigten, wurden die Patienten je nach Verträglichkeit auf bis zu 40 mg titriert, die in zwei getrennten Dosen verabreicht wurden.
Die empfohlene Anfangsdosis beträgt 2,5 mg. Der empfohlene Dosierungsbereich beträgt 2,5 bis 20 mg zweimal täglich. Die Dosis sollte je nach Verträglichkeit über einen Zeitraum von einigen Tagen oder Wochen erhöht werden. Die in klinischen Studien verabreichte maximale Tagesdosis betrug 40 mg in aufgeteilten Dosen.
Nach der Anfangsdosis von VASOTEC sollte der Patient mindestens zwei Stunden lang unter ärztlicher Aufsicht beobachtet werden und mindestens eine weitere Stunde lang, bis sich der Blutdruck stabilisiert hat (siehe WARNUNGEN und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ). Wenn möglich, sollte die Dosis eines gleichzeitig verabreichten Diuretikums reduziert werden, was die Wahrscheinlichkeit einer Hypotonie verringern kann. Das Auftreten einer Hypotonie nach der Anfangsdosis von VASOTEC schließt eine anschließende sorgfältige Dosistitration mit dem Arzneimittel nach einer wirksamen Behandlung der Hypotonie nicht aus.
Asymptomatische linksventrikuläre Dysfunktion
In der Studie, die die Wirksamkeit zeigte, wurden die Patienten mit 2,5 mg zweimal täglich begonnen und je nach Verträglichkeit auf die angestrebte Tagesdosis von 20 mg (in aufgeteilten Dosen) titriert.
Nach der Anfangsdosis von VASOTEC 10 mg sollte der Patient mindestens zwei Stunden lang unter ärztlicher Aufsicht beobachtet werden und mindestens eine weitere Stunde lang, bis sich der Blutdruck stabilisiert hat (siehe WARNUNGEN und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ). Wenn möglich, sollte die Dosis eines gleichzeitig verabreichten Diuretikums reduziert werden, was die Wahrscheinlichkeit einer Hypotonie verringern kann. Das Auftreten einer Hypotonie nach der Anfangsdosis von VASOTEC 5 mg schließt eine anschließende sorgfältige Dosistitration mit dem Arzneimittel nach einer wirksamen Behandlung der Hypotonie nicht aus.
Dosisanpassung bei Patienten mit Herzinsuffizienz und eingeschränkter Nierenfunktion oder Hyponatriämie
Bei Patienten mit Herzinsuffizienz mit Hyponatriämie (Serum-Natrium unter 130 mÄq/l) oder mit Serum-Kreatinin über 1,6 mg/dl sollte die Therapie mit 2,5 mg täglich unter engmaschiger ärztlicher Überwachung begonnen werden (siehe Herzfehler , WARNUNGEN und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ). Die Dosis kann auf 2,5 mg 2-mal täglich, dann 5 mg 2-mal täglich und nach Bedarf erhöht werden, üblicherweise in Abständen von mindestens vier Tagen, wenn zum Zeitpunkt der Dosisanpassung keine übermäßige Hypotonie oder signifikante Verschlechterung der Nierenfunktion vorliegt. Die maximale Tagesdosis beträgt 40 mg.
Pädiatrische hypertensive Patienten
Die übliche empfohlene Anfangsdosis beträgt 0,08 mg/kg (bis zu 5 mg) einmal täglich. Die Dosierung sollte entsprechend dem Ansprechen des Blutdrucks angepasst werden. Dosen über 0,58 mg/kg (oder über 40 mg) wurden bei pädiatrischen Patienten nicht untersucht (siehe KLINISCHE PHARMAKOLOGIE , Klinische Pharmakologie bei pädiatrischen Patienten ).
VASOTEC 5 mg wird bei Neugeborenen und pädiatrischen Patienten mit einer glomerulären Filtrationsrate von weniger als 30 ml/min/1,73 m² nicht empfohlen, da keine Daten verfügbar sind.
Vorbereitung der Suspension (für 200 ml einer 1,0 mg/ml Suspension)
Geben Sie 50 ml Bicitra® in eine Flasche aus Polyethylenterephthalat (PET), die zehn 20-mg-Tabletten VASOTEC 10 mg enthält, und schütteln Sie sie mindestens 2 Minuten lang. Konzentrat 60 Minuten stehen lassen. Schütteln Sie das Konzentrat nach der Haltezeit von 60 Minuten eine weitere Minute lang. Fügen Sie dem Konzentrat in der PET-Flasche 150 ml Ora-Sweet SF™2 hinzu und schütteln Sie die Suspension, um die Inhaltsstoffe zu verteilen. Die Suspension sollte bei 2-8°C (36-46°F) gekühlt werden und kann bis zu 30 Tage gelagert werden. Schütteln Sie die Suspension vor jedem Gebrauch.
WIE GELIEFERT
Lagerung
Bei 25 °C (77 °F) lagern; Exkursionen bis 15-30°C (59-86°F) erlaubt [siehe USP kontrollierte Raumtemperatur ].
Behälter dicht geschlossen halten.
Vor Feuchtigkeit schützen.
Abgabe in einem dichten Behälter gemäß USP, wenn die Produktverpackung unterteilt ist.
Hergestellt für: Valeant Pharmaceuticals North America LLC Bridgewater, NJ 08807 USA. Hergestellt von: Valeant Pharmaceuticals International, Inc. Steinbach, MB R5G 1Z7 Kanada. Revision: Juli 2017.
NEBENWIRKUNGEN
Die Sicherheit von VASOTEC wurde bei mehr als 10.000 Patienten bewertet, darunter mehr als 1.000 Patienten, die ein Jahr oder länger behandelt wurden. VASOTEC 10 mg hat sich in kontrollierten klinischen Studien mit 2987 Patienten als allgemein gut verträglich erwiesen. Zum größten Teil waren die negativen Erfahrungen mild und vorübergehender Natur. In klinischen Studien war bei 3,3 Prozent der Patienten mit Bluthochdruck und bei 5,7 Prozent der Patienten mit Herzinsuffizienz ein Abbruch der Therapie aufgrund klinischer Nebenwirkungen erforderlich. Die Häufigkeit von Nebenwirkungen stand in keinem Zusammenhang mit der täglichen Gesamtdosis innerhalb der üblichen Dosierungsbereiche. Bei Patienten mit Bluthochdruck war der Gesamtprozentsatz der mit VASOTEC behandelten Patienten, die über Nebenwirkungen berichteten, mit Placebo vergleichbar.
Hypertonie
Unerwünschte Erfahrungen, die bei mehr als einem Prozent der Patienten mit Bluthochdruck auftraten, die in kontrollierten klinischen Studien mit VASOTEC 2,5 mg behandelt wurden, sind unten aufgeführt. Bei mit VASOTEC behandelten Patienten betrug die maximale Behandlungsdauer drei Jahre; bei mit Placebo behandelten Patienten betrug die maximale Therapiedauer 12 Wochen.
Herzfehler
Unerwünschte Erfahrungen, die bei mehr als einem Prozent der mit VASOTEC 5 mg behandelten Patienten mit Herzinsuffizienz auftraten, sind unten aufgeführt. Die Inzidenzen stellen die Erfahrungen sowohl aus kontrollierten als auch aus unkontrollierten klinischen Studien dar (die maximale Therapiedauer betrug etwa ein Jahr). Bei den mit Placebo behandelten Patienten stammen die berichteten Inzidenzen aus den kontrollierten Studien (die maximale Behandlungsdauer beträgt 12 Wochen). Der Prozentsatz der Patienten mit schwerer Herzinsuffizienz (NYHA-Klasse IV) betrug 29 Prozent bzw. 43 Prozent bei Patienten, die mit VASOTEC 2,5 mg bzw. Placebo behandelt wurden.
Andere schwerwiegende klinische Nebenwirkungen, die seit der Markteinführung des Medikaments aufgetreten sind, oder Nebenwirkungen, die bei 0,5 bis 1,0 Prozent der Patienten mit Bluthochdruck oder Herzinsuffizienz in klinischen Studien auftraten, sind unten aufgeführt und innerhalb jeder Kategorie nach abnehmendem Schweregrad geordnet.
Körper als Ganzes
Anaphylaktoide Reaktionen (vgl WARNUNGEN , Anaphylaktoide und möglicherweise verwandte Reaktionen ).
Herz-Kreislauf
Herzstillstand; Myokardinfarkt oder zerebrovaskuläre Insult, möglicherweise als Folge einer übermäßigen Hypotonie bei Hochrisikopatienten (siehe WARNUNGEN , Hypotonie ); Lungenembolie und Infarkt; Lungenödem; Rhythmusstörungen einschließlich atrialer Tachykardie und Bradykardie; Vorhofflimmern; Herzklopfen, Raynaud-Phänomen.
Verdauungs
Ileus, Pankreatitis, Leberversagen, Hepatitis (hepatozellulär [bei erneuter Belastung nachgewiesen] oder cholestatischer Ikterus) (vgl WARNUNGEN , Leberversagen ), Meläna, Anorexie, Dyspepsie, Verstopfung, Glossitis, Stomatitis, Mundtrockenheit.
Hämatologisch
Seltene Fälle von Neutropenie, Thrombozytopenie und Knochenmarkdepression.
Bewegungsapparat
Muskelkrämpfe.
Nervös/Psychiatrisch
Depression, Verwirrtheit, Ataxie, Schläfrigkeit, Schlaflosigkeit, Nervosität, periphere Neuropathie (z. B. Parästhesie, Dysästhesie), Traumanomalie.
Atmung
Bronchospasmus, Rhinorrhoe, Halsschmerzen und Heiserkeit, Asthma, Infektion der oberen Atemwege, Lungeninfiltrate, eosinophile Pneumonitis.
Haut
Exfoliative Dermatitis, toxische epidermale Nekrolyse, Stevens-Johnson-Syndrom, Pemphigus, Herpes zoster, Erythema multiforme, Urtikaria, Pruritus, Alopezie, Flush, Schwitzen, Lichtempfindlichkeit.
Besondere Sinne
Verschwommenes Sehen, Geschmacksveränderungen, Anosmie, Tinnitus, Konjunktivitis, trockene Augen, Tränenfluss.
Urogenital
Nierenversagen, Oligurie, Nierenfunktionsstörung (vgl VORSICHTSMASSNAHMEN und DOSIERUNG UND ANWENDUNG ), Flankenschmerzen, Gynäkomastie, Impotenz.
Sonstig
Es wurde über einen Symptomkomplex berichtet, der einige oder alle der folgenden Symptome umfassen kann: ein positives ANA, eine erhöhte Erythrozytensedimentationsrate, Arthralgie/Arthritis, Myalgie/Myositis, Fieber, Serositis, Vaskulitis, Leukozytose, Eosinophilie, Lichtempfindlichkeit, Hautausschlag und andere Dermatologie Manifestationen.
Angioödem
Angioödeme wurden bei Patienten berichtet, die VASOTEC 2,5 mg erhielten, mit einer höheren Inzidenz bei Patienten mit schwarzer Hautfarbe als bei Patienten mit nicht schwarzer Hautfarbe. Angioödeme in Verbindung mit Larynxödemen können tödlich sein. Wenn ein Angioödem des Gesichts, der Extremitäten, der Lippen, der Zunge, der Stimmritze und/oder des Kehlkopfes auftritt, sollte die Behandlung mit VASOTEC abgebrochen und sofort eine geeignete Therapie eingeleitet werden (siehe WARNUNGEN ).
Hypotonie
Bei den Bluthochdruckpatienten trat bei 0,9 Prozent eine Hypotonie und bei 0,5 Prozent der Patienten nach der Anfangsdosis oder während einer längeren Therapie eine Synkope auf. Hypotonie oder Synkope waren bei 0,1 Prozent der Bluthochdruckpatienten ein Grund für den Therapieabbruch. Bei Patienten mit Herzinsuffizienz trat bei 6,7 Prozent der Patienten eine Hypotonie und bei 2,2 Prozent der Patienten eine Synkope auf. Hypotonie oder Synkope waren bei 1,9 Prozent der Patienten mit Herzinsuffizienz ein Grund für den Therapieabbruch (vgl WARNUNGEN ).
Husten
Sehen VORSICHTSMASSNAHMEN , Husten .
Pädiatrische Patienten
Das Nebenwirkungsprofil bei pädiatrischen Patienten scheint ähnlich dem bei erwachsenen Patienten zu sein.
Klinische Labortestergebnisse
Serumelektrolyte
Hyperkaliämie (vgl VORSICHTSMASSNAHMEN ), Hyponatriämie.
Kreatinin, Blut-Harnstoff-Stickstoff
In kontrollierten klinischen Studien wurde bei etwa 0,2 Prozent der mit VASOTEC allein behandelten Patienten mit essentieller Hypertonie ein geringfügiger Anstieg des Blut-Harnstoff-Stickstoffs und des Serum-Kreatinins beobachtet, der nach Absetzen der Therapie reversibel war. Erhöhungen treten eher bei Patienten auf, die gleichzeitig Diuretika erhalten, oder bei Patienten mit Nierenarterienstenose (vgl VORSICHTSMASSNAHMEN ). Bei Patienten mit Herzinsuffizienz, die auch Diuretika mit oder ohne Digitalis erhielten, wurde bei etwa 11 Prozent der Patienten ein Anstieg des Blut-Harnstoff-Stickstoffs oder des Serum-Kreatinins beobachtet, der normalerweise nach Absetzen von VASOTEC 5 mg und/oder einer anderen begleitenden Diuretika-Therapie reversibel war. Anstiege des Blut-Harnstoff-Stickstoffs oder -Kreatinins waren bei 1,2 Prozent der Patienten ein Grund für das Absetzen.
Hämatologie
Kleine Abnahmen von Hämoglobin und Hämatokrit (mittlere Abnahmen von etwa 0,3 g-Prozent bzw. 1,0 Vol.-%) treten häufig bei Patienten mit Hypertonie oder dekompensierter Herzinsuffizienz auf, die mit VASOTEC 5 mg behandelt werden, sind aber selten von klinischer Bedeutung, es sei denn, es besteht gleichzeitig eine andere Ursache der Anämie. In klinischen Studien brachen weniger als 0,1 Prozent der Patienten die Therapie aufgrund von Anämie ab. Hämolytische Anämie, einschließlich Fälle von Hämolyse bei Patienten mit G6PD-Mangel, wurde berichtet; ein Kausalzusammenhang mit Enalapril kann nicht ausgeschlossen werden.
Leberfunktionstest
Es sind Erhöhungen der Leberenzyme und/oder des Serumbilirubins aufgetreten (siehe WARNUNGEN , Leberversagen ).
Um VERMUTLICHE NEBENWIRKUNGEN zu melden, kontaktieren Sie Valeant Pharmaceuticals North America LLC unter 1-800-321-4576 oder die FDA unter 1-800-FDA-1088 oder www.fda.gov/medwatch.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Neprilysin-Inhibitoren
Bei Patienten, die gleichzeitig Neprilysin-Inhibitoren einnehmen, besteht möglicherweise ein erhöhtes Risiko für ein Angioödem. (sehen WARNUNGEN )
Duale Blockade des Renin-Angiotensin-Systems (RAS)
Die duale Blockade des RAS mit Angiotensinrezeptorblockern, ACE-Hemmern oder Aliskiren ist im Vergleich zur Monotherapie mit einem erhöhten Risiko für Hypotonie, Hyperkaliämie und Veränderungen der Nierenfunktion (einschließlich akutem Nierenversagen) verbunden. Die meisten Patienten, die die Kombination von zwei RAS-Hemmern erhalten, erhalten keinen zusätzlichen Nutzen im Vergleich zur Monotherapie. Vermeiden Sie im Allgemeinen die kombinierte Anwendung von RAS-Hemmern. Bei Patienten, die VASOTEC 2,5 mg und andere Wirkstoffe, die das RAS beeinflussen, erhalten, sind Blutdruck, Nierenfunktion und Elektrolyte engmaschig zu überwachen.
Verabreichen Sie Aliskiren nicht zusammen mit VASOTEC 5 mg bei Patienten mit Diabetes. Vermeiden Sie die Anwendung von Aliskiren mit VASOTEC bei Patienten mit eingeschränkter Nierenfunktion (GFR
Hypotonie – Patienten unter diuretischer Therapie
Bei Patienten, die mit Diuretika behandelt werden, und insbesondere bei Patienten, bei denen vor kurzem eine diuretische Therapie begonnen wurde, kann es nach Beginn der Therapie mit Enalapril gelegentlich zu einer übermäßigen Blutdrucksenkung kommen. Die Möglichkeit blutdrucksenkender Wirkungen von Enalapril kann minimiert werden, indem entweder das Diuretikum abgesetzt oder die Salzaufnahme vor Beginn der Behandlung mit Enalapril erhöht wird. Wenn es notwendig ist, das Diuretikum fortzusetzen, sorgen Sie nach der Anfangsdosis für mindestens zwei Stunden und bis sich der Blutdruck für mindestens eine weitere Stunde stabilisiert hat, für eine engmaschige ärztliche Überwachung (siehe Abschnitt 4.4). WARNUNGEN und DOSIERUNG UND ANWENDUNG ).
Wirkstoffe, die die Freisetzung von Renin verursachen
Die blutdrucksenkende Wirkung von VASOTEC 10 mg wird durch blutdrucksenkende Mittel verstärkt, die eine Reninfreisetzung bewirken (z. B. Diuretika).
Nichtsteroidale Entzündungshemmer einschließlich selektiver Cyclooxygenase-2-Hemmer (COX-2-Hemmer)
Bei älteren Patienten, Patienten mit Volumenmangel (einschließlich Patienten unter Diuretikatherapie) oder mit eingeschränkter Nierenfunktion kann die gleichzeitige Anwendung von NSAIDs, einschließlich selektiver COX-2-Hemmer, mit ACE-Hemmern, einschließlich Enalapril, zu einer Verschlechterung der Nierenfunktion führen, einschließlich möglicherweise akutes Nierenversagen. Diese Effekte sind normalerweise reversibel. Überwachen Sie regelmäßig die Nierenfunktion bei Patienten, die eine Enalapril- und NSAID-Therapie erhalten.
In einer klinisch-pharmakologischen Studie wurde Indomethacin oder Sulindac Patienten mit Bluthochdruck verabreicht, die VASOTEC erhielten. In dieser Studie gab es keine Hinweise auf eine Abschwächung der blutdrucksenkenden Wirkung von VASOTEC. Berichte deuten jedoch darauf hin, dass NSAIDs die blutdrucksenkende Wirkung von ACE-Hemmern verringern können.
Andere kardiovaskuläre Mittel
VASOTEC 10 mg wurde gleichzeitig mit Betablockern, Methyldopa, Nitraten, Kalziumblockern, Hydralazin, Prazosin und Digoxin angewendet, ohne dass es zu klinisch signifikanten Nebenwirkungen kam.
Mittel zur Erhöhung des Serumkaliums
VASOTEC dämpft den durch Diuretika vom Thiazidtyp verursachten Kaliumverlust. Kaliumsparende Diuretika (z. B. Spironolacton, Triamteren oder Amilorid), Kaliumpräparate oder kaliumhaltige Salzersatzstoffe können zu einem signifikanten Anstieg des Serumkaliums führen. Wenn die gleichzeitige Anwendung dieser Arzneimittel aufgrund einer nachgewiesenen Hypokaliämie indiziert ist, sollten sie daher mit Vorsicht und unter häufiger Überwachung des Serumkaliums angewendet werden. Kaliumsparende Arzneimittel sollten bei Patienten mit Herzinsuffizienz, die VASOTEC erhalten, im Allgemeinen nicht angewendet werden.
Lithium
Lithiumtoxizität wurde bei Patienten berichtet, die Lithium gleichzeitig mit Arzneimitteln erhielten, die eine Elimination von Natrium verursachen, einschließlich ACE-Hemmern. Bei Patienten, die gleichzeitig VASOTEC und Lithium erhielten, wurden einige Fälle von Lithiumtoxizität berichtet, die nach Absetzen beider Arzneimittel reversibel waren. Es wird empfohlen, die Lithiumspiegel im Serum häufig zu kontrollieren, wenn Enalapril gleichzeitig mit Lithium verabreicht wird.
Gold
Nitritoidreaktionen (Symptome umfassen Gesichtsrötung, Übelkeit, Erbrechen und Hypotonie) wurden selten bei Patienten unter Therapie mit injizierbarem Gold (Natriumaurothiomalat) und gleichzeitiger Therapie mit ACE-Hemmern, einschließlich VASOTEC, berichtet.
mTOR (Mammalian Target Of Rapamycin)-Inhibitoren
Bei Patienten, die eine gleichzeitige Therapie mit ACE-Hemmern und mTOR-Hemmern (z. B. Temsirolimus, Sirolimus, Everolimus) erhalten, besteht möglicherweise ein erhöhtes Risiko für ein Angioödem (siehe WARNUNGEN ).
WARNUNGEN
Anaphylaktoide und möglicherweise verwandte Reaktionen
Vermutlich weil Angiotensin-Converting-Enzyme-Hemmer den Metabolismus von Eicosanoiden und Polypeptiden, einschließlich endogenem Bradykinin, beeinflussen, können bei Patienten, die ACE-Hemmer (einschließlich VASOTEC) erhalten, verschiedene Nebenwirkungen auftreten, von denen einige schwerwiegend sind.
Kopf-Hals-Angioödem
Bei Patienten, die mit Angiotensin-Converting-Enzym-Hemmern, einschließlich VASOTEC, behandelt wurden, wurde über Angioödeme des Gesichts, der Extremitäten, der Lippen, der Zunge, der Stimmritze und/oder des Kehlkopfes berichtet. Dies kann jederzeit während der Behandlung auftreten. In solchen Fällen sollte VASOTEC 2,5 mg sofort abgesetzt und eine geeignete Therapie und Überwachung durchgeführt werden, bis ein vollständiges und nachhaltiges Abklingen der Anzeichen und Symptome eingetreten ist. In Fällen, in denen die Schwellung auf das Gesicht und die Lippen beschränkt war, verschwand der Zustand im Allgemeinen ohne Behandlung, obwohl Antihistaminika zur Linderung der Symptome hilfreich waren. Angioödeme in Verbindung mit Larynxödemen können tödlich sein. Bei Beteiligung von Zunge, Glottis oder Kehlkopf, die wahrscheinlich zu einer Obstruktion der Atemwege führt, sollte umgehend eine geeignete Therapie, z bereitgestellt (sehen NEBENWIRKUNGEN ).
Bei Patienten, die gleichzeitig mit einem ACE-Hemmer und einem mTOR-Hemmer (mammalian target of rapamycin) (z. B. Temsirolimus, Sirolimus, Everolimus) oder einem Neprilysin-Hemmer behandelt werden, besteht möglicherweise ein erhöhtes Risiko für ein Angioödem (siehe Abschnitt 4.4). VORSICHTSMASSNAHMEN ).
Darm-Angioödem
Bei Patienten, die mit ACE-Hemmern behandelt wurden, wurde über intestinales Angioödem berichtet. Diese Patienten zeigten Bauchschmerzen (mit oder ohne Übelkeit oder Erbrechen); in manchen Fällen gab es in der Vorgeschichte kein faziales Angioödem und die C-1-Esterasespiegel waren normal. Das Angioödem wurde durch Verfahren wie Bauch-CT oder Ultraschall oder bei einer Operation diagnostiziert, und die Symptome verschwanden nach dem Absetzen des ACE-Hemmers. Intestinale Angioödeme sollten in die Differentialdiagnose von Patienten mit ACE-Hemmern einbezogen werden, die sich mit Bauchschmerzen vorstellen.
Patienten mit Angioödem in der Anamnese, die nicht mit einer ACE-Hemmer-Therapie in Zusammenhang stehen, können während der Behandlung mit einem ACE-Hemmer ein erhöhtes Risiko für ein Angioödem haben (siehe auch INDIKATIONEN UND VERWENDUNG und KONTRAINDIKATIONEN ).
Anaphylaktoide Reaktionen während der Desensibilisierung
Zwei Patienten, die sich einer desensibilisierenden Behandlung mit Hymenopterengift unterzogen, während sie ACE-Hemmer erhielten, erlitten lebensbedrohliche anaphylaktoide Reaktionen. Bei denselben Patienten wurden diese Reaktionen vermieden, wenn ACE-Hemmer vorübergehend abgesetzt wurden, aber sie traten bei einer versehentlichen erneuten Provokation wieder auf.
Anaphylaktoide Reaktionen während der Membranexposition
Anaphylaktoide Reaktionen wurden bei Patienten berichtet, die mit High-Flux-Membranen dialysiert und gleichzeitig mit einem ACE-Hemmer behandelt wurden. Anaphylaktoide Reaktionen wurden auch bei Patienten berichtet, die sich einer Low-Density-Lipoprotein-Apherese mit Dextransulfat-Absorption unterzogen.
Hypotonie
Eine übermäßige Hypotonie ist bei Patienten mit unkompliziertem Bluthochdruck, die mit VASOTEC 5 mg allein behandelt werden, selten. Bei Patienten mit Herzinsuffizienz, die VASOTEC erhalten, kommt es häufig zu einer gewissen Blutdrucksenkung, insbesondere bei der ersten Dosis, aber ein Absetzen der Therapie bei anhaltender symptomatischer Hypotonie ist normalerweise nicht erforderlich, wenn die Dosierungsanleitung befolgt wird; Bei Therapiebeginn ist Vorsicht geboten (vgl DOSIERUNG UND ANWENDUNG ). Zu den Patienten mit einem Risiko für übermäßige Hypotonie, die manchmal mit Oligurie und/oder fortschreitender Azotämie und selten mit akutem Nierenversagen und/oder Tod einhergeht, gehören Patienten mit den folgenden Erkrankungen oder Merkmalen: Herzinsuffizienz, Hyponatriämie, hochdosierte diuretische Therapie, kürzlich intensiviert Diurese oder Erhöhung der diuretischen Dosis, Nierendialyse oder schwerer Volumen- und/oder Salzmangel jeglicher Ätiologie. Es kann ratsam sein, das Diuretikum abzusetzen (außer bei Patienten mit Herzinsuffizienz), die Dosis des Diuretikums zu reduzieren oder die Salzaufnahme vorsichtig zu erhöhen, bevor eine Therapie mit VASOTEC 10 mg bei Patienten mit einem Risiko für übermäßige Hypotonie begonnen wird, die solche Anpassungen tolerieren können (siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN und NEBENWIRKUNGEN ). Bei Patienten mit einem Risiko für übermäßige Hypotonie sollte die Therapie unter sehr engmaschiger ärztlicher Überwachung begonnen werden, und diese Patienten sollten in den ersten beiden Behandlungswochen und bei jeder Dosiserhöhung von Enalapril und/oder Diuretikum engmaschig überwacht werden. Ähnliche Überlegungen können für Patienten mit ischämischer Herzkrankheit oder zerebrovaskulärer Erkrankung gelten, bei denen ein übermäßiger Blutdruckabfall zu einem Myokardinfarkt oder einem Schlaganfall führen könnte.
Wenn eine übermäßige Hypotonie auftritt, sollte der Patient in Rückenlage gebracht werden und, falls erforderlich, eine intravenöse Infusion mit normaler Kochsalzlösung erhalten. Eine vorübergehende hypotensive Reaktion ist keine Kontraindikation für weitere Dosen von VASOTEC 2,5 mg, die normalerweise problemlos verabreicht werden können, sobald sich der Blutdruck stabilisiert hat. Wenn sich eine symptomatische Hypotonie entwickelt, kann eine Dosisreduktion oder ein Absetzen von VASOTEC oder einem begleitenden Diuretikum erforderlich sein.
Neutropenie/Agranulozytose
Ein weiterer Hemmer des Angiotensin-Converting-Enzyms, Captopril, verursacht nachweislich Agranulozytose und Knochenmarksdepression, selten bei unkomplizierten Patienten, aber häufiger bei Patienten mit eingeschränkter Nierenfunktion, insbesondere wenn sie auch eine Kollagenose haben. Die verfügbaren Daten aus klinischen Studien mit Enalapril reichen nicht aus, um zu zeigen, dass Enalapril keine Agranulozytose mit ähnlichen Häufigkeiten verursacht. Aus Markterfahrungen sind Fälle von Neutropenie oder Agranulozytose bekannt, bei denen ein kausaler Zusammenhang mit Enalapril nicht ausgeschlossen werden kann. Eine regelmäßige Überwachung der Leukozytenzahl bei Patienten mit Kollagenose und Nierenerkrankungen sollte in Erwägung gezogen werden.
Leberversagen
Selten wurden ACE-Hemmer mit einem Syndrom in Verbindung gebracht, das mit cholestatischer Gelbsucht beginnt und zu einer fulminanten hepatischen Nekrose und (manchmal) zum Tod fortschreitet. Der Mechanismus dieses Syndroms ist nicht verstanden. Patienten, die ACE-Hemmer erhalten und eine Gelbsucht oder deutliche Erhöhungen der Leberenzymwerte entwickeln, sollten den ACE-Hemmer absetzen und eine angemessene medizinische Nachsorge erhalten.
Fötale Toxizität
Die Einnahme von Arzneimitteln, die während des zweiten und dritten Trimenons der Schwangerschaft auf das Renin-Angiotensin-System wirken, verringert die fetale Nierenfunktion und erhöht die fötale und neonatale Morbidität und den Tod. Das resultierende Oligohydramnion kann mit fetaler Lungenhypoplasie und Skelettdeformationen einhergehen. Mögliche Nebenwirkungen bei Neugeborenen sind Schädelhypoplasie, Anurie, Hypotonie, Nierenversagen und Tod. Wenn eine Schwangerschaft festgestellt wird, setzen Sie VASOTEC 10 mg so schnell wie möglich ab. Diese unerwünschten Wirkungen sind normalerweise mit der Anwendung dieser Arzneimittel im zweiten und dritten Trimenon der Schwangerschaft verbunden. Die meisten epidemiologischen Studien, die fötale Anomalien nach Anwendung von Antihypertensiva im ersten Trimenon untersuchten, haben Arzneimittel, die das Renin-Angiotensin-System beeinflussen, nicht von anderen Antihypertonika unterschieden. Eine angemessene Behandlung der mütterlichen Hypertonie während der Schwangerschaft ist wichtig, um die Ergebnisse für Mutter und Fötus zu optimieren.
In dem ungewöhnlichen Fall, dass es für einen bestimmten Patienten keine geeignete Alternative zu einer Therapie mit Arzneimitteln gibt, die das Renin-Angiotensin-System beeinflussen, informieren Sie die Mutter über das potenzielle Risiko für den Fötus. Führen Sie serielle Ultraschalluntersuchungen durch, um die intraamniotische Umgebung zu beurteilen. Wenn Oligohydramnion beobachtet wird, ist VASOTEC abzusetzen, es sei denn, es wird als lebensrettend für die Mutter angesehen. Abhängig von der Schwangerschaftswoche kann ein fetaler Test angebracht sein. Patienten und Ärzte sollten sich jedoch darüber im Klaren sein, dass Oligohydramnion möglicherweise erst auftritt, nachdem der Fötus eine irreversible Verletzung erlitten hat. Beobachten Sie Säuglinge, die in der Vergangenheit VASOTEC in der Gebärmutter ausgesetzt waren, genau auf Hypotonie, Oligurie und Hyperkaliämie (siehe VORSICHTSMASSNAHMEN , Verwendung in der Pädiatrie ).
In Studien an trächtigen Ratten und Kaninchen wurden keine teratogenen Wirkungen von Enalapril beobachtet. Auf Basis der Körperoberfläche betrugen die verwendeten Dosen das 57- bzw. 12-fache der maximal empfohlenen Tagesdosis beim Menschen (MRHDD).
VORSICHTSMASSNAHMEN
Allgemein
Aortenstenose/hypertrophe Kardiomyopathie
Wie alle Vasodilatatoren sollte Enalapril bei Patienten mit Obstruktion im Ausflusstrakt des linken Ventrikels mit Vorsicht angewendet werden.
Beeinträchtigte Nierenfunktion
Als Folge der Hemmung des Renin-Angiotensin-Aldosteron-Systems sind bei empfindlichen Personen Veränderungen der Nierenfunktion zu erwarten. Bei Patienten mit schwerer Herzinsuffizienz, deren Nierenfunktion von der Aktivität des Renin-Angiotensin-Aldosteron-Systems abhängen kann, kann die Behandlung mit Angiotensin-Converting-Enzym-Hemmern, einschließlich VASOTEC, mit Oligurie und/oder fortschreitender Azotämie und selten mit akutem Nierenversagen einhergehen /oder Tod (vgl WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ).
In klinischen Studien bei Bluthochdruckpatienten mit einseitiger oder beidseitiger Nierenarterienstenose wurden bei 20 Prozent der Patienten Anstiege des Blutharnstoffstickstoffs und des Serumkreatinins beobachtet. Diese Anstiege waren nach Absetzen von Enalapril und/oder Diuretika fast immer reversibel. Bei solchen Patienten sollte die Nierenfunktion während der ersten Behandlungswochen überwacht werden.
Einige Patienten mit Bluthochdruck oder Herzinsuffizienz ohne offensichtliche vorbestehende Nierengefäßerkrankung haben einen Anstieg des Blutharnstoffs und des Serumkreatinins entwickelt, der gewöhnlich geringfügig und vorübergehend ist, insbesondere wenn VASOTEC gleichzeitig mit einem Diuretikum verabreicht wurde. Dies tritt eher bei Patienten mit vorbestehender Nierenfunktionsstörung auf. Eine Dosisreduktion und/oder das Absetzen des Diuretikums und/oder VASOTEC 5 mg kann erforderlich sein.
Die Beurteilung von Patienten mit Bluthochdruck oder Herzinsuffizienz sollte immer eine Beurteilung der Nierenfunktion umfassen (sehen DOSIERUNG UND ANWENDUNG ).
Hyperkaliämie
Erhöhtes Serumkalium (mehr als 5,7 mÄq/l) wurde in klinischen Studien bei etwa einem Prozent der Bluthochdruckpatienten beobachtet. In den meisten Fällen handelte es sich um isolierte Werte, die sich trotz fortgesetzter Therapie zurückbildeten. Hyperkaliämie war bei 0,28 Prozent der Bluthochdruckpatienten ein Grund für den Therapieabbruch. In klinischen Studien bei Herzinsuffizienz wurde bei 3,8 Prozent der Patienten eine Hyperkaliämie beobachtet, die jedoch kein Grund für einen Abbruch war.
Risikofaktoren für die Entwicklung einer Hyperkaliämie sind Niereninsuffizienz, Diabetes mellitus und die gleichzeitige Anwendung von kaliumsparenden Diuretika, Kaliumpräparaten und/oder kaliumhaltigen Salzersatzmitteln, die, wenn überhaupt, mit VASOTEC nur mit Vorsicht angewendet werden sollten (vgl WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ).
Husten
Vermutlich aufgrund der Hemmung des Abbaus von körpereigenem Bradykinin wurde bei allen ACE-Hemmern über anhaltenden unproduktiven Husten berichtet, der immer nach Absetzen der Therapie abklang. ACE-Hemmer-induzierter Husten sollte bei der Differentialdiagnose des Hustens in Betracht gezogen werden.
Chirurgie/Anästhesie
Bei Patienten, die sich einem größeren chirurgischen Eingriff unterziehen oder während einer Anästhesie mit Mitteln, die eine Hypotonie hervorrufen, kann Enalapril die Angiotensin-II-Bildung als Folge einer kompensatorischen Reninfreisetzung blockieren. Wenn Hypotonie auftritt und auf diesen Mechanismus zurückzuführen ist, kann sie durch Volumenexpansion korrigiert werden.
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Es gab keine Hinweise auf eine tumorerzeugende Wirkung, wenn Enalapril 106 Wochen lang männlichen und weiblichen Ratten in Dosen von bis zu 90 mg/kg/Tag oder 94 Wochen lang männlichen und weiblichen Mäusen in Dosen von bis zu 90 und 180 mg/kg/Tag verabreicht wurde. Tag bzw. Diese Dosen betragen das 26-fache (bei Ratten und weiblichen Mäusen) und das 13-fache (bei männlichen Mäusen) der maximal empfohlenen menschlichen Tagesdosis (MRHDD) im Vergleich zur Körperoberfläche.
Weder Enalaprilmaleat noch die aktive Disäure waren im mikrobiellen Mutagentest von Ames mit oder ohne metabolische Aktivierung mutagen. Enalapril war auch in den folgenden Genotoxizitätsstudien negativ: Rec-Assay, Rückmutationsassay mit E. coli, Schwesterchromatidaustausch mit kultivierten Säugetierzellen und Mikrokerntest mit Mäusen sowie in einer zytogenetischen In-vivo-Studie mit Mausknochenmark .
Es gab keine nachteiligen Auswirkungen auf die Fortpflanzungsfähigkeit von männlichen und weiblichen Ratten, die mit bis zu 90 mg/kg/Tag Enalapril behandelt wurden (26-fache MRHDD im Vergleich zur Körperoberfläche).
Schwangerschaft
Stillende Mutter
Enalapril und Enalaprilat wurden in der menschlichen Muttermilch nachgewiesen. Aufgrund der Möglichkeit schwerwiegender Nebenwirkungen von Enalapril bei gestillten Säuglingen sollte unter Berücksichtigung der Bedeutung des Arzneimittels für die Mutter eine Entscheidung getroffen werden, ob das Stillen beendet oder VASOTEC 2,5 mg abgesetzt werden soll.
Pädiatrische Verwendung
Neugeborene mit einer Vorgeschichte von In-utero-Exposition gegenüber VASOTEC
Wenn Oligurie oder Hypotonie auftritt, lenken Sie die Aufmerksamkeit auf die Unterstützung des Blutdrucks und der Nierendurchblutung. Austauschtransfusionen oder Dialyse können erforderlich sein, um eine Hypotonie umzukehren und/oder eine gestörte Nierenfunktion zu ersetzen. Enalapril, das die Plazenta passiert, wurde mit einigem klinischen Nutzen durch Peritonealdialyse aus dem neonatalen Kreislauf entfernt und kann theoretisch durch Austauschtransfusion entfernt werden, obwohl es keine Erfahrung mit dem letzteren Verfahren gibt.
Antihypertensive Wirkungen von VASOTEC wurden bei pädiatrischen Patienten mit Hypertonie im Alter von 1 Monat bis 16 Jahren nachgewiesen. Die Anwendung von VASOTEC 5 mg in diesen Altersgruppen wird durch Nachweise aus angemessenen und gut kontrollierten Studien zu VASOTEC 2,5 mg bei pädiatrischen und erwachsenen Patienten sowie durch veröffentlichte Literatur bei pädiatrischen Patienten gestützt (siehe KLINISCHE PHARMAKOLOGIE , Klinische Pharmakologie bei pädiatrischen Patienten und DOSIERUNG UND ANWENDUNG ).
VASOTEC wird bei Neugeborenen und pädiatrischen Patienten mit einer glomerulären Filtrationsrate
ÜBERDOSIS
Bezüglich einer Überdosierung beim Menschen liegen begrenzte Daten vor.
Orale Einzeldosen von Enalapril über 1.000 mg/kg und ≥ 1.775 mg/kg waren bei Mäusen bzw. Ratten mit Letalität verbunden.
Die wahrscheinlichste Manifestation einer Überdosierung wäre Hypotonie, für die die übliche Behandlung eine intravenöse Infusion normaler Kochsalzlösung wäre.
Enalaprilat kann durch Hämodialyse aus dem allgemeinen Kreislauf entfernt werden und wurde durch Peritonealdialyse aus dem Kreislauf von Neugeborenen entfernt (siehe WARNUNGEN , Anaphylaktoide Reaktionen während der Membranexposition ).
KONTRAINDIKATIONEN
VASOTEC 2,5 mg ist kontraindiziert bei Patienten, die auf dieses Produkt überempfindlich reagieren, und bei Patienten mit Angioödem in der Vorgeschichte im Zusammenhang mit einer früheren Behandlung mit einem Angiotensin-Converting-Enzym-Hemmer und bei Patienten mit hereditärem oder idiopathischem Angioödem.
Verabreichen Sie Aliskiren nicht zusammen mit VASOTEC bei Patienten mit Diabetes (siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ).
VASOTEC 10 mg ist in Kombination mit einem Neprilysin-Inhibitor (z. B. Sacubitril) kontraindiziert. Verabreichen Sie VASOTEC nicht innerhalb von 36 Stunden nach der Umstellung auf oder von Sacubitril/Valsartan, einem Neprilysin-Inhibitor (siehe WARNUNGEN ).
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Enalapril hemmt nach Hydrolyse zu Enalaprilat das Angiotensin-Converting-Enzym (ACE) bei Menschen und Tieren. ACE ist eine Peptidyldipeptidase, die die Umwandlung von Angiotensin I in die vasokonstriktorische Substanz Angiotensin II katalysiert. Angiotensin II stimuliert auch die Aldosteronsekretion durch die Nebennierenrinde. Die vorteilhaften Wirkungen von Enalapril bei Bluthochdruck und Herzinsuffizienz scheinen hauptsächlich aus der Unterdrückung des Renin-Angiotensin-Aldosteron-Systems zu resultieren. Die Hemmung von ACE führt zu einem verringerten Plasma-Angiotensin II, was zu einer verringerten vasopressorischen Aktivität und zu einer verringerten Aldosteronsekretion führt. Obwohl die letztere Abnahme gering ist, führt sie zu einem geringen Anstieg des Serumkaliums. Bei Bluthochdruckpatienten, die bis zu 48 Wochen lang mit VASOTEC allein behandelt wurden, wurden mittlere Anstiege des Serumkaliums um etwa 0,2 mEq/l beobachtet. Bei Patienten, die mit VASOTEC 5 mg plus einem Thiaziddiuretikum behandelt wurden, gab es im Wesentlichen keine Veränderung des Serumkaliums (siehe VORSICHTSMASSNAHMEN ). Die Beseitigung der negativen Rückkopplung von Angiotensin II auf die Reninsekretion führt zu einer erhöhten Plasma-Renin-Aktivität.
ACE ist identisch mit Kininase, einem Enzym, das Bradykinin abbaut. Ob erhöhte Konzentrationen von Bradykinin, einem potenten Vasodepressor-Peptid, bei der therapeutischen Wirkung von VASOTEC eine Rolle spielen, muss noch geklärt werden.
Während angenommen wird, dass der Mechanismus, durch den VASOTEC 5 mg den Blutdruck senkt, in erster Linie die Unterdrückung des Renin-Angiotensin-Aldosteron-Systems ist, wirkt VASOTEC 10 mg selbst bei Patienten mit niedrigem Renin-Hypertonie blutdrucksenkend. Obwohl VASOTEC bei allen untersuchten Rassen blutdrucksenkend wirkte, sprachen schwarze Bluthochdruckpatienten (normalerweise eine hypertensive Population mit niedrigem Reninspiegel) im Durchschnitt weniger auf die Enalapril-Monotherapie an als nicht schwarze Patienten.
Pharmakokinetik und Stoffwechsel
Nach oraler Gabe von VASOTEC treten innerhalb von etwa einer Stunde maximale Serumkonzentrationen von Enalapril auf. Basierend auf der Wiederfindung im Urin beträgt das Ausmaß der Resorption von Enalapril ungefähr 60 Prozent. Die Resorption von Enalapril wird durch die Anwesenheit von Nahrung im Magen-Darm-Trakt nicht beeinflusst. Nach der Resorption wird Enalapril zu Enalaprilat hydrolysiert, das ein wirksamerer Hemmer des Angiotensin-Converting-Enzyms ist als Enalapril; Enalaprilat wird bei oraler Verabreichung schlecht resorbiert. Maximale Serumkonzentrationen von Enalaprilat treten drei bis vier Stunden nach einer oralen Dosis von Enalaprilmaleat auf. Die Ausscheidung von VASOTEC erfolgt hauptsächlich renal. Ungefähr 94 Prozent der Dosis werden als Enalaprilat oder Enalapril im Urin und im Stuhl wiedergefunden. Die Hauptbestandteile im Urin sind Enalaprilat, das etwa 40 Prozent der Dosis ausmacht, und intaktes Enalapril. Es gibt keine Hinweise auf Metaboliten von Enalapril außer Enalaprilat.
Das Serumkonzentrationsprofil von Enalaprilat weist eine verlängerte Endphase auf, die offenbar einen kleinen Bruchteil der verabreichten Dosis darstellt, der an ACE gebunden wurde. Die gebundene Menge nimmt mit der Dosis nicht zu, was auf eine sättigbare Bindungsstelle hinweist. Die effektive Halbwertszeit für die Akkumulation von Enalaprilat nach Mehrfachgabe von Enalaprilmaleat beträgt 11 Stunden. Die Verteilung von Enalapril und Enalaprilat bei Patienten mit Niereninsuffizienz ist ähnlich wie bei Patienten mit normaler Nierenfunktion, bis die glomeruläre Filtrationsrate 30 ml/min oder weniger beträgt. Bei einer glomerulären Filtrationsrate von ≤ 30 ml/min steigen die Spitzen- und Talspiegel von Enalaprilat, die Zeit bis zum Erreichen der maximalen Konzentration steigt und die Zeit bis zum Steady State kann verzögert sein. Die effektive Halbwertszeit von Enalaprilat nach mehrfacher Gabe von Enalaprilmaleat ist bei dieser Niereninsuffizienz verlängert (vgl DOSIERUNG UND ANWENDUNG ). Enalaprilat ist mit einer Geschwindigkeit von 62 ml/min dialysierbar.
Studien an Hunden weisen darauf hin, dass Enalapril die Blut-Hirn-Schranke, wenn überhaupt, nur schlecht passiert; Enalaprilat dringt nicht in das Gehirn ein. Mehrfachdosen von Enalaprilmaleat bei Ratten führten nicht zu einer Akkumulation in irgendeinem Gewebe. Milch säugender Ratten enthält nach Verabreichung von 14C-Enalaprilmaleat Radioaktivität. Es wurde festgestellt, dass Radioaktivität die Plazenta passiert, nachdem das markierte Medikament an trächtige Hamster verabreicht wurde.
Pharmakodynamik und klinische Wirkungen
Hypertonie
Die Verabreichung von VASOTEC an Patienten mit leichtem bis schwerem Bluthochdruck führt zu einer Senkung des Blutdrucks sowohl im Liegen als auch im Stehen, in der Regel ohne orthostatische Komponente. Eine symptomatische orthostatische Hypotonie ist daher selten, obwohl sie bei Patienten mit Volumenmangel zu erwarten ist (siehe WARNUNGEN ).
Bei den meisten untersuchten Patienten wurde nach oraler Gabe einer Einzeldosis Enalapril der Beginn der blutdrucksenkenden Wirkung nach einer Stunde beobachtet, wobei die maximale Blutdrucksenkung nach vier bis sechs Stunden erreicht wurde.
Bei empfohlener Dosierung hält die antihypertensive Wirkung für mindestens 24 Stunden an. Bei manchen Patienten kann die Wirkung gegen Ende des Dosierungsintervalls nachlassen (vgl DOSIERUNG UND ANWENDUNG ).
Bei manchen Patienten kann das Erreichen einer optimalen Blutdrucksenkung eine mehrwöchige Therapie erfordern.
Die blutdrucksenkende Wirkung von VASOTEC hielt während der Langzeittherapie an. Ein abruptes Absetzen von VASOTEC 10 mg wurde nicht mit einem raschen Anstieg des Blutdrucks in Verbindung gebracht.
In hämodynamischen Studien bei Patienten mit essentieller Hypertonie war die Blutdrucksenkung von einer Verringerung des peripheren arteriellen Widerstands mit einem Anstieg des Herzzeitvolumens und geringer oder keiner Änderung der Herzfrequenz begleitet. Nach der Verabreichung von VASOTEC kommt es zu einem Anstieg der Nierendurchblutung; Die glomeruläre Filtrationsrate ist normalerweise unverändert. Die Wirkungen scheinen bei Patienten mit renovaskulärer Hypertonie ähnlich zu sein.
Bei gleichzeitiger Gabe mit Diuretika vom Thiazidtyp addieren sich die blutdrucksenkenden Wirkungen von VASOTEC 5 mg annähernd.
In einer klinisch-pharmakologischen Studie wurde Indomethacin oder Sulindac Patienten mit Bluthochdruck verabreicht, die VASOTEC erhielten. In dieser Studie gab es keinen Hinweis auf eine Abschwächung der blutdrucksenkenden Wirkung von VASOTEC (vgl WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ).
Herzfehler
In Studien mit Patienten, die mit Digitalis und Diuretika behandelt wurden, führte die Behandlung mit Enalapril zu einer Verringerung des systemischen Gefäßwiderstands, des Blutdrucks, des pulmonalen Kapillarkeildrucks und der Herzgröße sowie zu einer Erhöhung des Herzzeitvolumens und der Belastungstoleranz. Die Herzfrequenz war unverändert oder leicht reduziert, und die mittlere Ejektionsfraktion war unverändert oder erhöht. Es gab eine positive Wirkung auf den Schweregrad der Herzinsuffizienz, gemessen nach der Klassifikation der New York Heart Association (NYHA), sowie auf die Symptome von Dyspnoe und Müdigkeit. Hämodynamische Wirkungen wurden nach der ersten Dosis beobachtet und schienen in unkontrollierten Studien, die bis zu vier Monate dauerten, anzuhalten. In placebokontrollierten Studien, die acht Wochen bis über ein Jahr dauerten, wurden Auswirkungen auf die Belastbarkeit, die Herzgröße sowie den Schweregrad und die Symptome von Herzinsuffizienz beobachtet.
Herzinsuffizienz, Sterblichkeitsstudien
In einer multizentrischen, placebokontrollierten klinischen Studie wurden 2.569 Patienten mit allen Graden der symptomatischen Herzinsuffizienz und einer Ejektionsfraktion ≤ 35 Prozent randomisiert entweder Placebo oder Enalapril zugeteilt und bis zu 55 Monate nachbeobachtet (SOLVD-Behandlung). Die Anwendung von Enalapril war mit einer 11-prozentigen Verringerung der Gesamtmortalität und einer 30-prozentigen Verringerung der Krankenhauseinweisungen wegen Herzinsuffizienz verbunden. Zu den Krankheiten, die Patienten von der Aufnahme in die Studie ausschlossen, gehörten schwere stabile Angina pectoris (> 2 Attacken/Tag), hämodynamisch signifikante Obstruktion der Herzklappen oder des Ausflusstrakts, Nierenversagen (Kreatinin > 2,5 mg/dl), zerebrovaskuläre Erkrankung (z. B. signifikante Erkrankung der Halsschlagader). , fortgeschrittene Lungenerkrankung, bösartige Erkrankungen, aktive Myokarditis und konstriktive Perikarditis. Der mit Enalapril verbundene Mortalitätsvorteil scheint nicht vom Vorhandensein von Digitalis abzuhängen.
Eine zweite multizentrische Studie verwendete das SOLVD-Protokoll zur Untersuchung asymptomatischer oder minimal symptomatischer Patienten. SOLVD-Präventionspatienten mit einer linksventrikulären Ejektionsfraktion von ≤ 35 % und ohne symptomatische Herzinsuffizienz in der Vorgeschichte wurden randomisiert Placebo (n = 2.117) oder Enalapril (n = 2.111) zugeteilt und bis zu 5 Jahre nachbeobachtet. Die Mehrheit der Patienten in der SOLVD-Präventionsstudie hatte eine Vorgeschichte von ischämischer Herzkrankheit. Bei 80 Prozent der Patienten lag ein Myokardinfarkt in der Vorgeschichte vor, bei 34 Prozent eine aktuelle Angina pectoris und bei 37 Prozent eine Vorgeschichte von Bluthochdruck. In dieser Population wurde kein statistisch signifikanter Mortalitätseffekt nachgewiesen. Mit Enalapril behandelte Patienten hatten 32 % weniger erste Krankenhauseinweisungen wegen Herzinsuffizienz und 32 % weniger Gesamteinweisungen wegen Herzinsuffizienz. Im Vergleich zu Placebo entwickelten 32 Prozent weniger Patienten, die Enalapril erhielten, Symptome einer offenen Herzinsuffizienz. Auch Krankenhauseinweisungen aus kardiovaskulären Gründen wurden reduziert. In der Enalapril-Behandlungsgruppe gab es eine unbedeutende Verringerung der Krankenhauseinweisungen aus beliebigen Gründen (für Enalapril vs. Placebo jeweils 1166 vs. 1201 erste Krankenhauseinweisungen, 2649 vs. 2840 Gesamteinweisungen), obwohl die Studie nicht darauf ausgelegt war, nach einer solchen zu suchen Wirkung.
Die SOLVD-Präventionsstudie war nicht darauf ausgelegt, festzustellen, ob die Behandlung von asymptomatischen Patienten mit niedriger Ejektionsfraktion in Bezug auf die Verhinderung eines Krankenhausaufenthalts einer engeren Nachsorge und der Anwendung von Enalapril bei den frühesten Anzeichen einer Herzinsuffizienz überlegen wäre. Unter den Bedingungen der Nachbeobachtung in der SOLVD-Präventionsstudie (alle 4 Monate in der Studienklinik; bei Bedarf persönlicher Arzt) hatten jedoch 68 % der Patienten unter Placebo, die wegen Herzinsuffizienz ins Krankenhaus eingeliefert wurden, keine zuvor aufgezeichneten Symptome, die hätten Signalisierter Behandlungsbeginn.
Die SOLVD-Präventionsstudie war auch nicht darauf ausgelegt zu zeigen, ob Enalapril das Fortschreiten der zugrunde liegenden Herzerkrankung verändert.
In einer anderen multizentrischen, placebokontrollierten Studie (CONSENSUS), die auf Patienten mit dekompensierter Herzinsuffizienz der NYHA-Klasse IV und röntgenologischem Nachweis einer Kardiomegalie beschränkt war, war die Anwendung von Enalapril mit einem verbesserten Überleben verbunden. Die Ergebnisse sind in der folgenden Tabelle gezeigt.
Sowohl in den CONSENSUS- als auch in den SOLVD-Behandlungsstudien erhielten die Patienten in der Regel auch Digitalis, Diuretika oder beides.
Klinische Pharmakologie bei pädiatrischen Patienten
Bei 40 männlichen und weiblichen pädiatrischen Patienten mit Hypertonie im Alter von 2 Monaten bis ≤ 16 Jahren wurde nach täglicher oraler Verabreichung von 0,07 bis 0,14 mg/kg Enalaprilmaleat eine pharmakokinetische Studie mit Mehrfachdosis durchgeführt. Im Steady State betrug die mittlere effektive Halbwertszeit für die Akkumulation von Enalaprilat 14 Stunden, und die mittlere Wiederfindung von Enalapril und Enalaprilat im Urin innerhalb von 24 Stunden betrug 68 % der verabreichten Dosis. Die Umwandlung von Enalapril zu Enalaprilat lag im Bereich von 63–76 %. Die Gesamtergebnisse dieser Studie weisen darauf hin, dass die Pharmakokinetik von Enalapril bei hypertensiven Kindern im Alter von 2 Monaten bis ≤ 16 Jahren in allen untersuchten Altersgruppen konsistent ist und mit pharmakokinetischen Daten aus der Vergangenheit bei gesunden Erwachsenen übereinstimmt.
In einer klinischen Studie mit 110 hypertensiven pädiatrischen Patienten im Alter von 6 bis 16 Jahren erhielten Patienten mit einem Körpergewicht
In den oben genannten pädiatrischen Studien wurde Enalaprilmaleat als VASOTEC-Tabletten gegeben, und bei Kindern und Säuglingen, die keine Tabletten schlucken konnten oder die eine niedrigere Dosis benötigten, als in Tablettenform erhältlich ist, wurde Enalapril als Suspensionsformulierung verabreicht (siehe DOSIERUNG UND ANWENDUNG , Vorbereitung der Suspension ).
INFORMATIONEN ZUM PATIENTEN
Angioödem
Angioödeme, einschließlich Larynxödeme, können jederzeit während der Behandlung mit Angiotensin-Converting-Enzym-Hemmern, einschließlich Enalapril, auftreten. Die Patienten sollten darauf hingewiesen und aufgefordert werden, sofort alle Anzeichen oder Symptome zu melden, die auf ein Angioödem hindeuten (Schwellung von Gesicht, Extremitäten, Augen, Lippen, Zunge, Schluck- oder Atembeschwerden) und kein Medikament mehr einnehmen, bis sie den verschreibenden Arzt konsultiert haben.
Hypotonie
Die Patienten sollten davor gewarnt werden, Benommenheit zu melden, insbesondere in den ersten Tagen der Therapie. Wenn tatsächlich eine Synkope auftritt, sollten die Patienten angewiesen werden, das Medikament abzusetzen, bis sie den verschreibenden Arzt konsultiert haben. Alle Patienten sollten darauf hingewiesen werden, dass übermäßiges Schwitzen und Austrocknung aufgrund der Verringerung des Flüssigkeitsvolumens zu einem übermäßigen Abfall des Blutdrucks führen können. Auch andere Ursachen für einen Volumenmangel wie Erbrechen oder Durchfall können zu einem Abfall des Blutdrucks führen; Patienten sollte geraten werden, den Arzt zu konsultieren.
Hyperkaliämie
Die Patienten sollten darauf hingewiesen werden, keine kaliumhaltigen Salzersatzstoffe ohne Rücksprache mit ihrem Arzt zu verwenden.
Neutropenie
Die Patienten sollten angewiesen werden, unverzüglich alle Anzeichen einer Infektion (z. B. Halsschmerzen, Fieber), die ein Zeichen einer Neutropenie sein können, zu melden.
Schwangerschaft
Patientinnen im gebärfähigen Alter sollten über die Folgen einer Exposition gegenüber VASOTEC während der Schwangerschaft aufgeklärt werden. Besprechen Sie Behandlungsmöglichkeiten mit Frauen, die eine Schwangerschaft planen. Patientinnen sollten aufgefordert werden, Schwangerschaften so schnell wie möglich ihrem Arzt zu melden.
HINWEIS: Wie bei vielen anderen Arzneimitteln sind bestimmte Ratschläge für Patienten, die mit Enalapril behandelt werden, gerechtfertigt. Diese Informationen sollen bei der sicheren und wirksamen Anwendung dieses Medikaments helfen. Es handelt sich nicht um eine Offenlegung aller möglichen nachteiligen oder beabsichtigten Wirkungen.