Prinivil 2.5mg, 5mg, 10mg Lisinopril Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Prinivil 2,5 mg und wie wird es angewendet?
Prinivil ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Bluthochdruck (Hypertonie) nach einem Herzinfarkt oder einer Herzinsuffizienz. Prinivil kann allein oder mit anderen Medikamenten verwendet werden.
Welche Nebenwirkungen kann Prinivil haben?
Prinivil kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Prinivil 5mg gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Prinivil. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
WARNUNG
Fötale Toxizität
BEZEICHNUNG
PRINIVIL enthält Lisinopril, ein synthetisches Peptidderivat, und einen oralen, langwirksamen Hemmer des Angiotensin-Converting-Enzyms. Lisinopril wird chemisch als (S)-1-[N2-(1-Carboxy-3-phenylpropyl)-Llysyl]-L-Prolin-Dihydrat beschrieben. Seine Summenformel ist C21H31N3O5•2H2O und seine Strukturformel ist:
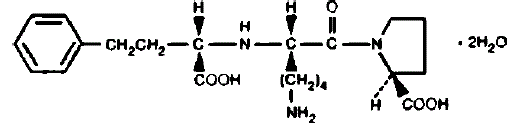
Lisinopril ist ein weißes bis cremefarbenes, kristallines Pulver mit einem Molekulargewicht von 441,52. Es ist wasserlöslich und in Methanol schwerlöslich und in Ethanol praktisch unlöslich.
PRINIVIL 10 mg wird als 5-mg-, 10-mg- und 20-mg-Tabletten zur oralen Verabreichung geliefert. Zusätzlich zum Wirkstoff Lisinopril enthält jede Tablette die folgenden Hilfsstoffe: Calciumphosphat, Mannit, Magnesiumstearat und Stärke. Die 10-mg- und 20-mg-Tabletten enthalten außerdem Eisenoxid.
INDIKATIONEN
Hypertonie
PRINIVIL ist angezeigt zur Behandlung von Bluthochdruck bei erwachsenen Patienten und pädiatrischen Patienten ab 6 Jahren, um den Blutdruck zu senken. Die Senkung des Blutdrucks senkt das Risiko tödlicher und nicht tödlicher kardiovaskulärer Ereignisse, vor allem Schlaganfälle und Myokardinfarkte. Diese Vorteile wurden in kontrollierten Studien mit blutdrucksenkenden Arzneimitteln aus einer Vielzahl von pharmakologischen Klassen beobachtet.
Die Kontrolle des Bluthochdrucks sollte Teil eines umfassenden kardiovaskulären Risikomanagements sein, einschließlich, soweit angemessen, Lipidkontrolle, Diabetesmanagement, antithrombotische Therapie, Raucherentwöhnung, Bewegung und begrenzte Natriumaufnahme. Viele Patienten benötigen mehr als 1 Medikament, um die Blutdruckziele zu erreichen. Spezifische Ratschläge zu Zielen und Management finden Sie in den veröffentlichten Richtlinien, wie denen des Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure (JNC) des National High Blood Pressure Education Program.
In randomisierten kontrollierten Studien wurde gezeigt, dass zahlreiche Antihypertensiva aus einer Vielzahl von pharmakologischen Klassen und mit unterschiedlichen Wirkmechanismen die kardiovaskuläre Morbidität und Mortalität verringern, und es kann geschlussfolgert werden, dass es sich um eine Blutdrucksenkung und nicht um eine andere pharmakologische Eigenschaft handelt die Medikamente, die größtenteils für diese Vorteile verantwortlich sind. Der größte und beständigste Nutzen für das kardiovaskuläre Ergebnis war eine Verringerung des Schlaganfallrisikos, aber auch eine Verringerung des Myokardinfarkts und der kardiovaskulären Mortalität wurde regelmäßig beobachtet.
Ein erhöhter systolischer oder diastolischer Druck verursacht ein erhöhtes kardiovaskuläres Risiko, und der absolute Risikoanstieg pro mmHg ist bei höheren Blutdrucken größer, so dass selbst eine geringfügige Verringerung einer schweren Hypertonie einen erheblichen Nutzen bringen kann. Die Reduktion des relativen Risikos durch Blutdrucksenkung ist in Populationen mit unterschiedlichem absolutem Risiko ähnlich, sodass der absolute Nutzen bei Patienten größer ist, die unabhängig von ihrer Hypertonie einem höheren Risiko ausgesetzt sind (z. B. Patienten mit Diabetes oder Hyperlipidämie), und solche Patienten wären zu erwarten um von einer aggressiveren Behandlung zu einem niedrigeren Blutdruckziel zu profitieren.
Einige Antihypertensiva haben geringere Blutdruckwirkungen (als Monotherapie) bei Patienten mit schwarzer Hautfarbe, und viele Antihypertensiva haben zusätzliche zugelassene Indikationen und Wirkungen (z. B. bei Angina pectoris, Herzinsuffizienz oder diabetischer Nierenerkrankung). Diese Überlegungen können die Auswahl der Therapie leiten.
PRINIVIL kann allein oder zusammen mit anderen blutdrucksenkenden Mitteln verabreicht werden [siehe Klinische Studien ].
Herzfehler
PRINIVIL ist indiziert zur Linderung von Anzeichen und Symptomen einer Herzinsuffizienz bei Patienten, die nicht ausreichend auf Diuretika und Digitalis ansprechen [siehe Klinische Studien ].
Akuter Myokardinfarkt
PRINIVIL ist indiziert zur Senkung der Sterblichkeit bei der Behandlung von hämodynamisch stabilen Patienten innerhalb von 24 Stunden nach einem akuten Myokardinfarkt. Die Patienten sollten gegebenenfalls die empfohlenen Standardbehandlungen wie Thrombolytika, Aspirin und Betablocker erhalten [siehe Klinische Studien ].
DOSIERUNG UND ANWENDUNG
Hypertonie
Anfangstherapie bei Erwachsenen: Die empfohlene Anfangsdosis beträgt 10 mg einmal täglich. Passen Sie die Dosierung entsprechend der Blutdruckreaktion an. Der übliche Dosierungsbereich beträgt 20 bis 40 mg pro Tag, verabreicht in einer einzelnen Tagesdosis. Dosen bis zu 80 mg wurden verwendet, scheinen jedoch keine größere Wirkung zu erzielen.
Verwendung mit Diuretika bei Erwachsenen
Wenn der Blutdruck mit PRINIVIL 10 mg allein nicht kontrolliert werden kann, kann eine niedrige Dosis eines Diuretikums hinzugefügt werden (z. B. Hydrochlorothiazid 12,5 mg).
Die empfohlene Anfangsdosis bei erwachsenen Patienten mit Bluthochdruck, die Diuretika einnehmen, beträgt 5 mg einmal täglich [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Pädiatrische Patienten ab 6 Jahren mit Bluthochdruck
Für pädiatrische Patienten mit einer glomerulären Filtrationsrate >30 ml/min/1,73 m² beträgt die empfohlene Anfangsdosis 0,07 mg/kg einmal täglich (bis zu 5 mg insgesamt). Die Dosierung sollte je nach Blutdruckreaktion bis zu einem Maximum von 0,61 mg/kg (bis zu 40 mg) einmal täglich angepasst werden. Dosen über 0,61 mg/kg (oder über 40 mg) wurden bei pädiatrischen Patienten nicht untersucht [siehe KLINISCHE PHARMAKOLOGIE ].
PRINIVIL 2,5 mg wird bei pädiatrischen Patienten Verwendung in bestimmten Bevölkerungsgruppen und Klinische Studien ].
Herzfehler
Die empfohlene Anfangsdosis für PRINIVIL 2,5 mg bei Anwendung mit Diuretika und (normalerweise) Digitalis als Begleittherapie beträgt 5 mg einmal täglich. Die empfohlene Anfangsdosis bei diesen Patienten mit Hyponatriämie (Serum-Natrium
Die Diuretikadosis muss möglicherweise angepasst werden, um eine Hypovolämie zu minimieren, die zu Hypotonie beitragen kann [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ]. Das Auftreten einer Hypotonie nach der Anfangsdosis von PRINIVIL schließt eine anschließende sorgfältige Dosistitration mit dem Arzneimittel nach einer wirksamen Behandlung der Hypotonie nicht aus.
Akuter Myokardinfarkt
Bei hämodynamisch stabilen Patienten innerhalb von 24 Stunden nach Auftreten der Symptome eines akuten Myokardinfarkts 5 mg PRINIVIL oral verabreichen, gefolgt von 5 mg nach 24 Stunden, 10 mg nach 48 Stunden und dann 10 mg einmal täglich. Die Einnahme sollte mindestens 6 Wochen fortgesetzt werden.
Beginnen Sie die Therapie mit 2,5 mg bei Patienten mit einem niedrigen systolischen Blutdruck (100-120 mmHg) während der ersten 3 Tage nach dem Infarkt [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Wenn Hypotonie auftritt (systolischer Blutdruck ≤ 100 mmHg), sollten Dosen von 2,5 oder 5 mg in Betracht gezogen werden. Bei anhaltender Hypotonie (systolischer Blutdruck
Dosis bei Patienten mit eingeschränkter Nierenfunktion
Bei Patienten mit einer Kreatinin-Clearance > 30 ml/min ist keine Dosisanpassung von PRINIVIL 2,5 mg erforderlich. Reduzieren Sie bei Patienten mit einer Kreatinin-Clearance von 10-30 ml/min die Anfangsdosis von PRINIVIL auf die Hälfte der üblichen empfohlenen Dosis (dh Hypertonie 5 mg; Herzinsuffizienz oder akuter MI 2,5 mg). Bei Patienten unter Hämodialyse oder einer Kreatinin-Clearance Verwendung in bestimmten Bevölkerungsgruppen und KLINISCHE PHARMAKOLOGIE ].
Vorbereitung der Suspension
Zur Herstellung von 200 ml einer Suspension mit 1,0 mg/ml 10 ml gereinigtes Wasser USP in eine Flasche aus Polyethylenterephthalat (PET) mit zehn 20-mg-Tabletten PRINIVIL 5 mg geben und mindestens eine Minute lang schütteln. 30 ml Natriumcitrat- und Zitronensäure-Lösung zum Einnehmen oder Cytra-2-Verdünnungsmittel und 160 ml Ora-Sweet SF™ zum Konzentrat in der PET-Flasche geben und einige Sekunden lang vorsichtig schütteln, um die Inhaltsstoffe zu verteilen. Die Suspension sollte bei oder unter 25 °C (77 °F) gelagert werden und kann bis zu vier Wochen gelagert werden. Schütteln Sie die Suspension vor jedem Gebrauch.
WIE GELIEFERT
Darreichungsformen und Stärken
Tabletten PRINIVIL, 5 mg, sind weiße, ovale, komprimierte Tabletten mit dem Code MSD 19 auf einer Seite und einer Bruchkerbe auf der anderen Seite.
Tabletten PRINIVIL, 10 mg, sind hellgelbe, ovale, komprimierte Tabletten mit dem Code MSD 106 auf einer Seite und einer Bruchkerbe auf der anderen Seite.
Tabletten PRINIVIL, 20 mg, sind pfirsichfarbene, ovale komprimierte Tabletten mit Code MSD 207 auf einer Seite und Bruchkerbe auf der anderen Seite.
Lagerung und Handhabung
PRINIVIL 10 mg wird als ovale, komprimierte Tabletten mit Bruchkerbe auf einer Seite geliefert.
Lagerung
Bei kontrollierter Raumtemperatur von 15-30°C (59-86°F) lagern und vor Feuchtigkeit schützen.
In einem dichten Behälter abgeben, wenn die Produktverpackung unterteilt ist.
Vertrieb durch: Merck Sharp & Dohme Corp., eine Tochtergesellschaft von MERCK & CO., INC., Whitehouse Station, NJ 08889, USA. Überarbeitet: November 2021
NEBENWIRKUNGEN
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Hypertonie
Die folgenden Nebenwirkungen (Ereignisse 2 % häufiger unter PRINIVIL 5 mg als unter Placebo) wurden unter PRINIVIL 2,5 mg vs. Placebo beobachtet: Kopfschmerzen (5,7 % vs. 1,9 %), Schwindel (5,4 % vs. 1,9 %), Husten (3,5 % vs. 1,0 % ).
Herzfehler
In kontrollierten Studien bei Patienten mit Herzinsuffizienz wurde die Therapie bei 8,1 % der Patienten, die 12 Wochen lang mit PRINIVIL 10 mg behandelt wurden, abgebrochen, verglichen mit 7,7 % der Patienten, die 12 Wochen lang mit Placebo behandelt wurden.
Die folgenden Nebenwirkungen (Ereignisse 2 % häufiger unter PRINIVIL 2,5 mg als unter Placebo) wurden unter PRINIVIL vs. Placebo beobachtet: Hypotonie (4,4 % vs. 0,6 %), Brustschmerzen (3,4 % vs. 1,3 %).
In der ATLAS-Studie [vgl Klinische Studien ] bei Patienten mit Herzinsuffizienz waren die Behandlungsabbrüche aufgrund von Nebenwirkungen in den Gruppen mit niedriger und hoher Dosis ähnlich. Die folgenden Nebenwirkungen, hauptsächlich im Zusammenhang mit der ACE-Hemmung, wurden häufiger in der Hochdosisgruppe berichtet:
Akuter Myokardinfarkt
Patienten in der GISSI-3-Studie, die mit PRINIVIL 10 mg behandelt wurden, hatten eine höhere Inzidenz von Hypotonie (9,0 % gegenüber 3,7 %) und Nierenfunktionsstörungen (2,4 % gegenüber 1,1 %) im Vergleich zu Patienten, die PRINIVIL nicht einnahmen.
Andere klinische Nebenwirkungen, die bei 1 % oder mehr der mit PRINIVIL 2,5 mg in kontrollierten klinischen Studien behandelten Patienten mit Bluthochdruck oder Herzinsuffizienz auftraten und nicht in anderen Abschnitten der Kennzeichnung erscheinen, sind nachstehend aufgeführt:
Körper als Ganzes: Müdigkeit, Asthenie, orthostatische Effekte.
Verdauungs: Bauchspeicheldrüsenentzündung, Verstopfung, Blähungen, Mundtrockenheit, Durchfall.
Hämatologisch: Seltene Fälle von Knochenmarkdepression, hämolytischer Anämie, Leukopenie/Neutropenie und Thrombozytopenie.
Endokrin: Diabetes mellitus, unangemessene Sekretion des antidiuretischen Hormons.
Stoffwechsel: Gicht
Haut: Urtikaria, Alopezie, Lichtempfindlichkeit, Erythem, Flush, Diaphorese, kutanes Pseudolymphom, toxische epidermale Nekrolyse, Stevens-Johnson-Syndrom und Juckreiz.
Besondere Sinne: Sehverlust, Diplopie, verschwommenes Sehen, Tinnitus, Photophobie, Geschmacksstörungen, Geruchsstörungen.
Urogenital: Impotenz
Sonstig: Es wurde über einen Symptomkomplex berichtet, der eine positive ANA, eine erhöhte Erythrozytensedimentationsrate, Arthralgie/Arthritis, Myalgie, Fieber, Vaskulitis, Eosinophilie, Leukozytose, Parästhesien und Schwindel umfassen kann. Hautausschlag, Lichtempfindlichkeit oder andere dermatologische Manifestationen können allein oder in Kombination mit diesen Symptomen auftreten.
Klinische Labortestergebnisse
Serumkalium
In klinischen Studien trat bei 2,2 % bzw. 4,8 % der mit PRINIVIL behandelten Patienten mit Hypertonie und Herzinsuffizienz eine Hyperkaliämie (Serumkalium > 5,7 mEq/l) auf [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Kreatinin, Blut-Harnstoff-Stickstoff
Bei etwa 2 % der Patienten mit Hypertonie, die mit PRINIVIL 5 mg allein behandelt wurden, wurde ein geringfügiger Anstieg des Blut-Harnstoff-Stickstoffs und des Serum-Kreatinins beobachtet, der nach Absetzen der Therapie reversibel war. Anstiege waren häufiger bei Patienten, die gleichzeitig Diuretika erhielten, und bei Patienten mit Nierenarterienstenose [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Bei 11,6 % der Patienten mit Herzinsuffizienz unter gleichzeitiger diuretischer Therapie wurden reversible geringfügige Anstiege des Blut-Harnstoff-Stickstoffs und des Serum-Kreatinins beobachtet. Häufig verschwanden diese Anomalien, wenn die Dosierung des Diuretikums verringert wurde.
Patienten mit akutem Myokardinfarkt in der GISSI-3-Studie, die mit PRINIVIL behandelt wurden, hatten eine höhere (2,4 % gegenüber 1,1 % in Placebo) Inzidenz von Nierenfunktionsstörungen im Krankenhaus und nach 6 Wochen (Anstieg der Kreatininkonzentration auf über 3 mg/dl oder eine Verdopplung). oder mehr als die Ausgangsserum-Kreatininkonzentration).
Hämoglobin und Hämatokrit
Kleine Abnahmen von Hämoglobin (Mittelwert 0,4 mg/dl) und Hämatokritwert (Mittelwert 1,3 %) traten häufig bei mit PRINIVIL 5 mg behandelten Patienten auf, waren jedoch bei Patienten ohne andere Anämieursache selten von klinischer Bedeutung. In klinischen Studien brachen weniger als 0,1 % der Patienten die Therapie wegen Anämie ab.
Leberenzyme
Selten sind Erhöhungen der Leberenzyme und/oder des Serumbilirubins aufgetreten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung von Lisinopril nach der Zulassung festgestellt, die nicht in anderen Abschnitten der Kennzeichnung aufgeführt sind. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen. Andere Reaktionen sind:
Stoffwechsel- und Ernährungsstörungen
Hyponatriämie [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ], Fälle von Hypoglykämie bei Diabetikern unter oralen Antidiabetika oder Insulin [vgl WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ]
Nervensystem und psychiatrische Erkrankungen
Stimmungsschwankungen (einschließlich depressiver Symptome), geistige Verwirrtheit
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Diuretika
Der Beginn der Behandlung mit PRINIVIL bei Patienten unter Diuretika kann zu einer übermäßigen Senkung des Blutdrucks führen. Die Möglichkeit blutdrucksenkender Wirkungen von PRINIVIL kann minimiert werden, indem vor Beginn der Behandlung mit PRINIVIL entweder das Diuretikum verringert oder abgesetzt oder die Salzaufnahme erhöht wird. Wenn dies nicht möglich ist, reduzieren Sie die Anfangsdosis von PRINIVIL [siehe DOSIERUNG UND ANWENDUNG und WARNUNGEN UND VORSICHTSMASSNAHMEN ].
PRINIVIL 2,5 mg dämpft den Kaliumverlust, der durch Diuretika vom Thiazidtyp verursacht wird. Kaliumsparende Diuretika (Spironolacton, Amilorid, Triamteren und andere) oder andere Arzneimittel, die das Serumkalium erhöhen können, können das Risiko einer Hyperkaliämie erhöhen. Wenn die gleichzeitige Anwendung solcher Mittel indiziert ist, sollte daher das Serumkalium des Patienten häufig überwacht werden.
Antidiabetika
Die gleichzeitige Anwendung von PRINIVIL 10 mg und Antidiabetika (Insulin, orale Antidiabetika) kann eine verstärkte blutzuckersenkende Wirkung mit dem Risiko einer Hypoglykämie hervorrufen.
Nicht-steroidale Entzündungshemmer einschließlich selektiver Cyclooxygenase-2-Hemmer (COX-2-Hemmer)
Bei älteren Patienten, Patienten mit Volumenmangel (einschließlich Patienten unter Diuretikatherapie) oder mit eingeschränkter Nierenfunktion kann die gleichzeitige Anwendung von NSAIDs, einschließlich selektiver COX-2-Hemmer, mit ACE-Hemmern, einschließlich Lisinopril, zu einer Verschlechterung der Nierenfunktion führen, einschließlich möglicherweise akutes Nierenversagen. Diese Effekte sind normalerweise reversibel. Überwachen Sie regelmäßig die Nierenfunktion bei Patienten, die eine Therapie mit Lisinopril und NSAR erhalten.
Die blutdrucksenkende Wirkung von ACE-Hemmern, einschließlich Lisinopril, kann durch NSAR abgeschwächt werden.
Duale Blockade des Renin-Angiotensin-Systems (RAS)
Die duale Blockade des RAS mit Angiotensinrezeptorblockern, ACE-Hemmern oder direkten Reninhemmern (wie Aliskiren) ist im Vergleich zur Monotherapie mit einem erhöhten Risiko für Hypotonie, Synkope, Hyperkaliämie und Veränderungen der Nierenfunktion (einschließlich akutem Nierenversagen) verbunden.
In die Studie Veterans Affairs Nephropathy in Diabetes (VA NEPHRON-D) wurden 1448 Patienten mit Typ-2-Diabetes, erhöhtem Albumin-zu-Kreatinin-Verhältnis im Urin und verringerter geschätzter glomerulärer Filtrationsrate (GFR 30 bis 89,9 ml/min) aufgenommen und randomisiert Lisinopril oder Placebo vor dem Hintergrund einer Losartan-Therapie und folgten ihnen über einen Median von 2,2 Jahren. Patienten, die die Kombination von Losartan und Lisinopril erhielten, erzielten keinen zusätzlichen Nutzen im Vergleich zur Monotherapie für den kombinierten Endpunkt Abnahme der GFR, Nierenerkrankung im Endstadium oder Tod, aber sie zeigten eine erhöhte Inzidenz von Hyperkaliämie und akuter Nierenschädigung im Vergleich zur Monotherapiegruppe .
Vermeiden Sie im Allgemeinen die kombinierte Anwendung von RAS-Hemmern. Überwachen Sie den Blutdruck, die Nierenfunktion und die Elektrolyte bei Patienten, die PRINIVIL 5 mg und andere Arzneimittel einnehmen, die das RAS beeinflussen.
Bei Patienten mit Diabetes darf Aliskiren nicht zusammen mit PRINIVIL verabreicht werden. Vermeiden Sie die Anwendung von Aliskiren zusammen mit PRINIVIL 2,5 mg bei Patienten mit eingeschränkter Nierenfunktion (GFR
Lithium
Lithiumtoxizität wurde bei Patienten berichtet, die Lithium gleichzeitig mit Arzneimitteln erhielten, die eine Elimination von Natrium verursachen, einschließlich ACE-Hemmern. Die Lithiumtoxizität war in der Regel nach Absetzen von Lithium und dem ACE-Hemmer reversibel. Überwachen Sie den Lithiumspiegel im Serum während der gleichzeitigen Anwendung.
Gold
Nitritoidreaktionen (Symptome umfassen Gesichtsrötung, Übelkeit, Erbrechen und Hypotonie) wurden selten bei Patienten unter Therapie mit injizierbarem Gold (Natriumaurothiomalat) und gleichzeitiger Therapie mit ACE-Hemmern, einschließlich PRINIVIL, berichtet.
Säugetier-Target von Rapamycin (mTOR)-Inhibitoren
Bei Patienten, die gleichzeitig eine Therapie mit mTOR-Inhibitoren (z. B. Temsirolimus, Sirolimus, Everolimus) einnehmen, besteht möglicherweise ein erhöhtes Risiko für ein Angioödem [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Neprilysin-Inhibitoren
Bei Patienten, die gleichzeitig einen Neprilysin-Inhibitor (z. B. Sacubitril) einnehmen, besteht möglicherweise ein erhöhtes Risiko für ein Angioödem [siehe KONTRAINDIKATIONEN und WARNUNGEN UND VORSICHTSMASSNAHMEN ].
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Fötale Toxizität
PRINIVIL kann den Fötus schädigen, wenn es einer schwangeren Frau verabreicht wird. Die Einnahme von Arzneimitteln, die während des zweiten und dritten Trimenons der Schwangerschaft auf das Renin-Angiotensin-System wirken, verringert die fetale Nierenfunktion und erhöht die fötale und neonatale Morbidität und den Tod. Das resultierende Oligohydramnion kann mit fetaler Lungenhypoplasie und Skelettdeformationen einhergehen. Mögliche Nebenwirkungen bei Neugeborenen sind Schädelhypoplasie, Anurie, Hypotonie, Nierenversagen und Tod. Wenn eine Schwangerschaft festgestellt wird, setzen Sie PRINIVIL so bald wie möglich ab [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Angioödem und anaphylaktoide Reaktionen
Angioödem
Kopf-Hals-Angioödem
Bei Patienten, die mit Angiotensin-Converting-Enzym-Hemmern, einschließlich PRINIVIL, behandelt wurden, sind zu irgendeinem Zeitpunkt während der Behandlung Angioödeme des Gesichts, der Extremitäten, der Lippen, der Zunge, der Stimmritze und/oder des Kehlkopfes, einschließlich einiger tödlicher Reaktionen, aufgetreten. Bei Patienten mit Beteiligung der Zunge, Glottis oder des Kehlkopfes ist mit hoher Wahrscheinlichkeit eine Obstruktion der Atemwege zu beobachten, insbesondere bei Patienten mit Atemwegsoperationen in der Vorgeschichte. PRINIVIL 5 mg sollte unverzüglich abgesetzt und eine angemessene Therapie und Überwachung durchgeführt werden, bis die Anzeichen und Symptome eines Angioödems vollständig und nachhaltig zurückgegangen sind.
Patienten mit Angioödem in der Anamnese, die nicht mit einer ACE-Hemmer-Therapie in Zusammenhang stehen, können während der Behandlung mit einem ACE-Hemmer ein erhöhtes Risiko für ein Angioödem haben [siehe KONTRAINDIKATIONEN ]. ACE-Hemmer wurden mit einer höheren Rate von Angioödemen bei Patienten mit schwarzer Hautfarbe als bei nicht-schwarzen Patienten in Verbindung gebracht.
Bei Patienten, die gleichzeitig mit ACE-Hemmern und mTOR-Hemmern (mammalian target of rapamycin) (z. B. Temsirolimus, Sirolimus, Everolimus) behandelt werden, besteht möglicherweise ein erhöhtes Risiko für ein Angioödem [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Bei Patienten, die gleichzeitig eine Therapie mit ACE-Hemmern und Neprilysin-Hemmern erhalten, besteht möglicherweise ein erhöhtes Risiko für ein Angioödem [siehe KONTRAINDIKATIONEN und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Darm-Angioödem
Bei Patienten, die mit ACE-Hemmern behandelt wurden, ist ein intestinales Angioödem aufgetreten. Diese Patienten zeigten Bauchschmerzen (mit oder ohne Übelkeit oder Erbrechen); in manchen Fällen gab es in der Vorgeschichte kein faziales Angioödem und die C-1-Esterasespiegel waren normal. In einigen Fällen wurde das Angioödem durch Verfahren, einschließlich Abdominal-CT oder Ultraschall, oder bei einer Operation diagnostiziert, und die Symptome verschwanden nach dem Absetzen des ACE-Hemmers.
Anaphylaktoide Reaktionen
Anaphylaktoide Reaktionen während der Desensibilisierung
Zwei Patienten, die sich einer desensibilisierenden Behandlung mit Hymenopterengift unterzogen, während sie ACE-Hemmer erhielten, erlitten lebensbedrohliche anaphylaktoide Reaktionen.
Anaphylaktoide Reaktionen während der Dialyse
Plötzliche und potenziell lebensbedrohliche anaphylaktoide Reaktionen sind bei einigen Patienten aufgetreten, die mit High-Flux-Membranen dialysiert und gleichzeitig mit einem ACE-Hemmer behandelt wurden. Bei solchen Patienten muss die Dialyse sofort abgebrochen und eine aggressive Therapie gegen anaphylaktoide Reaktionen eingeleitet werden. Die Symptome wurden in diesen Situationen durch Antihistaminika nicht gelindert. Bei diesen Patienten sollte die Anwendung einer anderen Art von Dialysemembran oder einer anderen Klasse von Antihypertensiva in Betracht gezogen werden. Anaphylaktoide Reaktionen wurden auch bei Patienten berichtet, die sich einer Low-Density-Lipoprotein-Apherese mit Dextransulfat-Absorption unterzogen.
Beeinträchtigte Nierenfunktion
Überwachen Sie regelmäßig die Nierenfunktion bei Patienten, die mit PRINIVIL behandelt werden. Veränderungen der Nierenfunktion einschließlich akutem Nierenversagen können durch Arzneimittel verursacht werden, die das Renin-Angiotensin-System hemmen. Patienten, deren Nierenfunktion teilweise von der Aktivität des Renin-Angiotensin-Systems abhängt (z. B. Patienten mit Nierenarterienstenose, chronischer Nierenerkrankung, schwerer dekompensierter Herzinsuffizienz, Postmyokardinfarkt oder Volumenmangel), können besonders gefährdet sein, sich zu entwickeln akutes Nierenversagen auf PRINIVIL. Erwägen Sie das Aussetzen oder Absetzen der Therapie bei Patienten, die unter PRINIVIL eine klinisch signifikante Abnahme der Nierenfunktion entwickeln [siehe NEBENWIRKUNGEN und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Hypotonie
PRINIVIL kann eine symptomatische Hypotonie verursachen, die manchmal durch Oligurie, fortschreitende Azotämie, akutes Nierenversagen oder Tod kompliziert wird. Zu den Patienten mit dem Risiko einer übermäßigen Hypotonie gehören Patienten mit den folgenden Erkrankungen oder Merkmalen: Herzinsuffizienz mit systolischem Blutdruck unter 100 mmHg, ischämische Herzerkrankung, zerebrovaskuläre Erkrankung, Hyponatriämie, Hochdosis-Diuretikatherapie, Nierendialyse oder schwerer Volumen- und/oder Salzmangel jeglicher Ätiologie.
Beginnen Sie bei diesen Patienten mit PRINIVIL unter ärztlicher Aufsicht und folgen Sie diesen Patienten in den ersten beiden Behandlungswochen und immer dann, wenn die Dosis von PRINIVIL und/oder Diuretikum erhöht wird. Vermeiden Sie die Anwendung von PRINIVIL 2,5 mg bei Patienten, die nach einem akuten MI hämodynamisch instabil sind.
Eine symptomatische Hypotonie ist auch bei Patienten mit schwerer Aortenstenose oder hypertropher Kardiomyopathie möglich.
Chirurgie/Anästhesie
Bei Patienten, die sich einem größeren chirurgischen Eingriff unterziehen oder während einer Anästhesie mit Mitteln, die Hypotonie hervorrufen, kann PRINIVIL die Angiotensin-II-Bildung als Folge einer kompensatorischen Reninfreisetzung blockieren. Wenn Hypotonie auftritt und auf diesen Mechanismus zurückzuführen ist, kann sie durch Volumenexpansion korrigiert werden.
Hyperkaliämie
Kontrollieren Sie regelmäßig das Serumkalium bei Patienten, die PRINIVIL erhalten. Arzneimittel, die das Renin-Angiotensin-System hemmen, können eine Hyperkaliämie verursachen. Risikofaktoren für die Entwicklung einer Hyperkaliämie sind Niereninsuffizienz, Diabetes mellitus und die gleichzeitige Anwendung von kaliumsparenden Diuretika, Kaliumpräparaten, kaliumhaltigen Salzersatzmitteln oder anderen Arzneimitteln, die das Serumkalium erhöhen können [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Leberversagen
ACE-Hemmer wurden mit einem Syndrom in Verbindung gebracht, das mit cholestatischer Gelbsucht oder Hepatitis beginnt und zu einer fulminanten hepatischen Nekrose und manchmal zum Tod fortschreitet. Der Mechanismus dieses Syndroms ist nicht verstanden. Patienten, die ACE-Hemmer erhalten und Gelbsucht oder deutliche Erhöhungen der Leberenzymwerte entwickeln, sollten den ACE-Hemmer absetzen und eine angemessene medizinische Behandlung erhalten.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Es gab keine Hinweise auf eine tumorerzeugende Wirkung, wenn Lisinopril 105 Wochen lang männlichen und weiblichen Ratten in Dosen von bis zu 90 mg pro kg pro Tag oder 92 Wochen lang männlichen und weiblichen Mäusen in Dosen von bis zu 135 mg pro kg pro Tag verabreicht wurde. Diese Dosen betragen das 10-fache bzw. 7-fache der MRHDD im Vergleich zur Körperoberfläche.
Lisinopril war im mikrobiellen Mutagentest von Ames mit oder ohne metabolische Aktivierung nicht mutagen. Es war auch in einem Vorwärtsmutationstest unter Verwendung von Lungenzellen chinesischer Hamster negativ. Lisinopril führte in einem In-vitro-Hepatozytentest mit alkalischer Elution an Ratten nicht zu Einzelstrang-DNA-Brüchen. Darüber hinaus führte Lisinopril in einem In-vitro-Test an Eierstockzellen des chinesischen Hamsters oder in einer In-vivo-Studie im Knochenmark von Mäusen nicht zu einer Zunahme von Chromosomenaberrationen.
Bei männlichen und weiblichen Ratten, die mit bis zu 300 mg/kg/Tag Lisinopril behandelt wurden (das 33-fache der MRHDD im Vergleich zur Körperoberfläche), traten keine nachteiligen Auswirkungen auf die Fortpflanzungsfähigkeit auf.
Studien an Ratten weisen darauf hin, dass Lisinopril die Blut-Hirn-Schranke schlecht passiert. Mehrfachdosen von Lisinopril bei Ratten führten nicht zu einer Akkumulation in irgendeinem Gewebe. Milch säugender Ratten enthält nach Verabreichung von 14C-Lisinopril Radioaktivität. Durch Ganzkörper-Autoradiographie wurde Radioaktivität in der Plazenta nach Verabreichung des markierten Medikaments an trächtige Ratten gefunden, aber keine wurde in den Föten gefunden.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Zusammenfassung der Risiken
PRINIVIL kann den Fötus schädigen, wenn es einer schwangeren Frau verabreicht wird. Die Einnahme von Arzneimitteln, die während des zweiten und dritten Trimenons der Schwangerschaft auf das Renin-Angiotensin-System wirken, verringert die fetale Nierenfunktion und erhöht die fötale und neonatale Morbidität und den Tod. Die meisten epidemiologischen Studien, die fetale Anomalien nach Anwendung von Antihypertensiva im ersten Trimenon untersuchten, haben Arzneimittel, die das Renin-Angiotensin-System beeinflussen, nicht von anderen Antihypertonika unterschieden. Wenn eine Schwangerschaft festgestellt wird, setzen Sie PRINIVIL 5 mg so schnell wie möglich ab.
Das geschätzte Hintergrundrisiko schwerer Geburtsfehler und Fehlgeburten für die angegebene Population ist unbekannt. Alle Schwangerschaften haben ein Hintergrundrisiko für Geburtsfehler, Verlust oder andere nachteilige Folgen. In der US-Allgemeinbevölkerung liegt das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten bei klinisch anerkannten Schwangerschaften bei 2–4 % bzw. 15–20 %.
Klinische Überlegungen
Krankheitsbedingtes mütterliches und/oder embryonale/fetales Risiko
Bluthochdruck in der Schwangerschaft erhöht das mütterliche Risiko für Präeklampsie, Schwangerschaftsdiabetes, Frühgeburt und Geburtskomplikationen (z. B. Notwendigkeit eines Kaiserschnitts und postpartale Blutungen). Bluthochdruck erhöht das fötale Risiko für eine intrauterine Wachstumsbeschränkung und einen intrauterinen Tod. Schwangere Frauen mit Bluthochdruck sollten sorgfältig überwacht und entsprechend behandelt werden.
Fötale/neonatale Nebenwirkungen
Oligohydramnie bei Schwangeren, die im zweiten und dritten Trimenon Arzneimittel anwenden, die das Renin-Angiotensin-System beeinflussen, kann zu Folgendem führen: verminderte fetale Nierenfunktion, die zu Anurie und Nierenversagen führt, fetale Lungenhypoplasie und Skelettdeformationen, einschließlich Schädelhypoplasie, Hypotonie , und Tod. In dem ungewöhnlichen Fall, dass es für einen bestimmten Patienten keine geeignete alternative Therapie zu Arzneimitteln gibt, die das Renin-Angiotensin-System beeinflussen, informieren Sie die Mutter über das potenzielle Risiko für den Fötus.
Führen Sie bei Patientinnen, die PRINIVIL während der Schwangerschaft einnehmen, serielle Ultraschalluntersuchungen durch, um das intraamniotische Milieu zu beurteilen. Abhängig von der Schwangerschaftswoche kann ein fetaler Test angebracht sein. Wenn Oligohydramnion beobachtet wird, ist PRINIVIL 10 mg abzusetzen, es sei denn, es wird als lebensrettend für die Mutter angesehen. Patienten und Ärzte sollten sich jedoch darüber im Klaren sein, dass Oligohydramnion möglicherweise erst auftritt, nachdem der Fötus eine irreversible Verletzung erlitten hat.
Säuglinge, die PRINIVIL in der Gebärmutter ausgesetzt waren, sind engmaschig auf Hypotonie, Oligurie und Hyperkaliämie zu beobachten. Bei Neugeborenen mit einer Vorgeschichte von PRINIVIL in utero, wenn Oligurie oder Hypotonie auftritt, unterstützen Sie den Blutdruck und die Nierendurchblutung. Austauschtransfusionen oder Dialyse können erforderlich sein, um eine Hypotonie umzukehren und/oder eine gestörte Nierenfunktion zu ersetzen.
Stillzeit
Zusammenfassung der Risiken
Es liegen keine Daten zum Vorkommen von Lisinopril in der Muttermilch oder zu den Wirkungen von Lisinopril auf den gestillten Säugling oder auf die Milchproduktion vor. Lisinopril ist in Rattenmilch enthalten. Da viele Arzneimittel in die Muttermilch übergehen und aufgrund der Möglichkeit schwerwiegender Nebenwirkungen bei gestillten Säuglingen durch ACE-Hemmer, sollten Sie mit dem Stillen aufhören oder PRINIVIL absetzen.
Pädiatrische Verwendung
Die blutdrucksenkenden Wirkungen und die Sicherheit von PRINIVIL wurden bei pädiatrischen Patienten im Alter von 6 bis 16 Jahren nachgewiesen [siehe DOSIERUNG UND ANWENDUNG und Klinische Studien ]. Es wurden keine relevanten Unterschiede zwischen dem Nebenwirkungsprofil für pädiatrische Patienten und erwachsene Patienten festgestellt.
Die Sicherheit und Wirksamkeit von PRINIVIL wurde bei pädiatrischen Patienten unter 6 Jahren oder bei pädiatrischen Patienten mit einer glomerulären Filtrationsrate KLINISCHE PHARMAKOLOGIE und Klinische Studien ].
Geriatrische Verwendung
Bei älteren Patienten ist keine Dosisanpassung mit PRINIVIL 2,5 mg erforderlich. In einer klinischen Studie mit PRINIVIL 10 mg bei Patienten mit Myokardinfarkt (GISSI-3-Studie) waren 4.413 (47 %) 65 Jahre und älter, während 1.656 (18 %) 75 Jahre und älter waren. In dieser Studie brachen 4,8 % der Patienten ab 75 Jahren die Behandlung mit PRINIVIL 5 mg wegen einer Nierenfunktionsstörung ab, gegenüber 1,3 % der Patienten unter 75 Jahren. Es wurden keine weiteren Unterschiede in der Sicherheit oder Wirksamkeit zwischen älteren und jüngeren Patienten beobachtet, aber eine größere Empfindlichkeit einiger älterer Personen kann nicht ausgeschlossen werden.
Wettrennen
ACE-Hemmer, einschließlich PRINIVIL, haben bei Patienten mit schwarzer Hautfarbe eine geringere Wirkung auf den Blutdruck als bei Patienten mit nicht-schwarzer Hautfarbe.
Nierenfunktionsstörung
Eine Dosisanpassung von PRINIVIL ist bei Patienten erforderlich, die sich einer Hämodialyse unterziehen oder deren Kreatinin-Clearance ≤ 30 ml/min beträgt. Bei Patienten mit einer Kreatinin-Clearance > 30 ml/min ist keine Dosisanpassung von PRINIVIL 5 mg erforderlich [siehe DOSIERUNG UND ANWENDUNG und KLINISCHE PHARMAKOLOGIE ].
ÜBERDOSIS
Nach einer oralen Einzeldosis von 20 g/kg trat bei Ratten keine Letalität auf, und bei einer von 20 Mäusen, die die gleiche Dosis erhielten, trat der Tod auf. Die wahrscheinlichste Manifestation einer Überdosierung wäre Hypotonie, für die die übliche Behandlung eine intravenöse Infusion normaler Kochsalzlösung wäre.
Lisinopril kann durch Hämodialyse entfernt werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
KONTRAINDIKATIONEN
PRINIVIL 10 mg ist kontraindiziert bei Patienten mit:
Verabreichen Sie Aliskiren nicht zusammen mit PRINIVIL 5 mg bei Patienten mit Diabetes [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ]. PRINIVIL ist in Kombination mit einem Neprilysin-Inhibitor (z. B. Sacubitril) kontraindiziert. Verabreichen Sie PRINIVIL 2,5 mg nicht innerhalb von 36 Stunden nach der Umstellung auf oder von Sacubitril/Valsartan, einem Produkt, das einen Neprilysin-Inhibitor enthält [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Lisinopril hemmt das Angiotensin-Converting-Enzym (ACE) bei Menschen und Tieren. ACE ist eine Peptidyldipeptidase, die die Umwandlung von Angiotensin I in die vasokonstriktorische Substanz Angiotensin II katalysiert. Angiotensin II stimuliert auch die Aldosteronsekretion durch die Nebennierenrinde. Die vorteilhaften Wirkungen von Lisinopril bei Bluthochdruck und Herzinsuffizienz scheinen hauptsächlich aus der Unterdrückung des Renin-Angiotensinaldosteron-Systems zu resultieren. Die Hemmung von ACE führt zu einem verringerten Plasma-Angiotensin II, was zu einer verringerten vasopressorischen Aktivität und zu einer verringerten Aldosteronsekretion führt. Die letztere Abnahme kann zu einem geringen Anstieg des Serumkaliums führen. Bei hypertensiven Patienten mit normaler Nierenfunktion, die bis zu 24 Wochen lang mit PRINIVIL 10 mg allein behandelt wurden, betrug der mittlere Anstieg des Serumkaliums etwa 0,1 mÄq/l; jedoch hatten ca. 15 % der Patienten Anstiege von mehr als 0,5 mEq/l und ca. 6 % eine Abnahme von mehr als 0,5 mEq/l. In derselben Studie kam es bei Patienten, die bis zu 24 Wochen lang mit PRINIVIL 2,5 mg und Hydrochlorothiazid behandelt wurden, zu einer mittleren Abnahme des Serumkaliums um 0,1 mÄq/l; etwa 4 % der Patienten hatten einen Anstieg von mehr als 0,5 mEq/l und etwa 12 % einen Rückgang von mehr als 0,5 mEq/l [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Die Beseitigung der negativen Rückkopplung von Angiotensin II auf die Reninsekretion führt zu einer erhöhten Plasma-Renin-Aktivität.
ACE ist identisch mit Kininase, einem Enzym, das Bradykinin abbaut. Ob erhöhte Spiegel von Bradykinin, einem potenten Vasodepressor-Peptid, eine Rolle bei der therapeutischen Wirkung von PRINIVIL 5 mg spielen, muss noch geklärt werden.
Während angenommen wird, dass der Mechanismus, durch den PRINIVIL 2,5 mg den Blutdruck senkt, in erster Linie die Unterdrückung des Renin-Angiotensin-Aldosteron-Systems ist, wirkt PRINIVIL auch bei Patienten mit niedrigem Renin-Hypertonie blutdrucksenkend. Obwohl PRINIVIL 10 mg in allen untersuchten Rassen blutdrucksenkend wirkte, sprachen schwarze Bluthochdruckpatienten (normalerweise eine hypertensive Population mit niedrigem Renin) im Durchschnitt weniger gut auf die Monotherapie an als nicht-schwarze Patienten.
Die gleichzeitige Verabreichung von PRINIVIL 5 mg und Hydrochlorothiazid senkte den Blutdruck bei schwarzen und nicht-schwarzen Patienten weiter, und es war kein rassischer Unterschied in der Blutdruckreaktion mehr erkennbar.
Pharmakodynamik
Hypertonie
Erwachsene Patienten
Die Verabreichung von PRINIVIL an Patienten mit Hypertonie führt zu einer etwa gleichen Senkung des Blutdrucks im Liegen und im Stehen ohne kompensatorische Tachykardie. Eine symptomatische orthostatische Hypotonie wird normalerweise nicht beobachtet, obwohl sie bei Patienten mit Volumen- und/oder Salzmangel auftreten kann und erwartet werden sollte [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Bei gleichzeitiger Gabe mit Diuretika vom Thiazidtyp addieren sich die blutdrucksenkenden Wirkungen der beiden Arzneimittel annähernd.
Bei den meisten untersuchten Patienten wurde der Beginn der blutdrucksenkenden Wirkung eine Stunde nach oraler Gabe einer Einzeldosis von PRINIVIL beobachtet, wobei die maximale Blutdrucksenkung nach 6 Stunden erreicht wurde. Obwohl eine blutdrucksenkende Wirkung 24 Stunden nach der Verabreichung der empfohlenen täglichen Einzeldosen beobachtet wurde, war die Wirkung konsistenter und die mittlere Wirkung war in einigen Studien mit Dosen von 20 mg oder mehr beträchtlich größer als bei niedrigeren Dosen. Bei allen untersuchten Dosierungen war die mittlere antihypertensive Wirkung jedoch 24 Stunden nach der Einnahme wesentlich geringer als 6 Stunden nach der Einnahme.
Die blutdrucksenkende Wirkung von PRINIVIL bleibt während einer Langzeittherapie erhalten. Ein abruptes Absetzen von PRINIVIL 10 mg wurde nicht mit einem raschen Anstieg des Blutdrucks oder einem signifikanten Anstieg des Blutdrucks im Vergleich zu den Werten vor der Behandlung in Verbindung gebracht.
Pharmakokinetik
Erwachsene Patienten
Nach oraler Gabe von PRINIVIL treten Spitzenkonzentrationen von Lisinopril im Serum innerhalb von etwa 7 Stunden auf, obwohl bei Patienten mit akutem Myokardinfarkt eine Tendenz zu einer kleinen Verzögerung in der Zeit bestand, die benötigt wird, um Spitzenkonzentrationen im Serum zu erreichen. Abnehmende Serumkonzentrationen weisen eine verlängerte Endphase auf, die nicht zur Arzneimittelakkumulation beiträgt. Diese Endphase stellt wahrscheinlich eine sättigbare Bindung an ACE dar und ist nicht proportional zur Dosis. Bei Mehrfachdosierung weist Lisinopril eine effektive Halbwertszeit von 12 Stunden auf.
Lisinopril scheint nicht an andere Serumproteine gebunden zu sein. Lisinopril unterliegt keinem Metabolismus und wird unverändert vollständig mit dem Urin ausgeschieden. Basierend auf der Wiederfindung im Urin beträgt das mittlere Ausmaß der Resorption von Lisinopril etwa 25 Prozent, mit großer interindividueller Variabilität (6-60 Prozent) bei allen getesteten Dosen (5-80 mg). Die Resorption von Lisinopril wird durch die Anwesenheit von Nahrung im Magen-Darm-Trakt nicht beeinflusst. Die absolute Bioverfügbarkeit von Lisinopril ist bei Patienten mit stabiler dekompensierter Herzinsuffizienz der NYHA-Klassen II-IV auf etwa 16 Prozent reduziert, und das Verteilungsvolumen scheint geringfügig geringer zu sein als bei gesunden Probanden.
Die orale Bioverfügbarkeit von Lisinopril bei Patienten mit akutem Myokardinfarkt ist ähnlich wie bei gesunden Probanden.
Eine eingeschränkte Nierenfunktion verringert die Elimination von Lisinopril, das hauptsächlich über die Nieren ausgeschieden wird, aber diese Verringerung wird nur dann klinisch bedeutsam, wenn die glomeruläre Filtrationsrate unter 30 ml/min liegt. Oberhalb dieser glomerulären Filtrationsrate ändert sich die Eliminationshalbwertszeit kaum. Bei stärkerer Beeinträchtigung steigen jedoch die Spitzen- und Talspiegel von Lisinopril, die Zeit bis zum Erreichen der Spitzenkonzentration nimmt zu und die Zeit bis zum Erreichen des Steady State verlängert sich. Ältere Patienten haben im Durchschnitt (etwa doppelt so) höhere Blutspiegel und Flächen unter der Plasmakonzentrations-Zeit-Kurve (AUC) als jüngere Patienten [vgl DOSIERUNG UND ANWENDUNG ]. Lisinopril kann durch Hämodialyse entfernt werden.
Studien an Ratten weisen darauf hin, dass Lisinopril die Blut-Hirn-Schranke schlecht passiert. Mehrfachdosen von Lisinopril bei Ratten führten nicht zu einer Akkumulation in irgendeinem Gewebe. Milch säugender Ratten enthält nach Verabreichung von 14C-Lisinopril Radioaktivität. Durch Ganzkörper-Autoradiographie wurde Radioaktivität in der Plazenta nach Verabreichung des markierten Medikaments an trächtige Ratten gefunden, aber keine wurde in den Föten gefunden.
Pädiatrische Patienten
Die Pharmakokinetik von Lisinopril wurde bei 29 pädiatrischen Patienten mit Hypertonie zwischen 6 und 16 Jahren mit einer glomerulären Filtrationsrate > 30 ml/min/1,73 m² untersucht. Nach Dosierungen von 0,1 bis 0,2 mg/kg traten maximale Lisinopril-Plasmakonzentrationen im Steady State innerhalb von 6 Stunden auf, und das Ausmaß der Resorption, basierend auf der Wiederfindung im Urin, betrug etwa 28 %. Diese Werte ähneln denen, die zuvor bei Erwachsenen erhalten wurden. Der typische Wert der oralen Clearance von Lisinopril (systemische Clearance/absolute Bioverfügbarkeit) bei einem Kind mit einem Körpergewicht von 30 kg beträgt 10 l/h und steigt proportional zur Nierenfunktion.
Klinische Studien
Hypertonie
Erwachsene Patienten
Bei 438 Patienten mit leichtem bis mittelschwerem Bluthochdruck, die kein Diuretikum erhielten, wurden zwei Dosis-Wirkungs-Studien mit einmal täglicher Gabe durchgeführt. Der Blutdruck wurde 24 Stunden nach der Dosierung gemessen. Bei einigen Patienten wurde eine blutdrucksenkende Wirkung von PRINIVIL mit 5 mg beobachtet. In beiden Studien trat die Blutdrucksenkung jedoch früher ein und war stärker bei Patienten, die mit 10, 20 oder 80 mg PRINIVIL behandelt wurden. In kontrollierten klinischen Studien bei Patienten mit leichter bis mäßiger Hypertonie wurde PRINIVIL 20-80 mg mit Hydrochlorothiazid 12,5-50 mg und mit Atenolol 50-500 mg und bei Patienten mit mäßiger bis schwerer Hypertonie mit Metoprolol 100-200 mg verglichen. Es war Hydrochlorothiazid in seiner Wirkung auf den systolischen und diastolischen Blutdruck in einer Population, die zu 75 % aus Kaukasiern bestand, überlegen. PRINIVIL 10 mg entsprach ungefähr Atenolol und Metoprolol in Bezug auf die Wirkung auf den diastolischen Blutdruck und hatte eine etwas stärkere Wirkung auf den systolischen Blutdruck.
PRINIVIL hatte ähnliche Wirksamkeit und Nebenwirkungen bei jüngeren und älteren (>65 Jahre) Patienten. Es war bei Schwarzen weniger wirksam als bei Kaukasiern.
In hämodynamischen Studien mit PRINIVIL 5 mg bei Patienten mit essentieller Hypertonie ging die Blutdrucksenkung mit einer Verringerung des peripheren arteriellen Widerstands einher, bei geringer oder keiner Änderung des Herzzeitvolumens und der Herzfrequenz. In einer Studie mit neun Bluthochdruckpatienten kam es nach Verabreichung von PRINIVIL 5 mg zu einem nicht signifikanten Anstieg des mittleren renalen Blutflusses. Daten aus mehreren kleinen Studien sind in Bezug auf die Wirkung von Lisinopril auf die glomeruläre Filtrationsrate bei Bluthochdruckpatienten mit normaler Nierenfunktion widersprüchlich, deuten jedoch darauf hin, dass Änderungen, falls vorhanden, nicht groß sind.
Bei Patienten mit renovaskulärer Hypertonie hat sich PRINIVIL als gut verträglich und blutdrucksenkend erwiesen [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Pädiatrische Patienten
In einer klinischen Studie mit 115 hypertensiven pädiatrischen Patienten im Alter von 6 bis 16 Jahren erhielten Patienten mit einem Körpergewicht 1,25 mg (0,02 mg/kg) nachgewiesen wurde. Dieser Effekt wurde in einer Absetzphase bestätigt, in der der diastolische Druck bei Patienten, die randomisiert Placebo erhielten, um etwa 9 mmHg stärker anstieg als bei Patienten, die randomisiert auf mittlere und hohe Lisinopril-Dosen blieben. Die dosisabhängige blutdrucksenkende Wirkung von Lisinopril war über mehrere demografische Untergruppen hinweg konsistent: Alter, Tanner-Stadium, Geschlecht und Rasse. In dieser Studie wurde Lisinopril im Allgemeinen gut vertragen.
In den oben genannten pädiatrischen Studien wurde Lisinopril entweder als Tabletten oder als Suspension für jene Kinder und Säuglinge verabreicht, die keine Tabletten schlucken konnten oder eine niedrigere Dosis benötigten, als in Tablettenform erhältlich ist [siehe DOSIERUNG UND ANWENDUNG ].
Herzfehler
In zwei placebokontrollierten, 12-wöchigen klinischen Studien wurde die Zugabe von PRINIVIL 2,5 mg bis zu 20 mg täglich mit Digitalis und Diuretika allein verglichen. Die Kombination von PRINIVIL, Digitalis und Diuretika reduzierte die folgenden Anzeichen und Symptome einer Herzinsuffizienz: Ödeme, Rasseln, paroxysmale nächtliche Dyspnoe und Jugularvenenerweiterung. In einer der Studien reduzierte die Kombination von PRINIVIL 2,5 mg, Digitalis und Diuretika Orthopnoe, das Auftreten von dritten Herztönen und die Anzahl der Patienten, die als NYHA-Klassen III und IV eingestuft wurden, und verbesserte die Belastungstoleranz. Eine große (über 3000 Patienten) Überlebensstudie, die ATLAS-Studie, in der 2,5 und 35 mg Lisinopril bei Patienten mit systolischer Herzinsuffizienz verglichen wurden, zeigte, dass die höhere Lisinopril-Dosis Ergebnisse hatte, die mindestens so günstig waren wie die niedrigere Dosis. In grundlagenkontrollierten klinischen Studien führten Einzeldosen von PRINIVIL 5 mg bei Patienten, die Digitalis und Diuretika erhielten, zu einer Abnahme des pulmonalen Kapillarkeildrucks, des systemischen Gefäßwiderstands und des Blutdrucks, begleitet von einem Anstieg des Herzzeitvolumens und keiner Änderung der Herzfrequenz.
Akuter Myokardinfarkt
Die Studie Gruppo Italiano per lo Studio della Sopravvienza nell'Infarto Miocardico (GISSI-3) war eine multizentrische, kontrollierte, randomisierte, unverblindete klinische Studie, die an 19.394 Patienten mit akutem Myokardinfarkt (MI) durchgeführt wurde, die auf einer Koronarstation aufgenommen wurden. Es wurde entwickelt, um die Auswirkungen einer kurzfristigen (6 Wochen) Behandlung mit Lisinopril, Nitraten, deren Kombination oder keiner Therapie auf die kurzfristige (6 Wochen) Mortalität und auf den langfristigen Tod und eine deutlich eingeschränkte Herzfunktion zu untersuchen. Hämodynamisch stabile Patienten, die sich innerhalb von 24 Stunden nach Beginn der Symptome vorstellten, wurden in einem 2 x 2-faktoriellen Design randomisiert zu 6 Wochen mit entweder 1) PRINIVIL allein (n = 4841), 2) Nitraten allein (n = 4869), 3 ) PRINIVIL 2,5 mg plus Nitrate (n = 4841) oder 4) offene Kontrolle (n = 4843). Alle Patienten erhielten Routinetherapien, darunter Thrombolytika (72 %), Aspirin (84 %) und einen Betablocker (31 %), die normalerweise bei Patienten mit akutem Myokardinfarkt (MI) angewendet werden.
Das Protokoll schloss Patienten mit Hypotonie (systolischer Blutdruck ≤ 100 mmHg), schwerer Herzinsuffizienz, kardiogenem Schock und Nierenfunktionsstörung (Serumkreatinin > 2 mg/dl und/oder Proteinurie > 500 mg pro 24 h) aus. Patienten, die auf PRINIVIL 5 mg randomisiert wurden, erhielten 5 mg innerhalb von 24 Stunden nach Auftreten der Symptome, 5 mg nach 24 Stunden und danach 10 mg täglich. Patienten mit einem systolischen Blutdruck von weniger als 120 mmHg zu Studienbeginn erhielten 2,5 mg PRINIVIL. Wenn eine Hypotonie auftrat, wurde die Dosis von PRINIVIL 10 mg reduziert oder wenn eine schwere Hypotonie auftrat, wurde PRINIVIL abgesetzt [siehe DOSIERUNG UND ANWENDUNG ].
Die primären Ergebnisse der Studie waren die Gesamtsterblichkeit nach 6 Wochen und ein kombinierter Endpunkt nach 6 Monaten nach dem Myokardinfarkt, bestehend aus der Anzahl der Patienten, die starben, eine späte (Tag 4) klinische dekompensierte Herzinsuffizienz oder eine ausgedehnte linksventrikuläre Herzinsuffizienz hatten Schädigung definiert als Ejektionsfraktion ≤ 35 % oder ein akinetisch-dyskinetischer [AD]-Score ≥ 45 %. Patienten, die PRINIVIL (n = 9646), allein oder mit Nitraten, erhielten, hatten ein um 11 % geringeres Sterberisiko (p = 0,04) im Vergleich zu Patienten, die PRINIVIL nicht erhielten (n = 9672) (6,4 % vs. 7,2 %). mit 6 wochen. Obwohl Patienten, die randomisiert PRINIVIL für bis zu 6 Wochen erhielten, auch beim kombinierten Endpunkt nach 6 Monaten numerisch besser abschnitten, lagen die offene Art der Beurteilung der Herzinsuffizienz, der erhebliche Verlust an Echokardiographie und die erhebliche übermäßige Anwendung von PRINIVIL 10 mg dazwischen 6 Wochen und 6 Monate in der Gruppe, die auf 6 Wochen Lisinopril randomisiert wurde, schließen jegliche Schlussfolgerung zu diesem Endpunkt aus.
Patienten mit akutem Myokardinfarkt, die mit PRINIVIL 10 mg behandelt wurden, hatten eine höhere (9,0 % versus 3,7 %) Inzidenz von anhaltender Hypotonie (systolischer Blutdruck NEBENWIRKUNGEN ].
INFORMATIONEN ZUM PATIENTEN
HINWEIS: Diese Informationen sollen bei der sicheren und wirksamen Anwendung dieses Medikaments helfen. Es handelt sich nicht um eine Offenlegung aller möglichen nachteiligen oder beabsichtigten Wirkungen.
Schwangerschaft
Informieren Sie Patientinnen im gebärfähigen Alter über die Folgen einer Exposition gegenüber PRINIVIL 10 mg während der Schwangerschaft. Besprechen Sie Behandlungsmöglichkeiten mit Frauen, die eine Schwangerschaft planen. Sagen Sie den Patientinnen, dass sie Schwangerschaften so schnell wie möglich ihrem Arzt melden sollen.
Angioödem
Angioödeme, einschließlich Kehlkopfödeme, können jederzeit während der Behandlung mit Angiotensin-Converting-Enzym-Hemmern, einschließlich PRINIVIL, auftreten. Weisen Sie die Patienten an, sofort alle Anzeichen oder Symptome zu melden, die auf ein Angioödem hindeuten (Schwellung von Gesicht, Extremitäten, Augen, Lippen, Zunge, Schluck- oder Atembeschwerden) und kein Medikament mehr einnehmen, bis sie den verschreibenden Arzt konsultiert haben.
Symptomatische Hypotonie
Weisen Sie die Patienten darauf hin, dass sie insbesondere in den ersten Tagen der Therapie über Benommenheit berichten sollen. Wenn tatsächlich eine Synkope auftritt, sagen Sie dem Patienten, dass er das Medikament absetzen soll, bis er den verschreibenden Arzt konsultiert hat.
Informieren Sie die Patienten darüber, dass übermäßiges Schwitzen und Austrocknung aufgrund der Verringerung des Flüssigkeitsvolumens zu einem übermäßigen Abfall des Blutdrucks führen können. Auch andere Ursachen für einen Volumenmangel wie Erbrechen oder Durchfall können zu einem Abfall des Blutdrucks führen; Patienten entsprechend beraten.
Hyperkaliämie
Weisen Sie die Patienten darauf hin, keine kaliumhaltigen Salzersatzstoffe zu verwenden, ohne ihren Arzt zu konsultieren.
Hypoglykämie
Weisen Sie Diabetiker, die mit oralen Antidiabetika oder Insulin behandelt werden und mit einem ACE-Hemmer beginnen, an, engmaschig auf Hypoglykämie zu achten, insbesondere während des ersten Monats der kombinierten Anwendung [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Leukopenie/Neutropenie
Weisen Sie die Patienten an, unverzüglich alle Anzeichen einer Infektion (z. B. Halsschmerzen, Fieber) zu melden, die ein Zeichen von Leukopenie/Neutropenie sein können.